IMDRF《健康影响-临床体征、症状及状态术语与代码》浅析*
2019-09-26李志勇崔泽实
董 放 赵 燕 李志勇 崔泽实
医疗器械不良事件报告术语标准化问题一直受到国际组织和一些国家的广泛关注,并投入力量进行研究[1-3].我国国家药品监督管理局药品评价中心组织行业协作于2017年完成了医疗器械不良事件相关《医疗器械故障术语集》与《医疗器械伤害(表现)术语集》编制研究,术语集分为层级结构公共术语集、术语注释两个版本[4].2018年,药品评价中心医疗器械部又组织研究完成了《医疗器械不良事件器械故障术语导引模版》和《医疗器械不良事件器械-可疑伤害术语导引模版》数据库的编制,同时以主(干)词表形式再版两个术语集的层级结构公共术语及代码,并加载国家医疗器械不良事件监测系统上线运行[5-6].国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)分别于2017年3月及9月先后发布了两个版本属于不良事件报告(adverse event reporting,AER)术语项下的附件A《医疗器械问题术语与代码(Annex A: Medical Device Problem Terms and Codes)》[7];在2019年3月21日,又发布了第3版的《医疗器械问题术语与代码》,同时还发布了附件E《健康影响-临床体征、症状及状态术语与代码(Annex E:Health Effect-Clinical Signs, Symptoms and Conditions Terms and Codes)》及附件F《健康影响-健康影响术语与代码(Annex F:Health Effect-Health Impact Terms and Codes)》[7].本研究对我国国家药品监督管理局药品评价中心《医疗器械伤害(表现)术语集》与IMDRF《临床体征、症状与状态术语》进行对比分析,评估两者的关联性和对接程度,为国际交流与信息互通提供依据.
1 材料与方法
国家药品监督管理局药品评价中心《医疗器械伤害(表现)术语集》;IMDRF的AER术语附件E《健康影响-临床体征、症状及状态术语与代码》以及附件F《健康影响-健康影响术语与代码》.比较分析两个医疗器械不良事件术语体系在命名、术语分类、术语结构及编码等参量的关联性与对接程度,计量两个术语的术语项.
2 结果
2.1 术语集名称
IMDRF在2017年9月发布第2版"AER术语:术语、术语结构和代码(IMDRF terminologies for categorized Adverse Event Reporting: terms,terminology structure and codes)"文件中提到将要开展的附件E研究计划是使用了"患者问题术语(patient problem terms)"一词.而IMDRF新发布的附件E系以《临床体征、症状与状态术语》命名标题,但在表头上注释"在适当情况下'患者'应包括受试者、操作员或受事件影响的任何其他人".并强调:附件E意在为不良事件上报者提供一份医疗器械不良事件对健康影响相关的临床体征、症状和状态术语清单,其颗粒度足以从中捕捉到运用于医疗器械不良事件报告中对健康影响的术语;同时,从通用性出发避免了与其他综合术语系统重复,允许在不使用诊断检测手段的情况下,表述通过观察捕捉到的与医疗器械不良事件相关的体征和症状以及结果,而且不是用于描述不良事件之前就存在的体征、症状和状态.IMDRF在术语集名称上没有直接采用"伤害"一词,但实际上附件E中的具体术语词仍有明确的伤害用词,如E01神经系统中的E0102脑损伤(brain injury)等.
美国食品药品管理局(Food and Drug Administration,FDA)网站之前曾发布过《患者问题层次结构术语代码》(patient problem code Hierarchy,PPC Hierarchy)[8].在未做出确切的医学诊断前,把可疑医疗器械不良事件导致的相关伤害统称为"问题"有其较合理的一面,IMDRF附件E的注释与此趋同,但将受到医疗器械不良事件伤害的"操作人员或受事件影响的任何其他人"也均视为"患者",值得商榷.
我国国家市场监督管理总局和国家卫生健康委员会于2018年8月13日联合下发的《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号)中定义"医疗器械不良事件,是指已上市的医疗器械,在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件"[9].国家药品监督管理局药品评价中心2017年版《医疗器械伤害(表现)术语集》直接采用了"伤害术语"或"伤害(表现)术语"命名,应当是基于与医疗器械不良事件定义的一致性.
2.2 术语分类与术语词量
2.2.1 术语分类
IMDRF AER术语附件E《健康影响-临床体征、症状及状态术语与代码》以及附件F《健康影响-健康影响术语与代码》,系与国际人用药品注册技术协调会(International Council for Harmonization,ICH)的监管活动医学词典(Medical Dictionary for Regulatory Activities, MedDRA)工作组之间密切合作,以E01~E24为一级代码设置了"神经系统、精神情感与行为紊乱、血液与淋巴系统、免疫系统、血管系统、心脏、呼吸系统、眼、耳鼻喉、胃肠系统、肝胆系统、代谢与营养、肾脏与泌尿道、生殖系统与乳腺、妊娠分娩与产后期、骨骼肌肉系统、皮肤与皮下组织、良恶性肿瘤或非特指、感染、损伤、操作并发症、研究与诊断检测、综合性紊乱和其他"共24类.可见IMDRF原则上是以临床体征、症状及状态所归属的系统或器官以及生理问题分类,并与MedDRA术语的子集保持一致.
我国2017版《医疗器械伤害(表现)术语集》的分类是根据所涉及伤害术语的集中度、参考《ICD-10疾病和有关健康问题的国际统计分类》[10]以及国家药品监督管理局在2017年8月发布的新版《医疗器械分类目录》分类的临床应用与临床学科特征,归纳为22类.
2.2.2 术语层级结构与代码
IMDRF附件E《健康影响-临床体征、症状及状态术语与代码》的术语编码结构同附件A《医疗器械问题术语与代码(Annex A: Medical Device Problem Terms and Codes)》,采用2位1~3段编码,前加"E"引导词(与附录排序"E"对应):E|00[00][00].术语层级结构为3级,一级是主分类词,再按二级、三级细分,见图1.

图1 IMDRF术语的层级结构与代码
我国2017版《医疗器械伤害(表现)术语集》为三级层级结构,采用2位3段编码,为避免与其他编码混淆,在代码前加"M(Medical)"为引导词,但采用全6位3段编码,见图2.

图2 我国《医疗器械伤害(表现)术语集》的层级结构与代码
由图1、图2可见,两个术语集均为三级层级结构(逻辑树状),除代码引导词不同外,均采用2位3段编码.IMDRF对应标注了MedDRA.我国2017版《医疗器械伤害(表现)术语集》标注了ICD-10代码,对接原国家卫生计生委"医疗机构在病案书写中统一使用ICD-10"的要求[11].
对在多个类别中共同使用的术语,IMDRF采取了分别插入到相应类别列出的方式,目的是"便于查找";但在此种情况下,每个重复的术语将只根据其主要类别分配一个唯一的代码.
2.2.3 术语词量
IMDRF AER术语附件E《健康影响-临床体征、症状及状态术语与代码》使用了592个专类术语词、他类互用词152频次,分布在24个一级类别中;我国国家药品评价中心2017版《医疗器械伤害术语集》分为22个一级类别,968个术语词.两者比较,结果见表1.
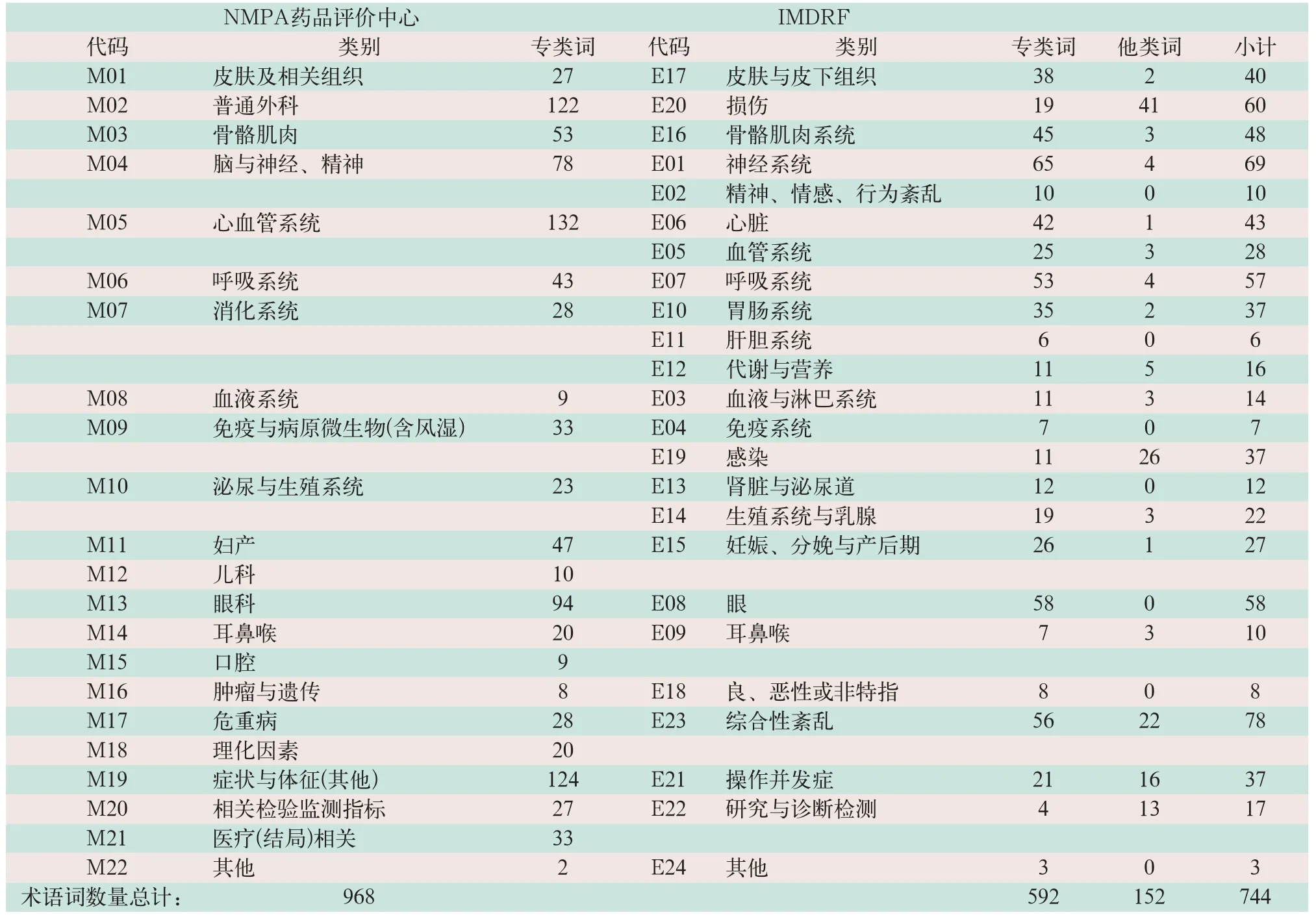
表1 国家药品评价中心术语与IMDRF术语的分类及词量比较
表1显示,两者分类基本相近,我国伤害术语的22类中有14类在名称与内容上与IMDRF基本一致、有20类的术语内容可基本对应IMDRF的22类,而IMDRF另设的"E21操作并发症"及"E23综合性紊乱"两类也基本上渗透在我国伤害术语的多个相关类别中;但"儿科""口腔"2类在IMDRF术语中无对应类别(但有部分相同术语词分布其他类别中).我国在编制伤害(表现)术语时注意到与我国医院分诊的临床学科实际相结合,如乳腺疾病多归属普外科或另设有乳腺外科,故将乳腺相关伤害(表现)术语归在普通外科类;国家药品监督管理局药品评价中心医疗器械不良事件报告数据库中症状与体征术语多见,而这些症状与体征涉及到多个学科、公共性较强,故单列一类,便于报告者查找;而IMDRF附录E就以"临床体征、症状和状态术语"命题.
2.3 IMDRF健康影响术语与代码
IMDRF新发布的附件F《健康影响-健康影响术语与代码》用于表述医疗器械不良事件对人产生影响的后果.后果包括最终的患者结局和(或)根据附件E中临床体征、症状和状态所需的干预或措施,术语代码以F为首字头,设置3级分层结构并分别以2位1段至2位3段数字编码,见表2.
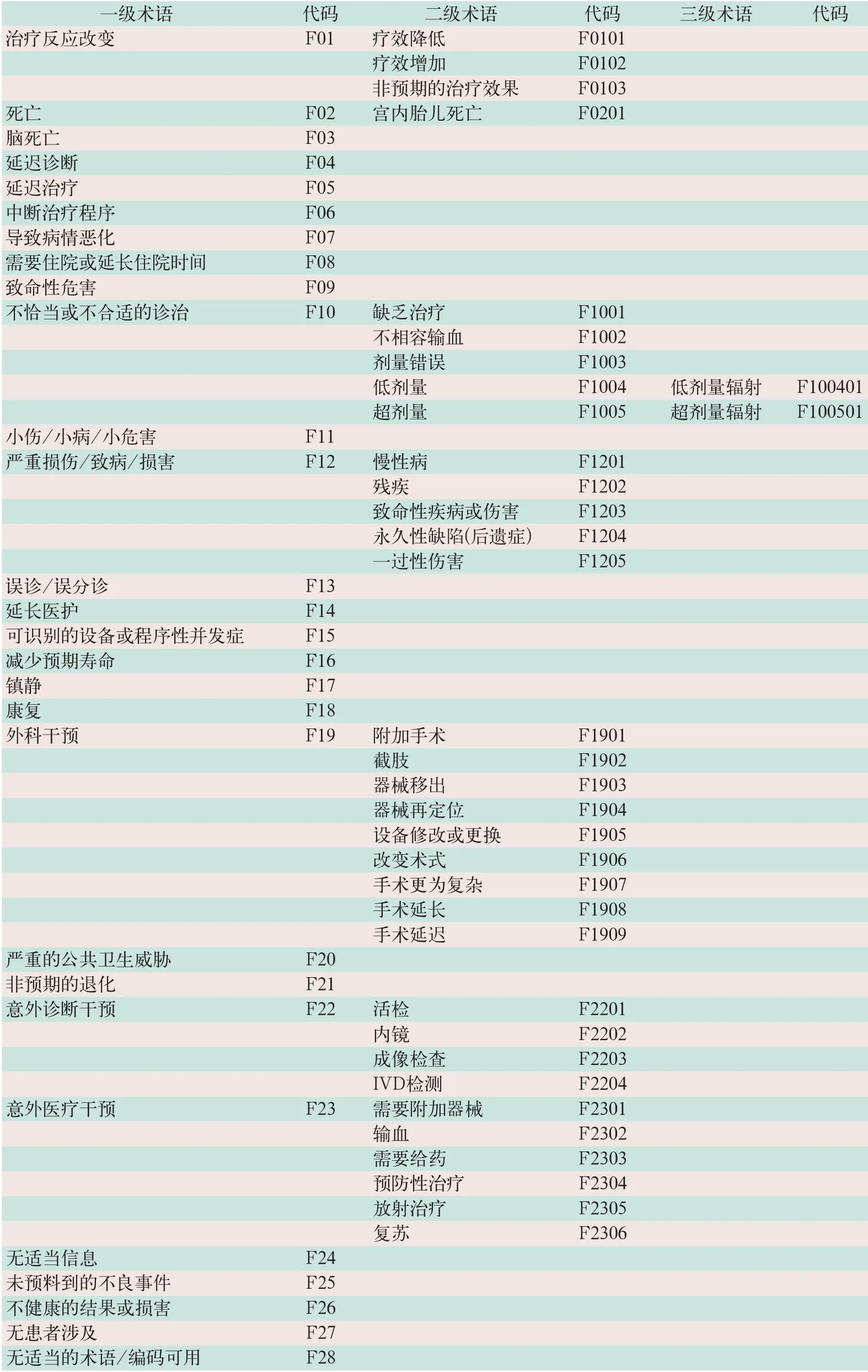
表2 IMDRF附录F健康影响术语的层级结构与代码
目前,其他国际或区域性组织对医疗器械不良事件仅有一个概括性的定义,大致划分出伤害程度.IMDRF AER术语附件F健康影响术语,实际上可以视为是根据国际上医疗器械不良事件定义对其结局性质的进一步细化表述,以此便于分类统计,值得借鉴.
3 讨论
3.1 规范术语是提升上市后监管质量的重要路径
现代医疗器械技术在从整体上驱动卫生健康事业进步的同时,还在促进新临床医学学科生成、助力传统医学模式改革及转变临床医学技术流程等方面发挥着重要作用[12-13].但医疗器械是一把双刃剑,所引发的应用安全问题也愈来愈受到广泛关注[14].建立医疗器械报告(medical device reporting,MDR)制度,加强医疗器械不良事件监管是保障医疗器械应用安全、增进产品质量的重要措施;而通过规范MDR不良事件术语是提升医疗器械上市后监管质量的有效路径,已成为国际共识.20世纪末至今,美国、部分欧洲国家、加拿大、中国、日本等国以及国际标准化组织(International Organization for Standardization,ISO)、IMDRF等国际组织先后开展了MDR不良事件术语研究,分别取得了各具特色的研究进展.我国编制医疗器械不良事件报告《医疗器械故障术语集》与《医疗器械伤害(表现)术语集》两个术语集的基础上,又完成了《医疗器械不良事件器械故障术语导引模版》和《医疗器械不良事件器械-可疑伤害术语导引模版》数据库构建,是MDR术语体系的一种创新形式,为MDR报告者提供了一个高效、便捷的工具数据源.另一方面,人们寄托对积累的MDR数据进行大数据分析,深入开展医疗器械不良事件循证研究,而规范MDR术语是有效利用MDR大数据的前提条件.
3.2 MDR术语的国际协同是必然趋势
医疗器械产业的国际化以及国际医疗器械区域市场的相互渗透映射出各国的医疗器械上市后监管具有一定趋同性,因此需要加强医疗器械不良事件监管的国际间协同,这也是组建IMDRF的初衷之一.因此,编制MDR不良事件术语需要考虑与国际术语体系的对接和数据交互.2019年起,美国FDA网站发布"FDA目前正在参与IMDRF不良事件报告术语工作组,旨在增进与国际监管机构之间在医疗器械不良事件编码上的工作协调,MDRF工作组正在迭代生成新的代码集并发布到IMDRF文档库中.FDA计划更新相应的FDA代码集,以与新的IMDRF代码集相协调,一旦IMDRF工作组发布了完整IMDRF代码集的初始版本,FDA计划更新其EMDR系统以接受IMDRF代码,将当前使用的FDA、NCIT术语编码与IMDRF编码系统实现对应每个代码的一对一映射转换",并声称作为参与国际协调工作的一部分,FDA不再根据制造商的要求添加新的不良事件代码,制造商和其他利益相关者如希望要求添加新的不良事件代码,应根据IMDRF代码的申请流程.我国在编写医疗器械不良事件报告术语时就制定了"专业性、可行性、规范性、可接受性、对接性"原则,与IMDRF新发布的医疗器械报告术语附件E《健康影响-临床体征、症状与状态术语》的比较研究表明,在术语的分类、层级结构上有较大的相近程度,也为国际信息交流及工作协同奠定了基础.
4 结论
我国国家药品监督管理局药品评价中心先期编制的《医疗器械伤害(表现)术语集》在结合我国医疗器械不良事件监管实际的基础上,术语的分类与架构基本上与IMDRF新发布的AER术语附件E《健康影响-临床体征、症状及状态术语与代码》相近,具有可对接性.在此研究基础上,有必要进一步开展对每个术语项的一致性、术语词定义及注释的兼容程度等的研究,绘制两个术语与代码的关联图谱.
