广枣提取物对内质网应激参与的大鼠酒精性肝损伤的保护作用
2019-09-25刘霞廖梅香范小娜
刘霞 廖梅香 范小娜
[摘要]目的 研究廣枣提取物(CAE)干预对酒精性肝病大鼠血脂代谢、肝细胞凋亡及内质网应激(ERS)相关蛋白表达的影响。方法 将60只雄性Wistar大鼠随机分为正常对照组(A组)、模型组(B组)、CAE低剂量组(C组)、CAE中剂量组(D组)、CAE高剂量组(E组)和阳性对照组(F组,益肝灵片),每组各10只。采用梯度浓度酒精、分次少量灌胃的方法建立大鼠慢性酒精性肝病模型,同时给予CAE保护。干预8周后测定各组的三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离脂肪酸(FFA)水平,观察各组的肝细胞GRP78/Caspase3比值及凋亡情况。结果 B、C、D、E、F组的TG、TC、LDL-C、FFA水平均高于A组,B、C、D、E组的HDL-C水平均低于A组,差异有统计学意义(P<0.01或P<0.05);F组与A组的HDL-C水平比较,差异无统计学意义(P>0.05);C、D、E、F组的TG、TC、FFA、LDL-C水平均低于B组,D、E、F组的HDL-C水平均高于B组,差异有统计学意义(P<0.01);C组与B组的HDL-C水平比较,差异无统计学意义(P>0.05)。B组的肝细胞凋亡率显著高于A组,差异有统计学意义(P<0.01);C、D、E组的肝细胞凋亡率均显著低于B组,差异有统计学意义(P<0.01)。B组的肝细胞GRP78/Caspase3比值显著低于A组,差异有统计学意义(P<0.01);D、E组的肝细胞GRP78/Caspase3比值均显著高于B组,差异有统计学意义(P<0.01);C组的肝细胞GRP78/Caspase3比值高于B组,但差异无统计学意义(P>0.05)。HE染色显示CAE能明显改善大鼠肝脏组织病变范围与程度,使炎性细胞浸润减少。结论 CAE保肝功效可能与其抗氧化活性和阻制ERS诱导的肝细胞凋亡有关。
[关键词]广枣提取物;内质网应激;酒精性肝病;大鼠
[中图分类号] R285.5 [文献标识码] A [文章编号] 1674-4721(2019)7(c)-0008-04
[Abstract] Objective To investigate the effect of Choerospondias Axillaries extracts (CAE) intervention on blood lipid metabolism, hepatocyte apoptosis and endoplasmic reticulum stress (ERS)-related protein expression in rats with alcoholic liver disease. Methods Sixty male Wistar rats were randomly divided into normal control group (group A), model group (group B), CAE low dose group (group C), CAE middle dose group (group D), CAE high dose group (group E) and positive control group (group F, Yiganling Tablets), 10 rats in each group. After 8 weeks of intervention, the levels of triglyceride (TG), total cholesterol (TC), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol (HDL-C), and free fatty acid (FFA) were determined. The ratio of GRP78/Caspase3 and apoptosis in hepatocytes were observed. Results The levels of TG, TC, LDL-C and FFA in group B, C, D, E and F were higher than those in group A, and the levels of HDL-C in group B, C, D and E were lower than those in group A, with statistically significant differences (P<0.01 or P<0.05). There was no significant difference in HDL-C level between group F and group A (P>0.05). The levels of TG, TC, FFA and LDL-C in group C, D, E and F were lower than those in group B, the HDL-C levels in group D, E and F were higher than those in group B, and the differences were statistically significant (P<0.01). There was no significant difference in HDL-C level between group C and group B (P>0.05). The apoptosis rate of hepatocytes in group B was significantly higher than that in group A, and the difference was statistically significant (P<0.01). The apoptotic rate of hepatocytes in group C, D and E was significantly lower than that in group B, and the differences were statistically significant (P<0.01). The ratio of GRP78/Caspase3 of hepatocytes in group B was significantly lower than that in group A, and the difference was statistically significant (P<0.01). The ratio of GRP78/Caspase3 of hepatocytes in group D and E was significantly higher than that in group B, and the difference was statistically significant (P<0.01). The ratio of GRP78/Caspase3 of hepatocytes in group C was higher than that in group B, but the difference was not statistically significant (P>0.05). HE staining showed that CAE could significantly improve the range and extent of liver tissue lesions in rats, and reduce inflammatory cell infiltration. Conclusion The liver-protecting effect of CAE may be related to its antioxidant activity and inhibition of ERS-induced hepatocyte apoptosis.
[Key words] Choerospondias Axillaries extracts; Endoplasmic reticulum stress; Alcoholic liver disease; Rats
酒精性肝病(ALD)是由于长期大量饮酒而导致的肝脏病变。随着社会对乙醇需求量的增加,ALD的发病率和死亡率大幅度提高[1-2]。其中,酒精性脂肪肝、酒精性肝炎、酒精性肝硬化是三种最常见的肝损伤,其经常同时并存并相互转化[3-5]。ALD严重危害人民健康,从丰富的中药资源中,筛选、研制出对防治ALD有确切疗效的药物,并在临床上推广应用,是学者们研究的焦点。中药主要通过发挥其抗氧化作用和清除有害自由基来达到保肝作用[6-7]。各种中药抗氧化剂可针对氧化刺激多个相关环节,发挥抗酒精性肝损害的作用。
本课题组前期研究工作揭示对酒精性肝损伤大鼠,广枣提取物(CAE)起到了保护肝细胞免受自由基损伤的作用[8],但具体作用机理还不是很明确,本研究以大鼠为对象制备酒精肝损伤模型,观察CAE干预后的效果,并探讨部分机制。
1材料与方法
1.1主要试剂
广枣药材(毫州市中药饮片厂,批号:130426),经赣南医学院药学院中药鉴定教研室程齐来教授鉴定;益肝灵片(广州白云山制药总厂,批号:4060001);三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和游离脂肪酸(FFA)试剂盒(上海晨易生物科技有限公司);鼠抗兔抗GRP78、Caspase3(美国Santa Cruz公司);TUNEL凋亡原位检测试剂盒(南京凱基生物科技发展有限公司);无水乙醇(分析纯,西陇科学股份有限公司)。
1.2材料
同批雄性Wistar大鼠60只,购于江西中医药大学动物中心,动物合格证号:(赣)2013-0031。
1.3模型构建及给药方案
将60只大鼠随机分为正常对照组(A组)、模型组(B组)、CAE低剂量组(C组)、CAE中剂量组(D组)、CAE高剂量组(E组)和阳性对照组(F组),共计6组,每组各10只。除A组外,其他组自由饮用5%的乙醇3 d,第4天改为10%的乙醇,以后每隔1周增加2%,直至18%,然后在每周增加1%直至22%。B组从饮用22%的乙醇当天开始,以54%乙醇灌胃,1.2 ml,3次/d,持续8周。C、D、E组乙醇灌胃同时,从饮用54%乙醇的当天起,每天灌胃1次CAE,分别为0.3、0.6、1.2 g/kg,持续8周。F组将益肝灵片研磨之后溶于蒸馏水中按100 mg/kg的标准灌胃,灌胃方法和时间与B组相同。A组自由饮用自来水,用生理盐水灌胃,灌胃方法和时间同上。
1.4检测指标及方法
1.4.1生化指标测试 各组血液中的TG、TC、HDL-C、LDL-C及FFA含量使用全自动生化分析仪检测,以上各指标测定均按照相关试剂盒说明书进行。
1.4.2肝组织病理学观察 将肝组织用10%的中性福尔马林溶液固定,石蜡包埋,HE染色,在光镜下观察肝组织病理学情况。肝组织病理学改变判断标准[9]:正常肝细胞为阴性(-);肝细胞点状坏死为轻度(+);肝细胞灶状坏死为中度(++);肝小叶<1/3肝细胞坏死为重度(+++);肝小叶>1/3肝细胞坏死为极重度(++++)。
1.4.3 TUNEL法观察肝细胞凋亡情况 TUNEL法严格按照试剂盒说明书进行规范操作。选取LEICA DMi8倒置荧光显微镜观察,在高倍镜下随意选取5个视野,对大鼠肝脏内的阳性细胞进行计数,计算阳性率平均值。
1.4.4蛋白免疫印记(Western blot)检测蛋白表达 取100 mg肝组织,加入1 ml的RIPA和10 μl 100 mmol/L的甲苯基磺酰氟(PMSF)和10 μl的磷酸酶抑制剂后,用组织匀浆器匀浆、高速离心,将上清液转移到无菌离心试管中,并于-20℃冰箱储存。取肝组织裂解物,加入电泳缓冲液,电泳(5%浓缩胶90 V,12%分离胶110 V,非稳态电流)持续时间约1.5 h。分离胶被转移到膜(90 V,90 min),打开电转仪,取出硝酸纤维素膜(NC),用去离子水冲洗,洗液平衡后用5%脱脂奶粉溶液室温密闭30 min,再4℃过夜,滴加已稀释好的GRP78、Caspase3抗体,放入4℃冰箱过夜,用PBS反复清洗膜,再滴加5 ml二抗工作液,37℃的条件下反应约1 h,用吸水纸吸干膜上PBS,加入ECL化学发光试剂,待完全浸泡后,置于胶片上,并覆上保鲜膜,置于X线暗箱内,应用凝胶电泳图像分析软件系统以胶片中灰度值的比值(蛋白质带中的灰度值/内部参数β-action灰度值)表示。
1.5统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1一般情况观察
A组大鼠活动、饮食正常,无死亡现象;B组大鼠经乙醇灌胃后先处于兴奋状态,后续出现行动不稳、食量降低、四肢无力、嗜睡等现象;与B组比较,各干预组大鼠均有不同程度的改善。整个造模期间,A组无死亡,B、C、D组均有2只大鼠死亡,E组和F组各有1只大鼠死亡。
2.2各组大鼠血脂水平的比较
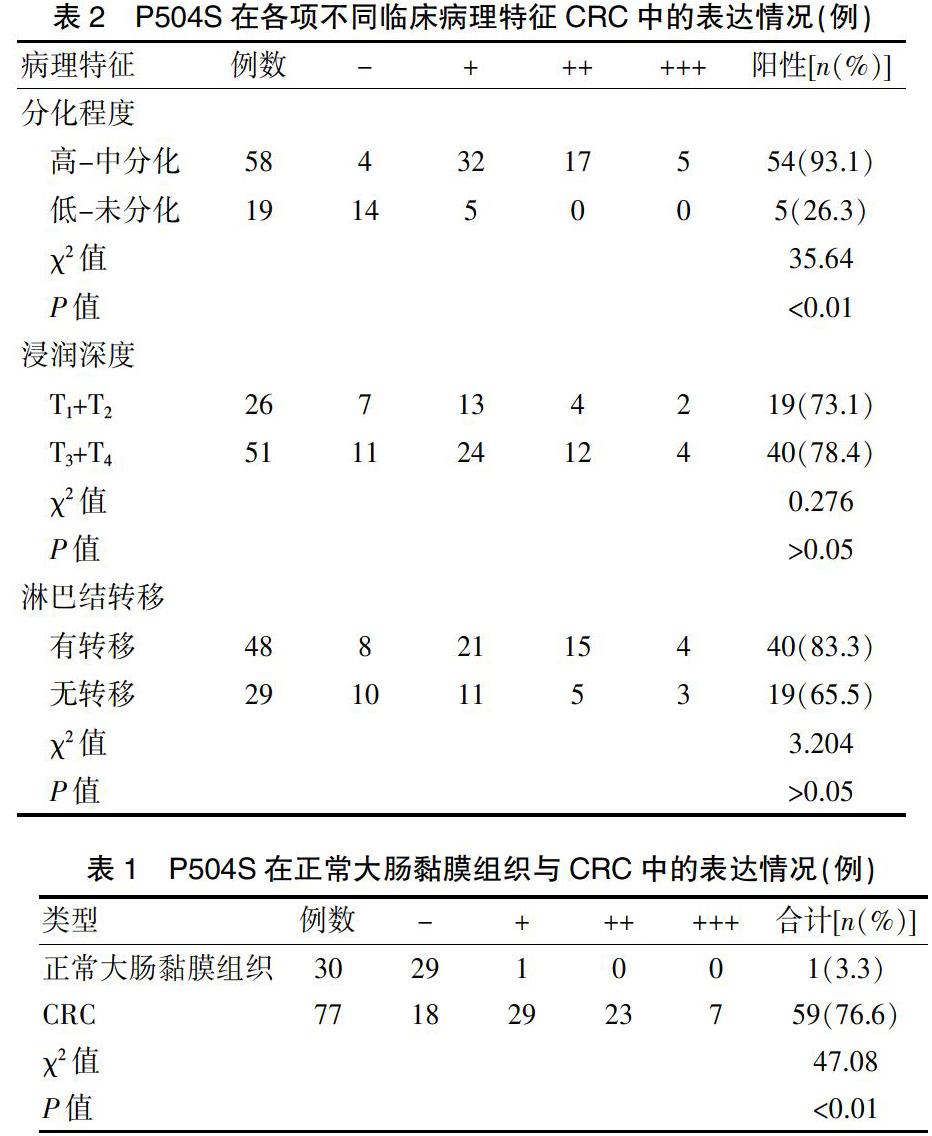
B、C、D、E、F组的TG、TC、LDL-C、FFA水平均高于A组,B、C、D、E组的HDL-C水平均低于A组,差异有统计学意义(P<0.01或P<0.05);F组与A组的HDL-C水平比较,差异无统计学意义(P>0.05);C、D、E、F组的TG、TC、FFA、LDL-C水平均低于B组,D、E、F组的HDL-C水平均高于B组,差异有统计学意义(P<0.01);C组与B组的HDL-C水平比较,差异无统计学意义(P>0.05);其他各组比较,差异无统计学意义(P>0.05)(表1)。
2.3各组大鼠HE染色肝组织病理学观察
光镜下观察:正常肝细胞(A组)呈放射状排列,肝小叶组织结构完整,肝细胞大小正常,胞质均匀分布。B组大鼠肝小叶和肝细胞索消失,肝细胞排列无序,胞浆空泡化、核淡染;脂肪融合大空泡的出现把胞核挤到一边。同时,汇管区有炎细胞浸润。F组肝细胞轻度水肿,肝细胞形态基本规则,炎性细胞浸润及脂肪变性程度明显减轻。C组大鼠肝小叶内可见弥漫性脂肪泡分布,细胞内可见数量不等的脂滴,并伴有坏死和炎性细胞浸润。D组肝细胞体积增加稍有减轻,细胞内有少许脂肪空泡,伴有坏死和炎性细胞浸润。E组大鼠肝小叶清晰,肝细胞索可见,脂肪空泡数目明显减少,细胞变性坏死等现象基本消失。
2.4各组大鼠肝细胞凋亡率的比较
A组大鼠肝细胞凋亡细胞数目极少。B组的肝细胞凋亡率显著高于A组,差异有统计学意义(P<0.01);C、D、E组的肝细胞凋亡率均显著低于B组,差异有统计学意义(P<0.01);其他各组比较,差异无统计学意义(P>0.05)。随着给药剂量越大,凋亡指数下降趋势越明显(图1)。
2.5各组大鼠肝组织GRP78/Caspase3比值的比较
B组的肝细胞GRP78/Caspase3比值显著低于A组,差异有统计学意义(P<0.01);D、E组的肝细胞GRP78/Caspase3比值均显著高于B组,差异有统计学意义(P<0.01);C组的肝细胞GRP78/Caspase3比值高于B组,但差异无统计学意义(P>0.05);其他各组比较,差异无统计学意义(P>0.05)(图2)。
3讨论
ALD发生机制较复杂,所涉及的致病因子有很多,除酒精及其代谢物的直接毒性损伤外,还包括过敏原的刺激、炎性介质、氧化应激反应、凋亡和免疫性损害等,其可结合起来共同诱导ALD[10-14]。肝细胞中含有大量的内质网,病毒性肝炎、中毒性肝损伤等多种肝脏疾病的发病机制均与内质网应激(ERS)有密切的联系[15-16]。由于ALD中,高同型半胱氨酸血症可作为重要的应激源通过引起氧化应激来诱导ERS的发生,因而,ERS在ALD发病机制中的作用越来越受到研究者的关注[17-20]。
本研究结果显示,B、C、D、E、F组的TG、TC、LDL-C、FFA水平均高于A组,B、C、D、E组的HDL-C水平均低于A组,差异有统计学意义(P<0.01或P<0.05);F组与A组的HDL-C水平比较,差异无统计学意义(P>0.05);C、D、E、F组的TG、TC、FFA、LDL-C水平均低于B组,D、E、F组的HDL-C水平均高于B组,差异有统计学意义(P<0.01);C组与B组的HDL-C水平比较,差异无统计学意义(P>0.05)。提示酒精能导致体内血酯水平异常,而CAE有一定程度的降脂功效,CAE能更有效地改善ALD大鼠脂代谢紊乱,加速了脂代谢,降低血清FFA水平。
采用Western blot检测大鼠血清中的GRP78、Caspase3蛋白表达水平,结果提示,B组的肝细胞GRP78/Caspase3比值显著低于A组,差异有统计学意义(P<0.01);D、E组的肝细胞GRP78/Caspase3比值均显著高于B组,差异有统计学意义(P<0.01);C组的肝细胞GRP78/Caspase3比值高于B组,但差异无统计学意义(P>0.05)。采用TUNEL技术观察结果显示,B组的肝细胞凋亡率显著高于A组,差异有统计学意义(P<0.01);C、D、E组的肝细胞凋亡率均显著低于B组,差异有统计学意义(P<0.01)。而且给药剂量越大,凋亡指数下降趋势越明显,提示对于ALD大鼠经CAE干预后可不同程度地抑制肝细胞凋亡指数的增高,且呈剂量依赖性。
综上所述,CAE可能是通過阻制ERS诱导的肝细胞凋亡,并促进正常肝细胞增殖,从而达到保肝的功效。
[参考文献]
[1]刘国涛,朱玉翠,张涛,等.酒精性肝病研究进展[J].世界华人消化杂志,2017,25(15):1382-1388.
[2]Trimble G,Zheng L,Mishra A,et al.Mortality associated with alcohol-related liver disease[J].Aliment Pharmacol Ther,2013,38(6):596-602.
[3]窦慧馨,张得钧.酒精性肝病分子发病机制研究进展[J].基因组学与应用生物学,2016,35(7):1643-1647.
[4]聂晶晶,王骁,唐艳萍.酒精性肝病的中西医结合治疗进展[J].河南中医,2016,36(4):738-740.
[5]杨国川.酒精性肝病免疫机制及中药防治研究进展[J].西南医科大学学报,2017,40(3):319-321.
[6]Wang CL,Liu C,Niu LL,et al.Surfactin-induced apoptosis through ROS-ERS-Ca2+-ERK pathways in HepG2 cells[J].Cell Biochem Biophys,2013,67(3):1433-1439.
[7]张优琴,王智巍,卞俊,等.中药治疗酒精性肝病的研究进展[J].海军医学杂志,2017,38(4):381-384.
[8]刘霞,李伟,范小娜,等.广枣提取物对大鼠酒精性肝病的保护作用[J].赣南医学院学报,2016,36(3):355-357.
[9]Shi QZ,Wang LW,Zhang W,et al.Betaine inhibits toll-like receptor 4 expression in rats with ethanol-induced liver injury[J].World J Gastroenterol,2010,16(7):897-903.
[10]Baena M,Sangüesa G,Hutter N,et al.Fructose supplementation impairs rat liver autophagy through mTORC activation without inducing endoplasmic reticulum stress[J].Biochimi Biophys Acta,2015,1851(2):107-116.
[11]陈洪锁,孟宪梅.酒精性肝病分子机制的研究进展[J].包头医学院学报,2018,34(8):127-129.
[12]Wu D,Cederbanm AI.Alcohol oxidative stress and free radical damage[J].Alcohol Res Health,2003,27:277-284.
[13]夏婷,张瑾,姚佳慧,等.氧化应激在酒精性肝病中作用机制的研究进展[J].中国药理学通报,2017,33(10):1353-1356.
[14]臧月,王生,刘楠,等.肠道菌群失调介导酒精性肝病发生发展的机制研究进展[J].中国药理学通报,2016,32(4):451-455.
[15]丁一芯.内质网应激与酒精性肝病研究进展[J].饮食保健,2018,5(21):286-287.
[16]Wang S,Pacher P,De Lisle RC,et al.A mechanistic review of cell death in alcohol-induced liver injury[J].Alcohol Clin Exp Res,2016,40(6):1215-1223.
[17]Tang WX,Wang LK,Wang YQ,et al.Peroxisome proliferator-activated receptor-alpha activation protects against endo-plasmic reticulum stress-induced HepG2 cell apoptosis[J].Mol Cell Biochem,2014,385(1-2):179-190.
[18]Shinohara M,Ji C,Kaplowitz N.Differences in betaine-homocysteine methyltransferase expression,endoplasmic reticulum stress response,and liver injury between alcohol-fed mice and rats[J].Hepatology,2010,51(3):796-805.
[19]Nishitani Y,Matsumoto H.Ethanol rapidly causes activation of JNK associated with ER stress under inhibition of ADH[J].FEBS Lett,2006,580(1):9-14.
[20]Esfandiari F,Medici V,Wong DH,et al.Epigenetic regulation of hepatic endoplasmic reticulum stress pathways in the ethanol-fed cystathionine beta synthase-deficient mouse[J].Hepatology,2010,51(3):932-941.
(收稿日期:2019-01-21 本文編辑:任秀兰)
