术后处理对马氏珠母贝育珠贝产珠性能的影响
2019-09-25梁飞龙邓岳文
梁飞龙,邓岳文
术后处理对马氏珠母贝育珠贝产珠性能的影响
梁飞龙,邓岳文
(广东海洋大学珍珠研究所,广东 湛江 524025)
【】为提高马氏珠母贝的育珠效益,比较海水盐度、抗生素和休养方式对马氏珠母贝育珠贝成活率、留核率和优良珠率的影响。实验1,设置休养海水盐度为22.5、25.1和27.8,以天然海水盐度31.7为对照组;实验2,休养期间,分别使用青霉素和链霉素、盐酸环丙沙星、头孢克肟和硫酸庆大霉素,手术第1天用量为10 mg·L-1,植核手术后1 d起使用量为5 mg·L-1,连续使用5 d;实验3,分别在室内水池、池塘和天然海区进行马氏珠母贝的术后休养,研究不同术后处理方式对育珠贝产珠性能的影响。低盐度海水休养对马氏珠母贝育珠贝的优良珠率影响有统计学意义(< 0.05),但对育珠贝成活率和留核率影响无统计学意义(> 0.05);休养期间使用抗生素对马氏珠母贝育珠贝的成活率、留核率和优良珠率影响无统计学意义(> 0.05);休养方式对育珠贝的成活率和留核率影响有统计学意义(< 0.05),水池休养的育珠贝成活率和留核率最高,海区休养的育珠贝最低。
马氏珠母贝;术后处理;术后休养;成活率;成珠率;珍珠质量
马氏珠母贝()又称合浦珠母贝(),是我国养殖海水珍珠的主要育珠贝之一,养殖区位于广东、广西和海南,广东雷州半岛为海水珍珠主产区[1]。海水珍珠培育包括育珠贝手术前处理、植核手术、育珠贝手术后休养、育珠贝养殖和收获珍珠等4个步骤[2-5]。马氏珠母贝珍珠培育技术研究主要集中在植核贝手术前处理[6-7],小片制取、保养和珠核处理[8-12]、珍珠囊发育[13-14]、手术母贝选择[15-20],以及养殖容量和环境[21-22]、饲料研发[23]、养殖方式[24-27]等育珠贝养殖技术。梁飞龙等[7]进行马氏珠母贝手术前处理研究,表明合适的术前处理可提高马氏珠母贝育珠贝的留核成珠率和珍珠质量。邓岳文等[10]对马氏珠母贝育珠细胞小片进行保养处理,可显著提高育珠贝的商品珠率和优质珠率。
马氏珠母贝在植核手术时受到严重创伤,处理不当会造成育珠贝大量死亡,影响所培育的珍珠质量和产量[2, 28],术后休养可影响珍珠贝成活率、成珠率和珍珠质量[2,5,28]。然而,马氏珠母贝珍珠培育过程中,术后休养技术的研究较少,仅见Atsumi等[5,26]的低盐度海水休养初步研究,以及符韶等[19]的池塘休养初步研究。目前,马氏珠母贝施术贝手术后多直接吊养在自然海区进行休养,易受水温、盐度、水流以及饵料生物的种类和数量变化等环境因素的影响,育珠贝成活率和留核成珠率低,育珠效益差。为提高马氏珠母贝的育珠效益,笔者进行马氏珠母贝休养技术研究,以期为提高马氏珠母贝育珠质量和产量提供新的思路。
1 材料和方法
1.1 材料
实验贝为广东海洋大学选育的“海选1号”,养殖在广东省湛江市雷州市覃斗镇后洪海区,贝体壳面光洁,贝壳完整无破损。
手术贝:贝龄1.5 ~ 2.0龄,壳高5.5 ~ 6.5 cm,手术前进行适当的处理,以调整贝体活力和性腺发育状况。
小片贝:贝龄1.0 ~ 1.5龄,壳长5.0 ~ 5.5 cm,贝壳内表面珍珠层颜色为虹彩色或银白色。
珠核:直径5.8 ~ 6.2 mm,由海水贝壳研磨而成。
养殖笼具:休养笼为锥形笼,高20 cm,底径35 cm,网孔边长2.0 cm×2.5 cm,笼底套上一个网孔边长2.0 mm×3.0 mm的网布,以回收脱落的珠核。育珠笼为片笼,长80 cm,宽50 cm,网孔边长2.0 ~ 3.0 cm,分为4层。
室内水池:有充气、控温、调光设施,长500 cm,宽200 cm,高150 cm,水深100 cm。
休养池塘:面积33 hm2,水深200 cm,经池底进排水口依靠潮差自然纳、排水,海水盐度27.8 ~ 31.7。
1.2 方法
1.2.1 植核手术 植核手术前1 ~ 2 h将母贝从养殖海区取回,清洗干净,排贝处理0.5 ~ 1.0 h,再进行栓口;外套膜小片的切取位置为小片贝唇瓣下方至肛门腹面之间,以色线为中心,按色线内外侧各占一半的比例,先切成条形,再切成2.0 mm×2.0 mm的正方形。采取先送核后送片的方法进行植核,每贝植核1颗,植核位置在腹嵴末端附近,即“左袋”[2,28]。
钾肥观察家认为,通过大规模实施混合所有制,未来国企、民企的楚河汉界不会再泾渭分明,而是你中有我,我中有你,这将极大地改写国企的股权结构与秩序,用更少资本撬动更大的资源。这无疑是一种“双赢”。
1.2.2 术后休养 植核完成的育珠贝,按照每笼40只的密度腹部向上排放在休养笼中,再分别置于相应水体中休养。
室内水池休养。育珠贝吊养在离池底20 ~ 30 cm的水层中,吊养密度120只/m3。水池每3 ~ 4 m2设散气石1个,保持连续充气,休养时间23 d,每2 ~ 3 d检查1次,及时清除死亡的育珠贝并回收脱落的珠核。休养期结束前3 d,用天然海水,让育珠贝适应海区环境。手术后第3天起,少量投喂亚心形扁藻()(1×104~ 2×104mL-1·d-1),小球藻(spp.)、湛江等鞭金藻()(3×104~ 5×104mL-1·d-1),以及经孔径48 μm的筛网过滤、天然海水施肥培育的混合藻(2×104~3×104mL-1·d-1)。
池塘和海区休养。吊养水深130 ~ 150 cm,笼间距40 ~ 50 cm,休养时间23 d,每2 ~ 3 d检查1次,手术10 d后每3 ~ 5 d检查1次,及时清除死贝,调整养殖密度。
休养期结束后,将育珠贝装至片笼,每笼约60只,移至海区养殖时间12个月。
1.3 实验设计
实验1,在天然过滤海水(盐度31.7)中添加相应的井水,使盐度分别为22.5、25.1、27.8,记为A1、A2和A3组,以天然海水为对照组(A0)。每组用贝3 600只,设3个重复组,共用贝10 800只。各组每3 d换水1次,换水量20% ~ 30%。实验在室内水池内进行,其他休养条件同1.2。
实验2,对术后贝分别施用青霉素-链霉素合剂(各占50%)、盐酸环丙沙星、头孢克肟和庆大霉素,记为B1、B2、B3和B4组。第1天用药量为10 mg/L,手术后第2天起药量调整为5 mg/L,每天施用1次,连续施用5 d,以不施用抗生素为对照组B0。每组用贝 2 400只,设3个重复组,共用贝12 000只。实验在室内水池内进行,其他休养条件同1.2。
实验3,分别在室内水池、池塘和海区进行马氏珠母贝手术后休养,记为C1、C2和C3组,每组用贝3 600只,设3个重复组,共用贝10 800只。
1.4 实验数据处理
休养成活率=休养期成活贝数/植核贝数×100%;
休养留核率=(植核数-脱核数-死贝脱核数)/ 休养成活贝数量×100%,因1只贝植核1颗,死亡1只贝则减去1颗核;
育珠成活率=育珠期成活育珠贝数/育珠开始时育珠贝数×100%;
育珠留核率=收珠留核数量/收珠成活贝数量×100%;
优良珠率=优良珍珠数量/商品珍珠数量×100%;
参照珍珠分级国家标准GB/T 18781—2008,优良珍珠判断标准为:珍珠形状A3级以上(近圆形、圆形和正圆),光泽C级以上(反射光明亮,表面能见物体影像),光洁度B级以上(表面有非常少的瑕疵,似针点状,肉眼较难观察到),珍珠层厚度C级以上(大于0.4 mm)。
利用单因素方差分析比较经反正弦转换后的休养期育珠贝的成活率、留核率,以及育珠期成活率、留核率和优良珠率的差异。如果差异显著,再利用最小显著差数(LSD)方法比较各组间平均数的差异,检验的显著性水平设为< 0.05。
2 结果与分析
2.1 休养期间海水盐度对育珠贝留核率、成活率和优良珠率的影响
不同海水盐度条件下育珠贝休养结果如表1所示。休养期和育珠期各组育珠贝的成活率与留核率差异无统计学意义(>0.05),但优良珠率差异有统计学意义(<0.05)。各实验组优良珠率均高于对照组,但三组间差异无统计学意义。其中,A2组育珠贝优良珠率平均值最高(45.2%),优良珠率平均值由高到低依次为A2、A1和A3(表1)。可见,育珠贝术后经低盐度海水休养后再移到天然海区育珠可显著提高育珠贝的优良珠率。

表1 不同盐度休养的马氏珠母贝育珠效果
注:同行数据含有相同字母数值差异无统计学意义(>0.05)。
Note: Means with the same letter within the same row are not significantly different (> 0.05).
2.2 抗生素对马氏珠母贝成活率、留核率和优良珠率的影响
从表2可见,休养期间,育珠贝休养成活率平均值最高的为B4组(硫酸庆大霉素),留核率平均值最高的为B3组(头孢克肟),成活率和留核率平均值最低的为B0(对照组);育珠期间,育珠成活率平均值最高的为B3组(头孢克肟),留核率平均值最高的为B2组(盐酸环丙沙星),优良珠率平均值最高的是B4组(硫酸庆大霉素),成活率平均值最低的为B1组(青霉素链霉素合剂),留核率和优良珠率平均值最低为对照组。单因素方差分析显示不同处理组之间育珠贝成活率、留核率、优良珠率差异均无统计学意义(>0.05)(表2)。
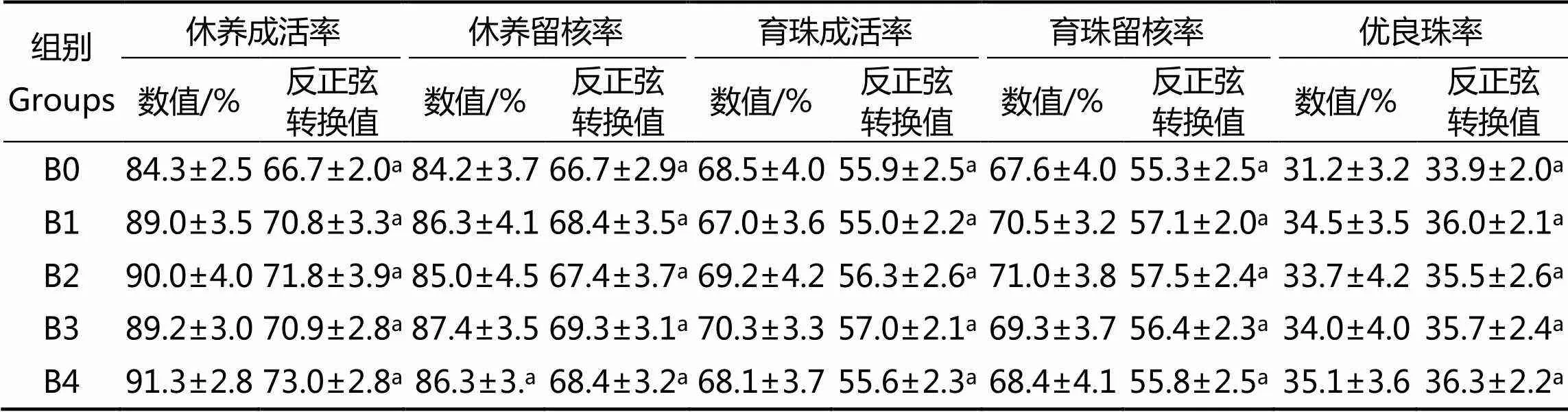
表2 抗生素对马氏珠母贝育珠效果的影响
注:表中同行含有相同字母数值差异不显著(>0.05)
Note: Means with the same letter within the same row are not significantly different (> 0.05)
2.3 休养方式对马氏珠母贝育珠贝成活率、留核率、优良珠率的影响
休养方式对马氏珠母贝育珠效果的影响如表3所示。C1组(室内水池休养)、C2组(池塘休养)的育珠贝成活率、留核率和优良珠率均高于C3组(海区休养),差异有统计学意义(<0.05),但二组间差异无统计学意义,C1组成活率、留核率和优良珠率平均值最高(88.5%、85.5%、32.5%),C2组(池塘休养)次之(87.7%、82.6%和31.4%),C3组(海区休养)最低(77.3%、76.6%和25.5%)。休养期结束后,将不同休养方式的育珠贝装笼移到育珠海区养殖,育珠贝成活率和留核率差异无统计学意义(> 0.05)。因此,马氏珠母贝手术后在室内水池或池塘休养,可提高育珠贝休养期间的成活率和留核率,以及育珠贝优良珠率。
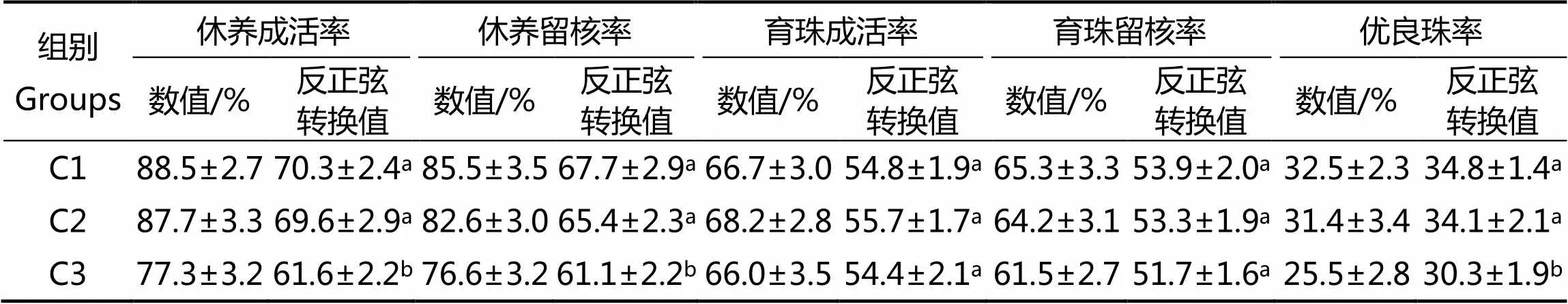
表3 休养方式对马氏珠母贝育珠效果的影响
注:表中同行含有相同字母数值差异不显著(>0.05)
Note: Means with the same letter within the same row are not significantly different (> 0.05)
3 讨论
在植核手术时马氏珠母贝手术母贝受到严重创伤,如果处理不当会影响珍珠的产量和质量,还会导致育珠贝大量死亡[2,28]。因此,手术后的育珠贝需进行20 ~ 30 d的休养。施术贝休养的目的,一是让手术贝恢复健康,生理活动从被抑制状态逐渐恢复到正常状态,防止手术贝死亡;二是使珠核在移植小片形成珍珠囊之前,不发生或少发生位置移动,防止脱核及产生素珠和畸形珍珠[2, 28]。
3.1 盐度对马氏珠母贝育珠贝成活率、留核率和珍珠质量的影响
谢忠明等[28]认为,海水盐度较低的海区,饵料生物丰富,育珠贝的珍珠质分泌速度较快,白色系列和粉红色系列优良珍珠出现率高。Atsumi 等[5,26]指出,低盐度海水休养的马氏珠母贝优质珠率是常规休养方法的5倍多,优质珍珠增加的形成机制还不完全清楚,但会延缓珍珠囊的形成速度。本实验结果和Atsumi等[5,26]的相似,但优质珠率的增加幅度仅11.1% ~ 14.8%(实验1)。笔者认为,导致马氏珠母贝低盐度海水休养优质珠率提高的因素可能是休养水体的微量元素发生变化,或是海水渗透压变化,具体原因有待进一步实验验证。马氏珠母贝生长的适宜海水相对密度为1.015 ~ 1.028(盐度约为21 ~ 38),最适海水密度为1.020 ~ 1.025(盐度27.8 ~ 34.3)[2]。马氏珠母贝植核手术后贝体受到创伤,抵抗力降低,为保持环境条件的相对稳定,以利于施术贝恢复健康,建议采用相对密度1.018 ~ 1.020(盐度25 ~ 28)的海水进行马氏珠母贝术后休养。
3.2 抗生素对马氏珠母贝育珠贝成活率、留核率和珍珠质量的影响
弧菌是海水养殖动物的主要病原菌之一,是条件致病菌,仅在病原菌达到一定数量,且养殖动物抵抗力下降才能致病,可使用抗生素抑制弧菌的生长繁殖,以及改善养殖环境条件、优化养殖模式进行防治[29-31]。常规贝类育苗多使用1 ~ 2 mg/L的抗生素,以提高贝类抗病力,提高育苗成活率[32]。本研究中,施术贝为大贝,休养过程中使用5 ~ 10 mg/L的常用抗生素对育珠贝的成活率、留核率和优良珠率未产生显著影响。认为其原因有,育珠贝在室内水池休养期间使用过滤海水,投喂人工培养的饵料,水体中病原菌未达到致病的数量;其次,贝体抵抗力较强,不施用抗生素也不会导致育珠贝致病。因此,育珠贝休养期间的处理措施是保持良好的环境条件,投喂优质饵料,提高贝体的健康水平。
3.3 休养方式对马氏珠母贝育珠贝成活率、留核率和珍珠质量的影响
养殖方式影响育珠贝生长和珍珠质量。Kishore等[24]认为,养殖方式影响所培育的珍珠形状和质量,片笼养殖的珠母贝生产圆形和半圆形优质珍珠的比例显著高于开放式养殖的珠母贝。本研究显示,水池、池塘休养的育珠贝成活率、留核率和优良珠率高于海区休养。可能与水池、池塘的风浪、流速小,对贝体刺激小,氧气供应充足有关,同时根据贝体的恢复状况投喂饵料,为育珠贝手术后恢复提供良好的休养条件。而海区休养的育珠贝受到海区风浪、流速、水温以及饵料生物的种类和数量变化的影响,育珠贝休养期间的成活率和和留核变化较大。休养期间稳定的环境条件亦使育珠贝快速形成珍珠囊分泌珍珠质,因此,水池和池塘休养的育珠贝优良珠率高。
[1] 贺亮, 全秋梅, 朱晓闻. 雷州半岛南珠产业可持续发展的思路与对策[J]. 安徽农业科学,2016, 44(20): 128-130.
[2] 邓陈茂, 蔡英亚. 海产经济贝类及其养殖[M]. 北京: 中国农业出版社, 2007: 258-285
[3] 蒙钊美, 李有宁, 邢孔武. 珍珠养殖理论与技术[M]. 北京: 科学出版社, 1995: 191-197.
[4] LATCHERE O, MOULLAC G L, GAERTNER-MAZOUNI N, et al. Influence of preoperative food and temperature conditions on pearl biogenesis in[J]. Aquaculture, 2017, 479:176-187
[5] ATSUMI T, ISHIKAWA T , INOUE N, et al. Post-operative care of implanted pearl oystersin low salinity seawater improves the quality of pearls[J]. Aquaculture, 2014, 422-423: 232-238
[6] 邓陈茂, 梁飞龙, 符韶, 等. 马氏珠母贝术前处理与育珠研究[J]. 海洋湖沼通报, 2010(4): 124-128.
[7] 梁飞龙, 林伟财, 邓岳文, 等. 术前处理对马氏珠母贝育珠效果的影响[J]. 中国农学通报, 2014, 30(8): 36-41.
[8] 王梅芳, 余祥勇, 李咏梅, 等. 马氏珠母贝育珠细胞小片和珠核处理技术研究Ⅱ: 不同处理液在广东徐闻的育珠效果[J]. 广东海洋大学学报, 2010, 30(6): 7-13.
[9] 温崇庆, 陈燕玲, 王梅芳, 等. 马氏珠母贝育珠细胞小片和珠核处理技术研究Ⅲ: 插核手术贝伤口区弧菌类型的初步研究[J]. 广东海洋大学学报, 2010, 30(6): 69-73.
[10] 邓岳文, 邓陈茂, 杜晓东, 等. 细胞小片处理对马氏珠母贝育珠效果影响[J]. 海洋湖沼通报, 2011 (3): 46-50.
[11] 王梅芳, 余祥勇, 宾承勇, 等. 马氏珠母贝育珠细胞小片和珠核处理技术研究Ⅳ:不同处理液在广西营盘育珠效果[J]. 广东海洋大学学报, 2011, 31(3): 31-36
[12] 翁雄, 李有宁, 樊虎, 等. 细胞小片形状对合浦珠母贝插核休养期死亡率和脱核率的影响[J]. 广东农业科学, 2012, 39(23): 119-122.
[13] 杜晓东, 焦钰, 邓岳文, 等. 马氏珠母贝珍珠囊发育的超微结构观察[J]. 海洋学报, 2010, 32(5): 160-164.
[14] 焦钰, 师尚丽, 杜晓东,等. 马氏珠母贝珍珠囊发育的组织和组织化学研究[J]. 广东海洋大学学报, 2010, 30(4): 7-10.
[15] 符韶, 谢绍河, 邓岳文, 等. 利用马氏珠母贝4个壳色系F3培育厚层优质珍珠[J]. 水产学报, 2012, 36(9): 1418-1424.
[16] WUDA K T, KOMARU A. Color and weight of pearls produced by grafting the mantle tissue from a selected population for white shell color of the Japanese pearl oyster(Dunker) [J]. Aquaculture, 1996, 142: 25-32.
[17] IWAI T, TAKAHASHI M, IDO A, et al. Effect of gender on Akoya pearl quality[J]. Aquaculture, 2015, 437: 333–338.
[18] 王庆恒, 逯云召, 邓岳文, 等. 马氏珠母贝生长性状与珍珠质量和珍珠层厚度的相关分析[J]. 广东海洋大学学报, 2013, 33(3): 18-21.
[19] 符韶, 黄邦双, 邓岳文, 等. 马氏珠母贝育珠效果影响因素分析[J]. 广东海洋大学学报, 2013, 33(1): 28-32.
[20] 尹立鹏, 邓岳文, 杜晓东, 等. 贝龄对马氏珠母贝植核贝生长、成活率和育珠性状的影响[J]. 中国水产科学, 2012, 19(4): 715-720.
[21] 朱春华, 申玉春, 谢恩义, 等. 湛江流沙湾马氏珠母贝的养殖容量[J]. 热带海洋学报, 2011, 30(3): 76-81.
[22] 顾志峰, 黄锋绍, 王海, 等. 不同海区养殖的马氏珠母贝珍珠质颜色比较[J]. 渔业科学进展, 2012, 33(5): 91-94.
[23] 王庆恒, 廖永山, 杨创业, 等. 微胶囊饲料对马氏珠母贝育珠性能、生长基因和矿化基因表达的影响[J].中国水产科学, 2017, 24(3): 616-623.
[24] KISHORE P, SOUTHGATE P C. The effect of different culture methods on the quality of round pearls produced by the black-lip pearl oyster(Linnaeus, 1758)[J]. Aquaculture, 2016, 451: 65-71.
[25] 邓远球, 符韶, 邓岳文, 等. 养殖笼具对马氏珠母贝育珠效果的影响[J]. 中国农学通报, 2018, 34(10): 148-152.
[26] ATSUMI T, AOKI H, ABE H, et al. Treatment effects during the post-operative care on the rate of pearl-sac formation in the pearl oysters[J]. Aquaculture, 2018, 483:154-162
[27] LI J H, YANG C Y, WANG Q H, et al. Growth and survival of host pearl oyster(Dunker,1880) treated by different biofouling-clean methods in China[J]. Estuarine, Coastal and Shelf Science, 2018, 207: 104-108.
[28] 谢忠明, 张元培, 邹乐道, 等. 人工育珠技术[M]. 北京: 金盾出版社, 2004: 216-217.
[29] 周永灿. 海洋贝类病害及其研究进展[J]. 海南大学学报(自然科学版), 2000, 18(2): 207-212.
[30] 陆彤霞, 王国良, 尤仲杰, 等. 我国海洋养殖贝类病害研究概况及防治对策[J]. 浙江海洋学院学报(自然科学版), 2002, 21(2): 154-159.
[31] 李国, 闫茂仓, 常维山, 等. 我国海水养殖贝类弧菌病研究进展[J]. 浙江海洋学院学报(自然科学版), 2008, 27(3): 327-334.
[32] 王如才, 王昭萍, 张建中. 海水贝类养殖学[M]. 青岛: 青岛海洋大学出版社, 1993: 241-242.
Experiments on Post-operative Treatment of Host Oysters of
LIANG Fei-long, DENG Yue-wen
(,,524025,)
【】To increase the profit of pearl farming, three experiments were carried out to evaluate the effects of seawater salinity, antibiotics and post-operative treatment on pearl production of pearl oyster. 【】In Experiment I, the seawater salinity was 22.5, 25.1, and 27.8, respectively. The control group was farmed in the nature seawater with a salinity value of 31.7. In Experiment II, the 10mgL-1penicillin and streptomycin mixture, ciprofloxacin hydrochloride, cefixime and gentamycin sulfate were used on the first day of seeding, and the usage was 5mgL-1from the day after operation and used for 5 days. In Experiment III, the host oysters were cultured in tank, pool and sea for post-operative care, respectively. 【】Effects of low salinity seawater on pearl quality of pearls produced by host oysters were significant, but the low salinity seawater did not significantly influence the survival and nucleus retention rate of host oysters. During the post-operative treatment, antibiotics did not significantly influence the survival and retention rate and pearl quality of host oysters. Post-operative treatment had a significant effect on survival and retention rate of host oysters. The survival rate and retention rate during recuperation were the highest for host oysters cultured in tank, and the lowest for host oysters cultured in the sea.
; post-operative treatment; post-operative care; survival; pearl formation percentage; pearl quality
S968.35
A
1673-9159(2019)05-0050-06
10.3969/j.issn.1673-9159.2019.05.008
2018-12-19
广东省海洋渔业科技与产业发展专项珍珠产业发展项目(Z2015005,Z2014008);国家贝类产业技术体系(CARS-49)
梁飞龙(1963―),男,教授级高工,研究方向为珍珠养殖技术研究。Tel:0759-2339346;E-mail: lflzjou@126.com
梁飞龙,邓岳文. 术后处理对马氏珠母贝育珠贝产珠性能的影响[J]. 广东海洋大学学报,2019,39(5):50-55.
(责任编辑:刘庆颖)
