含镁离子对硅酸溶液胶凝行为的影响
2019-09-25尤润泽申星梅
王 平,尤润泽,申星梅,杨 春
(1.安徽工业大学 冶金废弃物综合利用安徽省工程技术研究中心,安徽 马鞍山 243002; 2.安徽工业大学 冶金工程与资源综合利用安徽省重点实验室,安徽 马鞍山 243002)
硅酸溶液体系是精细化学品制备、资源高效利用、新材料合成等诸多领域常涉及的体系。近年来,研究者们采用工业固体废弃物为硅源来制备系列含硅精细化学品[1-4],如在利用黄长石类矿物及冶金渣制备精细化学品时,常经历含有铝离子、镁离子的硅酸溶液体系,这些金属离子的存在常会影响终极产品的质量,为此,需要研究金属离子对硅酸溶液胶凝行为的影响。
国内外研究硅酸的聚合机制已有一百多年的历史,其中以戴安邦教授[5-8]提出的系列“硅酸聚合理论”最为系统,此理论得到了国际同行的公认与高度评价,为硅溶胶的生产和科研均有重要的指导意义。鉴于需求的迫切性,不断有研究者探索复杂硅酸盐体系中的一些基础物理化学问题。如:Lee[9]等研究了硅酸溶胶的稳定性及其聚合过程动力学行为;Spadini[10]等研究了复杂硅酸盐体系中复杂AlOSi(OH)(3)2+离子的稳定性问题;尹承龙[11]等研究了酸化剂对硅酸聚合胶凝的影响;贾光耀[12]等研究了硅酸聚合、胶凝化过程等;王力[13]等研究了表面活性剂对硅酸聚合胶凝的影响;申星梅[14]等研究镁铝离子共存硅酸体系中硅酸聚合行为等。有关复杂硅酸溶液体系的研究前沿在不断拓展与推进,并取得了很多有意义的结果。尽管如此,单一金属离子的硅酸体系硅酸聚合机制的基础研究尚不系统。本研究重点对含Mg2+硅酸溶液的胶凝行为展开研究,以期丰富多金属离子共存硅酸体系的聚合理论,为工业固体废弃物制备含硅系列精细化学品提供理论支撑。
1 实验
1.1 试剂与仪器
试剂:氧化钙,二氧化硅,浓硫酸,浓氨水, MgSO4·7H2O,二次蒸馏水,均为分析纯。
仪器:PHS-2C精密pH计(上海般特仪器有限公司),DZF-6210真空干燥箱(上海恒科技有限公司),HJ-3A恒温磁力搅拌器(上海梅颖浦仪器制造有限公司),HH-2恒温水浴锅(上海力辰邦西仪器科技有限公司),Nicolet6700傅里叶红外光谱仪(美国Nicolet公司),石墨坩埚。
1.2 实验方法
1.2.1 纯硅酸溶液的制备
根据发明专利[15],采用硫酸酸化水淬硅酸钙的方法制备不含任何金属离子的纯硅酸溶液,为提高硅酸溶液的纯度,实验中的硫酸用量增加20%(滤液pH值为0.65左右)。
1.2.2 含镁离子硅酸溶液的配制
取纯硅酸溶液20 mL,置于烧杯中,放在磁力搅拌器上(转速为550 r/min),向溶液中加入一定量的七水硫酸镁,配置设定含镁离子浓度的硅酸溶液,并采用滴定管滴加氨水或硫酸溶液调节硅酸溶液的pH值到一定值,得到各种含镁离子硅酸溶液体系。
将上述不同含镁离子硅酸溶液体系置于一定温度的恒温水浴锅中,观察硅酸体系的胶凝过程。
1.2.3 分析方法
不同硅酸溶液体系的胶凝时间t = t1- t2,其中t1是试管放入水浴锅中的时刻,t2是胶凝结束的时刻(以倾斜试管溶液失去流动性时作为凝胶终了时间)。将含金属镁离子硅酸溶液在不同条件下胶凝后得到的凝胶,经真空泵反复“抽滤-洗涤”,直至洗涤液呈中性,再将凝胶置于120℃的真空恒温干燥箱中干燥12 h,粉碎后得水合二氧化硅粉体,用红外光谱分析仪分析其凝胶基团。
2 实验结果与分析
2.1 pH值对含镁离子硅酸溶液胶凝时间的影响
图1为不含镁离子的纯硅酸溶液与含有0.10 mol/L镁离子硅酸溶液在40℃、不同体系pH值条件下的胶凝曲线图。

图1 含镁离子硅酸溶液胶凝时间随体系pH值的变化曲线
从图1可看出,含镁离子硅酸溶液的胶凝时间比纯硅酸溶液胶凝时间缩短,镁离子的加入促进了硅酸溶液的胶凝,表现出一定的促凝作用。含镁离子硅酸溶液的胶凝曲线最高点出现在pH值为1.5左右,纯硅酸溶液体系胶凝曲线的最高点出现在pH值为1.1附近,含镁离子硅酸溶液胶凝曲线最高点对应的pH值升高。
根据戴安邦教授[6]等研究的硅酸聚合理论,在浓酸性溶液中,硅酸的聚合作用主要是H4SiO4与[H5SiO4]+之间的六配位的羟联反应,即发生如下反应:
H++H4SiO4(H5SiO4)+
(1)
(H5SiO4)++H4SiO4+2H2O(H13Si2O10)+
(2)
在微酸性溶液中,硅酸的聚合作用主要是是H4SiO4与[H3SiO4]-之间的四配位氧联反应,反应式为:
H4SiO4+(H3SiO4)-H6Si2O7+OH-
(3)
溶液中有镁离子存在时,硅溶胶表面的羟基可能会与镁发生如下反应:
Mg2++2Si-OHSi-OMgO-Si+2H+
(4)
在本实验pH值范围内,硅酸聚合过程中反应(2)和(3)同时进行,在胶凝曲线最高点对应pH值时,(H5SiO4)+和(H3SiO4)-的浓度相等,即为(H5SiO4)+和(H3SiO4)-的等电点。当镁离子存在时,溶液中发生反应(4),提高了溶液中H+浓度,促使反应(1)向右进行,同时抑制(H3SiO4)-生成,导致(H5SiO4)+和 (H3SiO4)-等电点对应的pH值升高,表现为含镁离子硅酸溶液的胶凝曲线最高点所对应的pH值增大。
2.2 温度对含镁离子硅酸溶液胶凝曲线的影响

图2 不同温度下含Mg2+硅酸溶液的胶凝时间随体系pH值的变化曲线
图2为在不同温度条件下,含镁离子浓度为0.10 mol/L硅酸溶液的胶凝时间随体系pH值的变化曲线图。
从图2可以得出,同温度体系中,含镁离子硅酸溶液胶凝曲线最高点几乎未移动,均维持在pH值为1.50左右。随着温度的升高,聚合反应速率加快,胶凝时间缩短。反应温度可改变一个化学反应的速率,所以温度能够影响硅酸聚合的程度,硅酸分子中的电子和质子能更活跃导致其跃迁,增大了其与邻近分子的碰撞几率,更有利于硅酸的聚合,表现为硅酸溶液的胶凝时间缩短。同时,温度升高促进了体系中硅酸胶粒的生长,使硅酸体系胶凝时间缩短。
2.3 镁离子浓度对硅酸溶液胶凝时间的影响
图3为40℃条件下,不同镁离子浓度的硅酸溶液体系的胶凝时间曲线图。
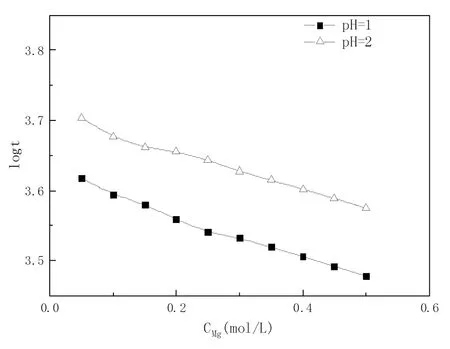
图3 镁离子浓度对硅酸溶液体系胶凝时间的影响
从图3看出,随着镁离子浓度的升高,硅酸溶液胶凝的时间明显缩短,硅酸胶凝速度明显加快。由于在同样实验pH值下,可忽略硅酸溶液体系中SO42-等强酸根离子对硅酸聚合的影响,只考察溶液中Mg2+对硅酸聚合作用的影响。在pH值较低时,金属镁离子与高聚物硅酸表面的硅羟基形成表面配合物,使得反应(2)向右进行;在pH值较高时,硅酸溶液中的聚合反应主要表现为反应(3),但同时镁离子与溶液中的硅酸负离子发生聚合反应,随着镁离子浓度的增大,镁离子和硅酸负离子聚合反应速度加快,缩短了硅酸胶凝的时间。
2.4 镁离子浓度对硅酸凝胶基团的影响
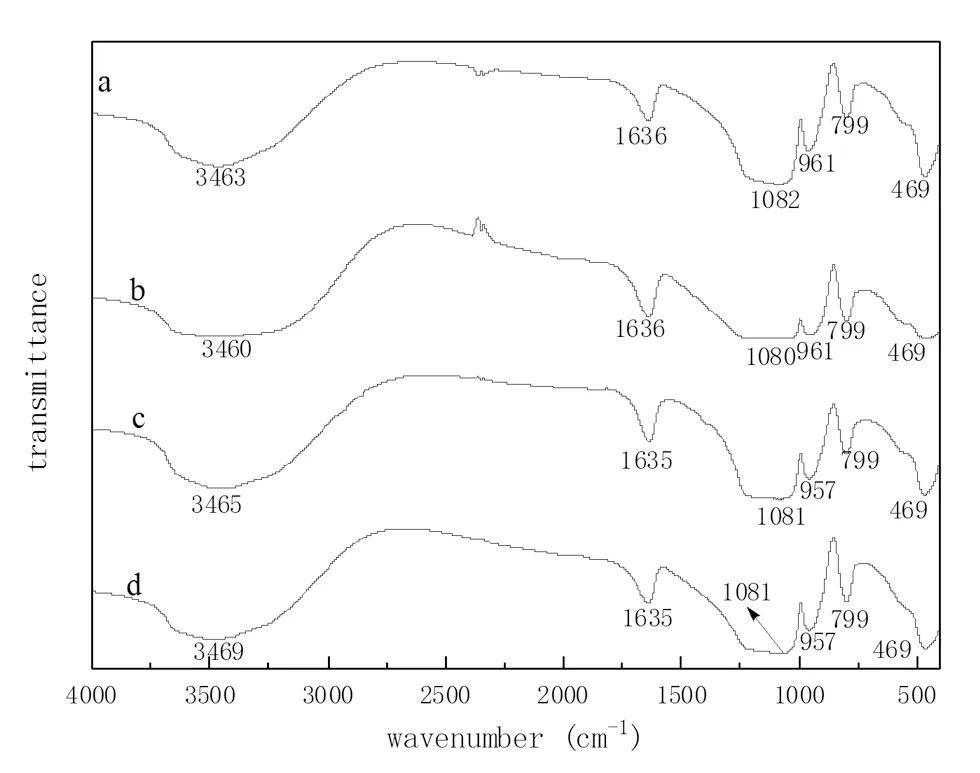
a:30℃,0 mol/L;b:30℃,0.1 mol/L;c:40℃,0 mol/L;d:40℃,0.1 mol/L图4 镁离子硅酸溶液胶凝产物的红外光谱图
图4为溶液体系pH值=1.0、不同镁离子浓度与温度下的硅酸体系胶凝产物的红外光谱图。
从图4可得出,对比纯水合二氧化硅的谱图[16],含有镁离子体系硅酸凝胶产物红外光谱图中都出现了水合二氧化硅的特征峰,波数1081 cm-1左右对应的是Si-O-Si键的反对称收缩振动,波数在960 cm-1左右对应的是Si-OH键的弯曲振动,波数为799 cm-1、469 cm-1左右的峰分别对应的是Si-O键的对称收缩振动与弯曲振动引起的,在1636 cm-1和3466 cm-1分别对应的是H-O-H弯曲振动和O-H的的伸缩振动。加入镁离子后,1081 cm-1、960 cm-1以及469 cm-1左右处的峰强度有所减弱,可能是由于镁离子参与硅酸聚合反应,引起硅酸网络结构的变形,导致胶凝产物的部分红外特征吸收峰强度减弱。
3 结论
研究pH值、温度以及镁离子浓度对硅酸胶凝行为的影响,发现:含镁离子硅酸溶液胶凝曲线最高点出现在pH值=1.5附近,比纯硅酸溶液胶凝曲线最高点对应的pH值大;温度升高,含镁离子硅酸溶液的聚合速率加快,胶凝时间缩短;随着溶液中镁离子浓度的增加,硅酸溶液的胶凝时间明显缩短;镁离子的加入导致胶凝产物硅酸基团部分红外吸收特征峰强度减弱。
