DMSO与DMF对H9C2心肌细胞毒性及STAT3信号通路的影响
2019-09-25李建喜仇正英王学智
杨 敏,张 凯,李建喜,王 磊,张 康,仇正英,王学智
(中国农业科学院 兰州畜牧与兽药研究所,甘肃省中兽药工程技术研究中心,甘肃 兰州 730050)
H9C2心肌细胞用于筛选临床药物时,常面临药物溶解度低的问题,因此筛选助溶剂是溶解药物的关键一步。助溶剂必须满足低毒、助溶效果优良、不改变药物本身的特性。二甲基亚砜(DMSO)和N,N-二甲基甲酰胺(DMF)为较常用的有机助溶剂。DMSO是一种广泛使用的可溶于水的非质子溶剂,增溶能力强,低毒,具有透过生物膜的能力,可诱导细胞发生凋亡[1-2]。DMF则作为最有效的极性溶剂之一,有很好的溶解性,高沸点,低毒性,价格低廉,在有机合成、高分子制备、制药等领域广泛应用[3]。DMSO与DMF都具有低毒性,但对H9C2心肌细胞的毒性作用有待进一步研究。近年来发现信号转导与转录激活因子3(STAT3)信号通路与心脏炎症、血管再生、肿瘤、新陈代谢密切相关,调节细胞增殖、分化、凋亡过程,在炎症反应中发挥作用,影响bcl-2、cyclinD1、matrix metalloproteinase-2基因转录活性[4-5]。当抑制STAT3活性时,可导致细胞凋亡,激活STAT3,进而抑制细胞凋亡[6]。DMSO与DMF对心肌细胞的毒性作用,可能与STAT3信号通路的调控相关。通过MTT法和Western blot试验,检测DMSO和DMF不同体积分数对H9C2心肌细胞的毒性作用与STAT3蛋白表达影响,以期为H9C2心肌细胞试验药物助溶剂的选择提供参考,为研究H9C2心肌细胞的STAT3蛋白通路相关领域提供参考。
1 材料与方法
1.1 试剂及药物
DMEM培养基、胎牛血清、双抗、0.25%的胰蛋白酶、无菌PBS,均购自美国Gibco公司;DMSO和DMF,购自美国SIGMA公司;MTT、彩虹180光谱蛋白Marker、5% BSA封闭液,均购自Solarbio公司;M-PER细胞裂解液,购自美国Thermo Fisher Scientific公司;Beta Actin Mouse McAb抗体,购自美国Proteintech公司;STAT3兔单克隆抗体,购自美国Cell Signaling Technology公司;Bcl-2兔多克隆抗体,购自美国Abcam公司;山羊抗鼠和山羊抗兔多克隆抗体,购自中杉金桥公司。
1.2 仪器
CO2恒温培养箱,购自Heal Force广州安邦生物公司;全自动细胞计数仪,购自美国 Nexcelom 公司;离心机,购自美国SIGMA公司;全波长酶标仪,购自美国Thermo Fisher Scientific公司;倒置显微镜,购自德国徕卡LEICA公司。
1.3 细胞来源
鼠源H9C2心肌细胞,购于中国科学院上海细胞库。
1.4 H9C2心肌细胞培养
制备含10%胎牛血清和1%双抗的DMEM细胞完全培养液,于-80 ℃取出H9C2细胞冻存管,立即放入37 ℃水浴,当心肌细胞完全融化后,加入DMEM细胞完全培养液,4 ℃,1 000 r·min-1,离心5 min后,弃去细胞液,加入DMEM细胞完全培养液,轻轻吹打底部细胞悬浮后,接种至75 mm2细胞瓶,37.5 ℃,5% CO2恒温培养2~3 d。倒置显微镜观察细胞生长情况,当平铺细胞量为90%以上,进行细胞传代,完全弃掉细胞液,磷酸盐缓冲液(PBS)洗涤一次,加入5 mL 0.25%的胰蛋白酶,37.5 ℃消化2 min,轻拍细胞瓶,促使细胞消化完全,加入10 mL含胎牛血清的细胞培养液终止消化,接种于新的细胞培养瓶培养。
1.5 配制不同体积分数的DMSO和DMF培养液
分别取10、20、30、50、70、90、100、200、300 μL的DMSO和DMF分别加入10 mL的DMEM高糖完全细胞培养液中,配比为0.1%、0.2%、0.3%、0.5%、0.7%、0.9%、1.0%、2.0%、3.0%体积分数的DMSO与DMF细胞培养液,经0.22 μm·L-1的微孔滤膜过滤除菌后分别加入75 mm2细胞培养瓶培养。
1.6 细胞毒性试验(MTT法)
将处于对数增长期的H9C2细胞制备为细胞悬液,以1×105mL-1的细胞密度接种于96孔板中,每孔100 μL,培养24 h后,加入不同体积分数的DMSO和DMF,每孔重复5个平行试验,共设置7列试验组(加入含不同体积分数的DMSO和DMF),2列对照组(细胞加培养液),1列空白组(无细胞,只加细胞培养液),围绕试验组、对照组、空白组外圈每孔加入100 μL无菌PBS,置于5% CO2的37.5 ℃恒温培养箱培养。避光使用无菌PBS配制5 mg·mL-1的MTT溶液,经0.22 μm·L-1的微孔滤膜过滤除菌,试验组、对照组和空白组每孔加入20 μL,在含5% CO2的37.5 ℃恒温培养箱培养4 h后,彻底吸弃除无菌PBS孔的液体后,每孔加入150 μL DMSO,轻轻吹打几下,低速振荡10 min,置于酶联免疫检测仪中,设置吸收波长为450 nm,测定D值。6个96孔板重复相同操作,分别于24、48、72 h各取出一个96孔板,每个浓度实验结果重复5次,取平均值计算细胞存活率。细胞存活率(%)=(实验组D均值-空白组D均值)/(对照组D均值-空白组D均值)×100。
1.7 Western blot检测STAT3和Bcl-2蛋白表达
将H9C2细胞接种在75 mm2细胞瓶中,加入15 mL含有10% FBS和1%双抗的DMEM,置于含5% CO2的37.5 ℃恒温培养箱中。根据细胞毒性试验(MTT法)结果,选取DMSO和DMF体积分数为0、0.2%、0.3%和0.5%加入75 mm2细胞培养瓶中,培养72 h后,取出细胞瓶放于冰盒上,每75 mm2中加入1 mL细胞裂解液,置于含5% CO2的37.5 ℃恒温培养箱中孵育3 min,加入含10% FBS终止消化,在方形冰盒上使用细胞刮充分刮下贴壁的细胞,吸取细胞裂解液加入无菌1.5 mL EP管中,放于冰盒上。收集蛋白完毕后,平衡EP管后放于离心机,12 000 r·min-1离心10 min,取上清加入无菌1.5 mL EP管中,按照5-1样品体积加5×蛋白上样缓冲液,沸水浴7 min,取出样品放于-80 ℃保存。检测目的蛋白STAT3和Bcl-2,先进行SDS-PAGE凝胶电泳,再半干转膜,TBS洗涤3次,10 min一次,5% BSA封闭1 h,4 ℃分别孵育STAT3抗体和Bcl-2抗体(5% BSA分别稀释抗体,比例均为1∶1 000)过夜,TBST充分洗涤3次,每次10 min,加入含辣根过氧化物酶(HRP)标记的二抗(稀释比1∶2 500)室温振荡1 h,TBST或TBS洗3次,每次10 min,将含目的蛋白的NC膜放入显影仪,滴加显影液(按照体积比1∶1配比)显影,拍照记录,以β-actin作为内参,使用Image J图像分析软件分析。
1.8 统计方法
采用SPSS 19.0进行统计学分析,以P<0.05和P<0.01分别作为差异显著性和差异极显著性判定标准。
2 结果与分析
2.1 细胞形态变化
观察加入0.3% DMSO和DMF培养心肌细胞24 h后形态变化,细胞生长较为缓慢,部分出现凋亡,形态短缩、不规则,细胞悬浮等变化。随着时间的延长,在48 h和72 h细胞贴壁数量减少,空泡、悬浮细胞量增加。

A和a为对照组(不含DMSO和DMF);B、C、D分别为0.3% DMSO对H9C2心肌细胞作用24、48、72 h的细胞形态图(5×和10×显微镜);b、c、d分别为0.3% DMF对H9C2心肌细胞作用24、48、72 h的细胞形态图(5×和10×显微镜)。A and a were control group (without DMSO and DMF); B, C, D, 0.3% DMSO on H9C2 cardiomyocytes for 24, 48, 72 h cell morphology map (5 × and 10 × microscope); b, c, d, 0.3% DMF on H9C2 cardiomyocytes for 24, 48, 72 h cell morphology map (5× and 10× microscope).图1 0.3% DMSO和DMF对H9C2心肌细胞形态变化影响Fig.1 Effects of 0.3% DMSO and DMF on morphological changes of H9C2 cardiomyocytes
2.2 MTT法检测细胞存活率变化
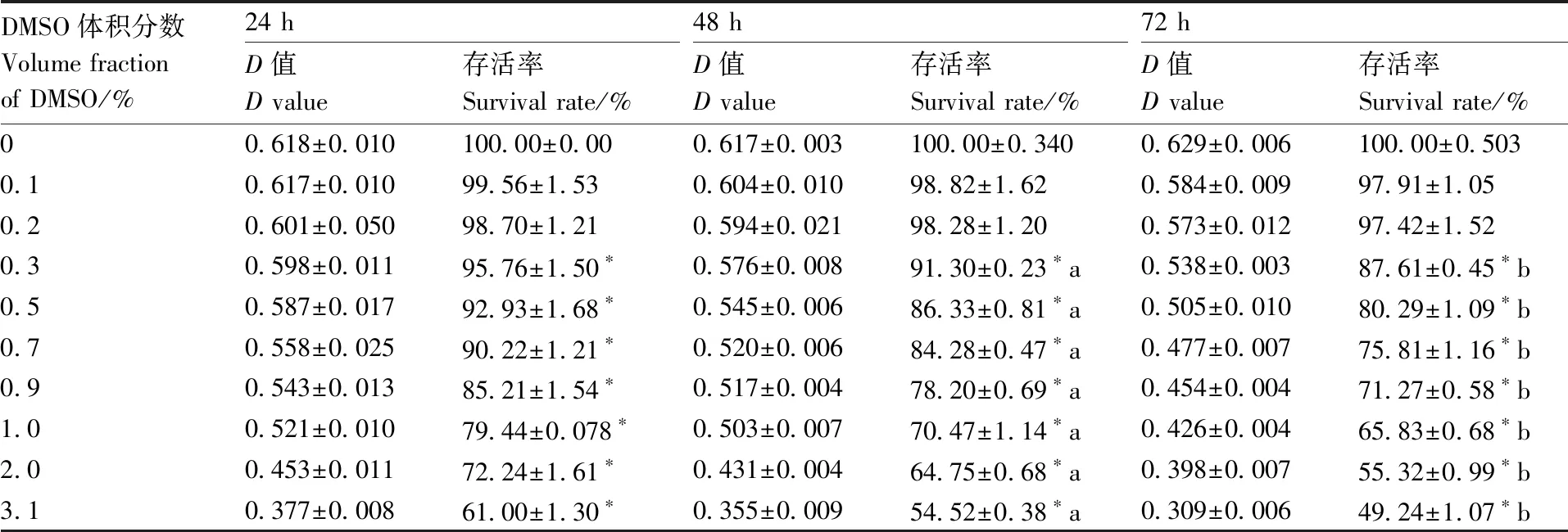
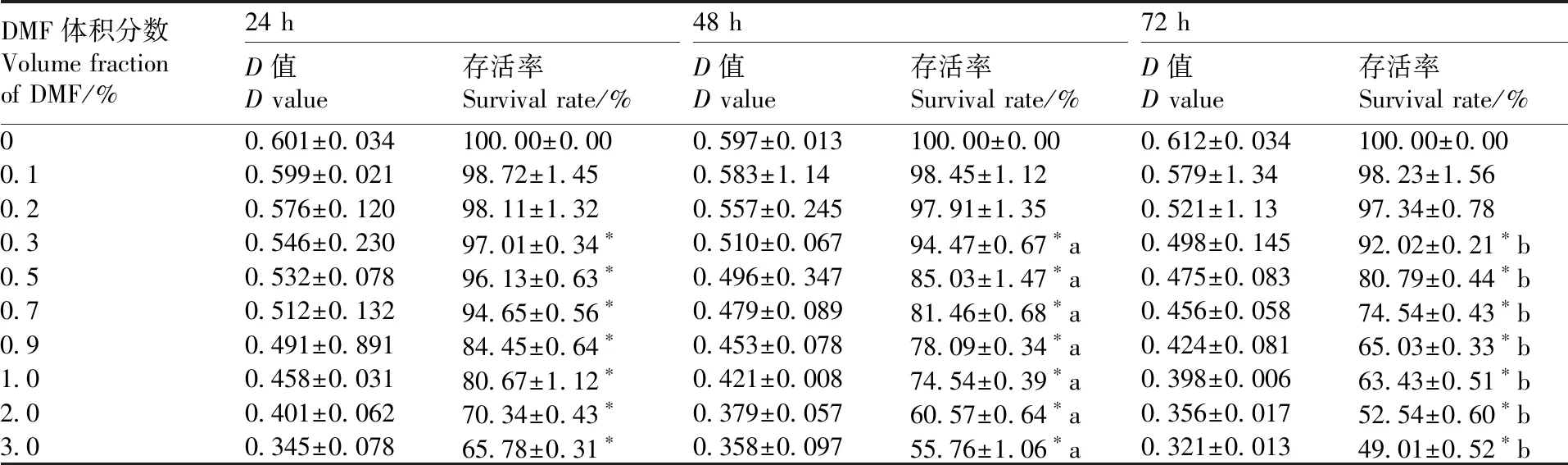
H9C2心肌细胞在DMSO和DMF不同体积分数作用下,通过MTT分别检测24、48和72 h细胞存活率变化(表1和表2),在DMSO和DMF体积分数为0.3%时,72 h对比48 h细胞存活率具有统计学意义(P<0.05),并随着DMSO体积分数的增加,细胞存活率逐渐下降。
2.3 Western法测定DMSO和DMF不同体积分数对STAT3蛋白表达的影响
检测DMSO和DMF作用H9C2心肌细胞72 h后,STAT3和Bcl-2的蛋白表达变化。如图3所示,与对照组比较,DMSO和DMF体积分数为0.3%和0.5%时,STAT3和Bcl-2蛋白的相对灰度值都具有统计学意义(P<0.01),但DMF体积分数为0.2%,STAT3有统计学意义(P<0.01),Bcl-2无统计学意义;DMSO体积分数为0.2%时,STAT3和Bcl-2与对照组比较均无统计学意义(P>0.05)。
表1MTT法检测DMSO对心肌细胞存活率的影响
Table1Effect of DMSO on myocardial cell survival rate by MTT assay
DMSO体积分数Volume fractionof DMSO/%24 hD值D value存活率Survival rate/%48 hD值D value存活率Survival rate/%72 hD值D value存活率Survival rate/%00.618±0.010100.00±0.000.617±0.003100.00±0.3400.629±0.006100.00±0.5030.10.617±0.01099.56±1.530.604±0.01098.82±1.620.584±0.00997.91±1.050.20.601±0.05098.70±1.210.594±0.02198.28±1.200.573±0.01297.42±1.520.30.598±0.01195.76±1.50∗0.576±0.00891.30±0.23∗a0.538±0.00387.61±0.45∗b0.50.587±0.01792.93±1.68∗0.545±0.00686.33±0.81∗a0.505±0.01080.29±1.09∗b0.70.558±0.02590.22±1.21∗0.520±0.00684.28±0.47∗a0.477±0.00775.81±1.16∗b0.90.543±0.01385.21±1.54∗0.517±0.00478.20±0.69∗a0.454±0.00471.27±0.58∗b1.00.521±0.01079.44±0.078∗0.503±0.00770.47±1.14∗a0.426±0.00465.83±0.68∗b2.00.453±0.01172.24±1.61∗0.431±0.00464.75±0.68∗a0.398±0.00755.32±0.99∗b3.10.377±0.00861.00±1.30∗0.355±0.00954.52±0.38∗a0.309±0.00649.24±1.07∗b
*,与对照组(不含DMSO)相比差异显著,P<0.05;a,与24 h组相比差异显著,P<0.05;b,与48 h组相比差异显著,P<0.05。下同。
*, The significance compared with the control group (without DMSO),P<0.05; a, The significance compared with the 24 h group,P<0.05; b, The significance compared with the 48 h group,P<0.05. The same as below.
表2MTT法检测DMF对心肌细胞存活率的影响
Table2Effect of DMF on myocardial cell survival rate by MTT assay
DMF体积分数Volume fractionof DMF/%24 hD值D value存活率Survival rate/%48 hD值D value存活率Survival rate/%72 hD值D value存活率Survival rate/%00.601±0.034100.00±0.000.597±0.013100.00±0.000.612±0.034100.00±0.000.10.599±0.02198.72±1.450.583±1.1498.45±1.120.579±1.3498.23±1.560.20.576±0.12098.11±1.320.557±0.24597.91±1.350.521±1.1397.34±0.780.30.546±0.23097.01±0.34∗0.510±0.06794.47±0.67∗a0.498±0.14592.02±0.21∗b0.50.532±0.07896.13±0.63∗0.496±0.34785.03±1.47∗a0.475±0.08380.79±0.44∗b0.70.512±0.13294.65±0.56∗0.479±0.08981.46±0.68∗a0.456±0.05874.54±0.43∗b0.90.491±0.89184.45±0.64∗0.453±0.07878.09±0.34∗a0.424±0.08165.03±0.33∗b1.00.458±0.03180.67±1.12∗0.421±0.00874.54±0.39∗a0.398±0.00663.43±0.51∗b2.00.401±0.06270.34±0.43∗0.379±0.05760.57±0.64∗a0.356±0.01752.54±0.60∗b3.00.345±0.07865.78±0.31∗0.358±0.09755.76±1.06∗a0.321±0.01349.01±0.52∗b
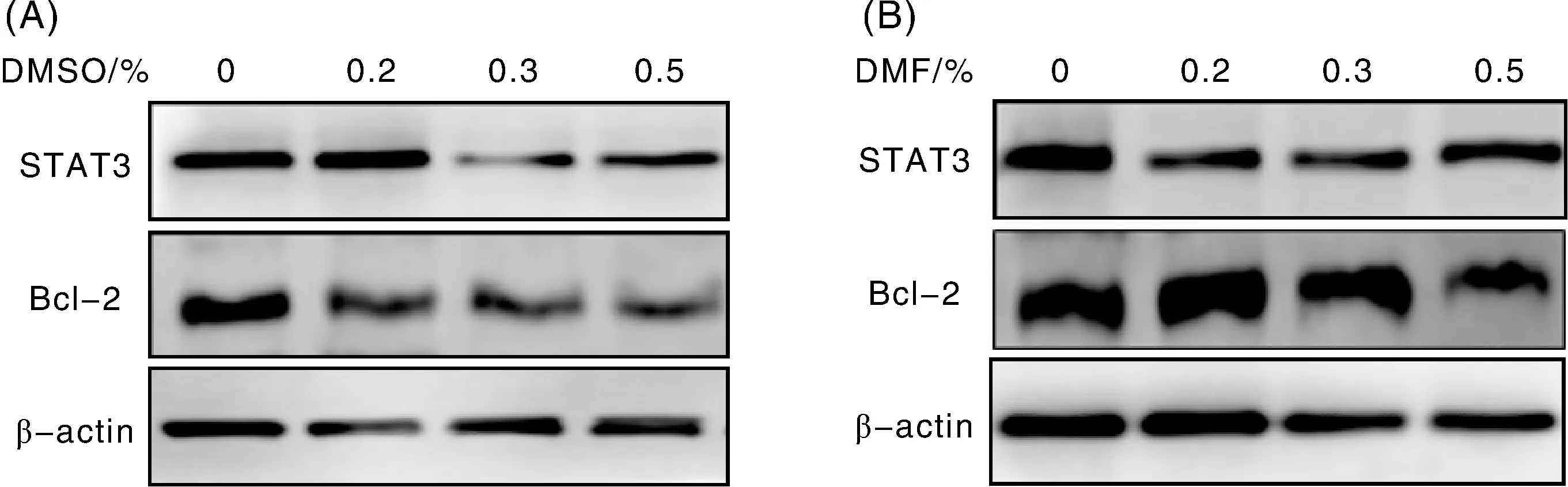
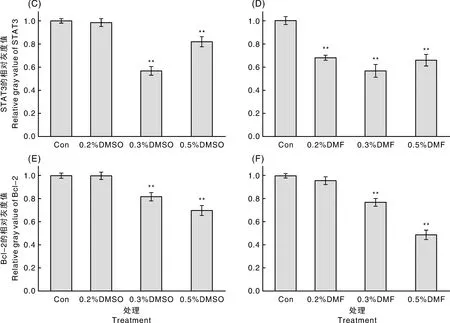
A、B,不同DMSO与DMF体积分数下STAT3和Bcl-2的Western blot结果图;C、D、E、F分别为不同DMSO与DMF体积分数下STAT3和Bcl-2的相对灰度值;**表示与对照组对比差异显著(P<0.01)。A, B, The Western blot results of STAT3 and Bcl-2 with different volume fraction of DMSO and DMF; C, D, E, F were the relative gray values of STAT3 and Bcl-2 with different volume fraction of DMSO and DMF;**, the significance compared with the control group (P<0.01).图2 STAT3和Bcl-2相对表达量的变化Fig.2 Changes of relative expression of STAT3 and Bcl-2
3 讨论
DMSO和DMF常被用作生物研究中的溶剂和药物治疗的载体,可与多种有机和无机物质完全混合,应用于治疗疾病和科学试验研究中,对不同细胞的毒性作用不可被忽略。有研究报道,DMSO对血液系统、兔视网膜上皮细胞等具有毒性作用,高浓度影响外周血单个核细胞(PBMCs)增殖和细胞因子分泌,在低浓度下降低T淋巴细胞的活性,抑制细胞的生长和细胞因子的分泌[7-11],但体外试验DMSO为0.1%~0.8%时作用大鼠心肌细胞6 h,对细胞活力无影响,抗氧化损伤作用机制与OH-1表达上调有关[12],推测DMSO对心肌细胞损伤具有治疗作用,体内试验却验证DMSO对脑死亡的大鼠心肌细胞无治疗作用,脑死亡(BD)所致大鼠心肌细胞凋亡作用机制与JNK信号通路的激活通过线粒体通路介导相关,线粒体凋亡通路受Bcl-2、caspase-3、Bax、Cyt-c蛋白影响[13]。DMF对消化系统、泌尿系统、心血管系统、生殖系统等具有损伤作用,主要通过皮肤和呼吸道感染。体外试验DMSO对心肌细胞产生炎性损伤作用,受活性氧和NF-κB调控[14]。本研究发现,DMSO和DMF对H9C2心肌细胞具有不同程度的毒性作用,抑制细胞生长,随着体积分数增加,细胞存活率逐渐降低,Bcl-2和STAT3蛋白表达均有下调,但当DMSO和DMF体积分数增加至0.5%时,STAT3表达上调,推测与机体平衡自身稳态相关,提示Bcl-2与STAT3蛋白可能共同调控DMSO和DMF对心肌细胞的凋亡机制。
Bcl-2家族分为抗凋亡和促凋亡蛋白。抗凋亡蛋白Bcl-2在线粒体介导的凋亡中起着重要的调节作用,通过表达上调,抵抗细胞凋亡损伤,癌细胞常常依赖Bcl-2来保护自己不受凋亡的影响。众所周知,Bcl-2蛋白的分布是一个决定细胞命运的动态过程。Bcl-2存在于线粒体、平滑的内质网(ER)、高尔基体、过氧化物酶体和细胞核中。Bcl-2主要定位于线粒体外膜,可抑制程序性细胞死亡,通过控制线粒体外膜通透性(MOMP),在线粒体中保留细胞色素C,抵抗细胞凋亡损伤[15]。Bcl-2蛋白的过度表达可以抑制Bax和Bak的激活,阻止细胞色素C的释放和caspase的激活共同改变细胞凋亡[16]。Bcl-2可抑制程序性细胞死亡,细胞淋巴瘤-2(bcl-2)家族的蛋白决定细胞的生命和线粒体自杀程序的凋亡,在程序性细胞死亡中,线粒体凋亡可能是最常见的形式,主要是去除多余的、感染的或受损的细胞[17]。线粒体是心肌细胞主要的能量供应,DMSO和DMF作用心肌细胞产生凋亡,检测抗凋亡蛋白Bcl-2表达降低,心肌细胞线粒体发生凋亡,细胞出现程序性死亡。
信号转导和转录激活因子3(STAT3)在多种细胞和组织中表达,是调节细胞增殖、凋亡和自噬等重要细胞过程的转录因子[18]。STAT3在几种实体癌和血液病中的一个或两个残基中被组成性磷酸化,活化的STAT3从细胞质转移到细胞核,与特定的启动子序列结合,然后调节抗凋亡和细胞周期,调控基因产物(如Bcl-2、XIAP和cyclinD1)的转录激活,发挥抗凋亡作用[19-20]。DMSO和DMF可能通过降低心肌细胞STAT3发生磷酸化,抑制Bcl-2蛋白表达,使细胞存活率下降。
