贝藻混养对舟山东极岛养殖海域二氧化碳的影响
2019-09-24吴杭纬经赵泓睿彭苑媛赵晟
吴杭纬经 赵泓睿 彭苑媛 赵晟

摘要[目的]研究混合培养是否能够促进藻类更好地吸收二氧化碳,从而在养殖区域中降低海洋二氧化碳浓度。[方法]在舟山东极养殖区现场进行一场模拟围隔试验,将贻贝和龙须菜按照不同的比例进行培养,用于吸收海水中的二氧化碳。[结果]贝藻混合培养下对二氧化碳的去除效果优于贝藻单独培养时的去除效果。而当贝藻按照比例为1.00∶0.15以及1.00∶0.30混合下培养时,海水中的最终二氧化碳浓度分别为1.00∶0.45比例下的5.5倍和2.2倍。[结论]选择1.00∶0.45比例培养贝藻有助于对海水中二氧化碳的吸收。
关键词 贝藻养殖;二氧化碳浓度;pH;模型计算法;舟山东极岛
中图分类号 S913文献标识码 A
文章编号 0517-6611(2019)15-0053-03
doi:10.3969/j.issn.0517-6611.2019.15.016
开放科学(资源服务)标识码(OSID):
Abstract[Objective]The research aimed to study whether polyculture was able to promote algae to absorb CO2 much better, thereby reducing the CO2 concentration in the cultured area.[Method]A simulated enclosure experiment was performed in an aquaculture zone located at Dongji Island of Zhoushan. Mytilus coruscus and Gracilaria lemaneiformis were cultured in different proportions for the determination of CO2 in seawater.[Result]The removal effect of CO2 in algaeshellfish polyculture was better than that in monoculture. When the Mytilus coruscus and Gracilaria lemaneiformis were cultured in a ratio of 1.00∶0.15 and 1.00∶0.30, the final CO2 concentration in seawater was 5.5 times and 22 times, respectively, at a ratio of 1.00∶0.45.[Conclusion]It will help to absorb CO2 in seawater by selecting the proportion of 1.00∶0.45 in an algaeshellfish polyculture.
Key words Algaeshellfish polyculture; CO2 concentration; pH; Model calculation;Dongji Island of Zhoushan
基金项目 NSFC-浙江两化融合联合基金项目(U1609204);浙江省自然科学基金项目(LY15D060006);國家重点研发计划支持项目(2017YFA0604902);舟山市科技局科技计划项目(2016C41017)。
作者简介 吴杭纬经(1994—),男,浙江湖州人,硕士研究生,研究方向:海洋碳循环。*通信作者,教授,博士,硕士生导师,从事海洋生态学研究。
收稿日期 2019-03-07
人类活动使大气中的二氧化碳浓度从工业前的0.028%增加到今天的0.040%[1]。到2100年,这种浓度预计将增加至0.1%[2]。这会导致温度上升,极端温度变化的放大可能造成比平均气温更严重的社会和健康影响[3]。在哥本哈根世界气候大会上,中国承诺到2020年单位GDP二氧化碳排放将比 2005年下降 40%~45%,非化石能源占一次性能源消费比重将达15%左右[4]。生物固碳就是一种是安全高效、经济可行的固碳途径与固碳工程[5]。
海洋生物的固碳引起更多关注,海洋碳不仅通过调控和吸收直接影响全球碳循环,还以其巨大的碳汇功能吸收了人类排放二氧化碳总量的20%~35%,有效延缓了温室气体排放对全球气候的影响[6-7]。根据联合国环境规划署《蓝碳》报告[8],海洋生物(包括浮游生物、细菌、海藻、盐沼和红树林等)固定了全球 55% 的碳。海洋植物(海草、海藻、红树林等)的固碳能力极强、效率极高,其生物量虽然只有陆生植物的 0.05%,但两者的碳储量不相上下[9]。海洋是地球上最大的碳库,达39.1万亿t碳,为大气储碳量的53倍,而渔业碳汇能通过渔业生产活动促进水生生物吸收水体中的 CO2,并通过收获这些已经转化为生物产品的碳和移出水体的机制从而减少水体中的二氧化碳,其主要通过藻类养殖、贝类养殖、增殖放流以及捕捞业等方式来实现。
由于海水贝藻养殖固碳提出的“碳汇渔业”理念尚处于研究的初级阶段,在过程与机制方面的基础研究多比较分散,尚存在很多不足的问题。该研究选择浙江典型的海水养殖海域为研究地点,以典型的养殖贝类厚壳贻贝为研究对象,对其固碳相关生理生态学环节进行研究。比起贝藻单养,贝藻混养能够更有效地吸收利用 CO2,进而能够有效调节全球海-气 CO2交换。我国学者在山东桑沟湾对栉孔扇贝与海带、龙须菜混养研究证实了这一点,但对于贝、藻混合比例未给出具体的最佳混养比例,对于浙江海域典型的厚壳贻贝及其与相关海藻混养促进碳汇研究鲜见报道。笔者以厚壳贻贝龙和须菜为材料,通过围隔试验比较研究,预期给出具体的混养比例,提出最佳的扩增碳汇途径,为“碳汇渔业”理论提供科学依据。
1 材料与方法
1.1 材料
该试验采用东极养殖区的厚壳贻贝Mytilus coruscus(重量约为100 g,尺寸为长12 cm、宽4 cm,误差为正负0.5 cm)和龙须菜Gracilaria lemaneiformis(烘干称重,测量重量约为30 g)作为研究对象。通过实际养殖海域的跟踪监测和典型养殖实验基地的现场围隔试验进行分析。
1.2 方法
试验中的试验模型如图1所示,整个试验模型分为2个部分。水面上有4个浮球和2个长线筏,水下挂着一个网。浮子的直径约为22 cm,这4个浮子的存在确保了整个模型完全浸没在水中并且没有下沉。 长线筏可以固定浮子和模型,以防止它漂移。 网内有填充海水的塑料袋,其中包含贻贝和龙须菜的试验样本。
在该试验中,根据0∶0(对照)、1∶0(M1)、0∶1(M2)、1∶015(P1)、1∶0.30(P2)、1∶0.45(P3)的比例将贻贝和龙须菜分为6组。 每2 h测量盐度、DO浓度和pH,作为连续测量。 通过特定的专用仪器在现场进行盐度、pH和DO的测定。 每组每次在测量时将每组取出50 mL的水样装在白色塑料瓶,并在试验结束后返回实验室进行溶解无机碳。整个试验进程温度控制在24~25 ℃。通过模型法计算水中的CO2浓度(10-3 mol/L),其公式如下:
2 结果与分析
2.1 pH的变化趋分析
从图2可看出,培养前后海水的pH保持在8.0和9.0。 在该研究中,对照组中仅温度和微生物对pH具有弱的影响,并且在培养期间pH几乎恒定,仅为7.87~7.99。 与对照组相比,M1比例为1∶0的pH呈下降趋势,最低pH为7.51,显著低于对照组。M1主要是通过贻贝的单次呼吸来产生CO2[10]。当比例为0∶1时,M2的pH增加,表明只有当含有龙须菜时,阳光才能被叶绿素吸收,并且海水中的二氧化碳被吸收用于光合作用,从而降低了海水的酸度[11],最终的pH为8.41。 增加二氧化碳和降低pH对浮游植物生理学的影响,特别是呼吸和光合作用的速度,可能导致相反的生长反应,其中一种或另一种占主导地位,这取决于其他条件[12-13]。如图2所示,由于龙须菜的光合作用高于贻贝的呼吸作用,因此藻类 - 贝类混养的3组pH较高。P1、P2和P3组具有相似的趋势,先增加后减小至平缓,最后再增加。 pH的第一次增加是由于龙须菜的光合作用,而减少的原因是日落后贻贝和龙须菜的呼吸作用,产生大量的二氧化碳,导致海水酸度的增加和pH下降。pH的后期增加是由于龍须菜重新启动光的协同作用。尽管趋势相似,但变化的幅度仍然不同,最终的pH为P3>P2>P3。 P3的最终pH为899。 这一结果表明藻类的含量越多,能够产生更活跃的生物活性[14]。具有适当比例的混养将比藻类或贝类单一栽培更好地控制海水中的CO2。在该研究中,当比例为1∶0.45时,海水中CO2的吸收是最好的。
2.2 DO的变化趋势分析
从不同比例的藻类 - 贝类混养中DO(溶解氧)的变化趋势(图3)可看出, 在对照组中,DO的趋势是稳定的,浓度几乎不变且保持在约10 mg/L。由于贻贝的呼吸作用,培养期间M1中比例为1∶0的DO持续降低。 在培养结束时,浓度降至3.89 mg/L的低水平,这是初始值的39.3%,与pH一样低[15]。
海水中的DO来自浮游植物的光合作用和来自大气的一部分的氧的溶解。消费的主要途径包括有机物质的降解和水生生物的呼吸,如大型无脊椎动物[16-17]。如果水中的DO含量低于5 mg/L,则会对水生生物的存活产生负面影响;当它低于2 mg/L时,会导致鱼类窒息死亡,大多数藻类不能同时存活[18]。从图3可以看出,龙须菜中加入龙须菜可以有效防止DO的快速下降,保证贝类的正常生长。 在其他组中,龙须菜的光合作用和贻贝的呼吸作用使得趋势一致,这与pH的变化非常相似。 M2、P1、P2、P3的DO在8~20 mg/L处呈现连续下降趋势,这是由于夜间缺光。龙须菜和贻贝呼吸的需要消耗了大量的氧气。 M2仅含有龙须菜,因此浓度降低较少; 并且3组多元培养物中的最终DO浓度为P3>P2>P1。 P3的比例为1∶0.45的DO最高,最终浓度为19.52 mg/L。 国外相关研究表明,DO受水温、浮游植物、pH、悬浮物浓度等因素的限制[19]。有研究表明DO与pH线性相关[20],pH对DO的影响表现为生化过程。
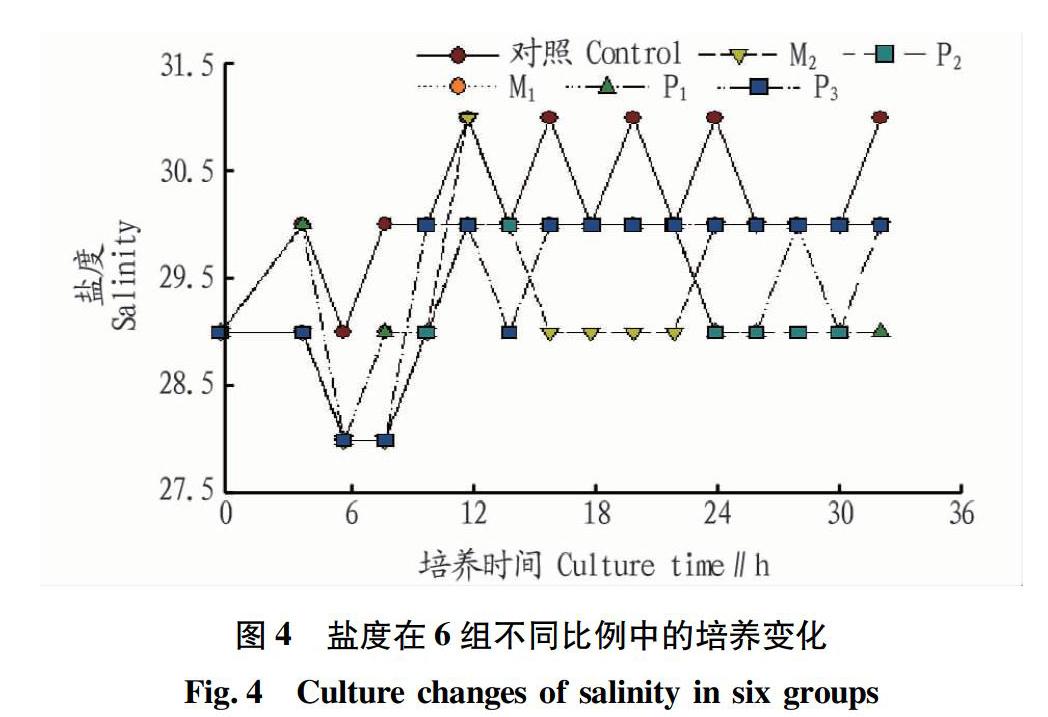
2.3 盐度的变化趋势分析
根据藻类 - 贝类混养的不同比例,记录了海水盐度的变化。 从图4可以看出,盐度为28~31;其他组的盐度最终浓度低于对照组31,最低盐度P1为29。有研究指出盐度与光合作用和呼吸密切相关[21]。Shafer等[22]指出,北美Z.japonica光合特性种群最适应中度盐度,在盐度为20时显示出最小呼吸速率,较低的补偿辐照度、较高的饱和辐照度和较高的光饱和光合速率,光合效率长期接触盐度为5~35。 因此,由于光合速率和呼吸速率,6组中的盐度产生了变化。根据以上讨论,该试验中最合适的P3的平均盐度约为30。
2.4 海水中二氧化碳浓度
根据DIC和公式计算CO2浓度,得到不同藻类-贝类比例培养物中CO2浓度的变化。 从图5可看出,对照组的CO2浓度在培养期间漂浮在50.44×10-3~60.99×10-3 mol/L。 在培养期间,M1中1∶0的CO2浓度继续上升,在第32小时达到141.1×10-3 mol/L。因此,当仅含有贻贝时,对贻贝呼吸产生的CO2的增加没有限制。 图5显示,海水中其他CO2浓度在前10 h内迅速下降,然后由于夜间CO2浓度略有增加,但最终在龙须菜的作用下降低。根据M2中CO2浓度低于P1的数据,表明混合P1吸收CO2的效果不如藻类单一栽培效果好。当比例为1∶0.45(P3)时,认为海水中CO2浓度变化率最快,为1.446×10-3 mol/(L·h),最终CO2浓度至少为4.504×10-3 mol/L。从变异曲线可以看出龙须菜的光合速率高于呼吸速率。根据表1,在3组藻类-贝类比例中,P1和P2的最终CO2分别是P3的5.5和2.2倍。该研究表明,P3扩增了最多的碳汇,是最合适的培养比例。
3 讨论
在国内外众多的学者研究中对于碳汇的计算方法有很多种,培养类型也数不胜数。在单一培养中,对于贝类碳汇计算最常见的方法就是利用贝类在生命活动中需要水体中的碳酸根离子来对海洋中的碳实现固定,所以可以从贝壳的碳的含量和贝壳的整体重量来粗略计算碳汇值。对于贝类的软组织来说,它把海洋中的微藻和一些有机颗粒作为食物,可以有效地固定这些食物中的碳。当海洋中的碳含量降低后,位于大气中的二氧化碳就会溶解于海水中,从而减少了大气中二氧化碳含量,这对于调节整个大气二氧化碳含量起到非常重要的作用。对于藻类碳汇计算最常见的方法就是收获和捕获藻类之后通过质量分数计算碳汇值。但藻类除了自身能够贡献碳汇外,其生命活动可以直接吸收海洋中的二氧化碳,然后还可以影响海洋中二氧化碳的分压,使其降低,促进大气中的二氧化碳向海水中溶解。对于贝藻混养模式发展较缓慢,养殖户和学者近几年开始逐渐关注和研究。区分于投饵式水产养殖体例,浙江省海水养殖多以贝藻类综合养殖为主,多养分条理综合养殖不但可以有效地发挥养殖海区的空间利用本领,更能增进各养分有条理地配合养殖生物并且健康发展。而在海洋生物固碳这一方面,更是具有其奇特的优点。在贝类与海藻综合养殖的过程当中,贝类经由过程滤食净化海水的同时,无机氨氮及有机排泄物可以被被大量产出,这些恰恰是可以提供海藻发展的营养物质;而海藻则经由光合作用过程,吸收大量二氧化碳发生大量的氧气,照顾到了贝类的正常代谢,被海藻自身排泄出来的消融有机颗粒,也可以成为贝类的食品。两者各自行使其固碳职能的同时,又达到了相互促进。通过收获养殖的贝类和藻类到岸上,使得大量的碳可以从海洋中移出,尤其是移出的贝壳中的碳可称为较为持久的碳汇,促进了海洋碳汇的功能。不管是养殖效率还是环保效率都比单一培养要高。最常见的贝藻综合培养碳汇的计算方式为贝类养殖的CO2吸收量和藻类养殖的CO2吸收量之和。
在贝藻养殖模式下,有很多不同的养殖模式,根据不同的贝类和藻类来定义。可以对于不同种类的贝类和藻类综合养殖来进行研究,比如扇贝和海带的混养、扇贝和紫菜的混养;也可以对于同一种混养而比例不同进行研究,如此次试验。通过观察上述研究数据可以清晰地得出结论,P3(1∶0.45)组的培养效果最好。此次试验的创新之处是在于利用不同的思维模式,较好地掌握了碳汇的定义和概念,计算了水体中的二氧化碳浓度,间接地得出了最佳碳汇扩增的比例模型。与传统的计算方法和模型相比更便捷,也更簡单。传统的计算方法需要大量的数据支撑,对于贝类的计算需要肉壳分离,分别检测和计算各自的碳汇值,而且对于养殖海域来说计算过程中会忽略表面海水沉入海底的有机碳。对于藻类来说不同的结构因素和产量因素都对碳汇起到了非常重要的作用。此次试验也存在不足之处,没有计算出具体的碳汇值,无法与传统方法一样客观地得到碳汇值的比较,未来需要研究出与之相结合的计算方法,可为日后的碳汇计算和碳汇扩增提供参考;由于海域条件的限制,混养比例组别不够多,无法完成更全面的对比,未来会在贝藻混养方面做更深入的研究,为渔民和大气环境做出贡献。
47卷15期 吴杭纬经等 贝藻混养对舟山东极岛养殖海域二氧化碳的影响
参考文献
[1]GOTO D,MORIMOTO S,AOKI S,et al.Vertical profiles and temporal variations of greenhouse gases in the stratosphere over Syowa Station,Antarctica[J].SOLA,2017,13:224-229.
[2]GOLDMAN J A L,BENDER M L,MOREL M M.The effects of pH and pCO2 on photosynthesis and respiration in the diatom Thalassiosira weissflogii[J].Photosynth Res,2017,132:83-93.
[3]MEEHL G A,COVEY C,TAYLOR K E,et al.The WCRP CMIP3 multimodel dataset:A new era in climate change research[J].Bull Am Meteorol Soc,2007,88(9):1383-1394.
[4]SHIOGAMA H,CHRISTIDIS N,CAESAR J,et al.Detection of greenhouse gas and aerosol influences on changes in temperature extremes[J].SOLA,2006,2:152-155.
[5]WANG B,LI Y Q,WU N,et al.CO2 biomitigation using microalgae[J].Appl Microbiol Biotechnol,2008,79(5):707-718.
[6]BOUILLON S,RIVERAMONROY V,TWILLEY R,et al.The management of natural coastal carbon sinks[M]//LAFFOLEY D,GRIMSDITCH G.The management of natural coastal carbon sinks.Gland,Switzerland:IUCN,2009.
[7]HOOD M,BROADGATE W,URBAN E,et al.Ocean acidification:A summary for policymakers from the second symposium on the Ocean in a HighCO2 World[R].IOC,2009.
[8]NELLEMANN C,CORCORAN E,DUARTE C M,et al.A rapid response assessment[R].Nairobi:United Nations Environment Programme,GRIDArendal,2009.
[9]TANG Q S,ZHANG J H,FANG J G.Shellfish and seaweed mariculture increase atmospheric CO2 absorption by coastal ecosystems[J].Marine ecology progress series,2011,424:97-104.
[10]RUGINIS T,ZILIUS M,VYBERNAITELUBIENE I,et al.Seasonal effect of zebra mussel colonies on benthic processes in the temperate mesotrophic Plateliai Lake,Lithuania[J].Hydrobiologia,2017,802(8):23-38.
[11]PORZIO L,BUIA M C,FERRETTI V,et al.Photosynthesis and mineralogy of Jania rubens at low pH/high pCO2:A future perspective[J].Science of the total environment,2018,628/629:375-383.
[12]HOPKINSON B M,XU Y,SHI D L,et al.The effect of CO2 on the photosynthetic physiology of phytoplankton in the Gulf of Alaska[J].Limnology and oceanography,2010,55(5):2011-2024.
[13]WU Y P,GAO K S,RIEBESELL U.CO2induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum[J].Biogeosciences discussions,2010,7(9):2915-2923.
[14]ZHOU L H,ZHENG T L,WANG X,et al.Effect of five chinese traditional medicines on the biological activity of a redtide causing algaAlexandrium tamarense[J].Harmful Algae,2007,6(3):354-360.
[15]殷燕,吳志旭,刘明亮,等.千岛湖溶解氧的动态分布特征及其影响因素分析[J].环境科学,2014,35(7):2539-2546.
[16]杨丽娜,李正炎,张学庆.大辽河近入海河段水体溶解氧分布特征及低氧成因的初步分析[J].环境科学,2011,32(1):51-57.
[17]DING Y K,RONG N,SHAN B Q.Impact of extreme oxygen consumption by pollutants on macroinvertebrate assemblages in plain rivers of the Ziya River Basin,north China[J].Environmental science & pollution research,2016,23(14):14147-14156.
[18]CHAPMAN D V.Water quality assessments:A guide to the use of Biota,sediments and water in environmental monitoring[M].London:Chapman&Hall,1992.
[19]YAMADA Y,MITO Y,IGETA A,et al.Dissolved oxygen concentration in river sediment of the Lake Biwa tributaries,Japan[J].Limnology,2012,13(1):149-154.
[20]WUNGRAMPHA S,JOSHI R,SINGLAPAREEK S L,et al.Photosynthesis and salinity:Are these mutually exclusive?[J].Photosynthetica,2018,56(1):366-381.
[21]MOHAMMADI M H,KHATAAR M,SHEKARI F.Effect of soil salinity on the wheat and bean root respiration rate at low matric suctions[J].Paddy & water environment,2017,15(3):639-648.
[22]SHAFER D J,KALDY J E,SHERMAN T D,et al.Effects of salinity on photosynthesis and respiration of the seagrass Zostera japonica:A comparison of two established populations in North America[J].Aquatic botany,2011,95(3):214-220.
