竹屑提取物的抑菌活性及其水解研究
2019-09-24王嵘李卫华
王嵘 李卫华
摘要 以大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌为供试菌种,研究了不同提取温度、时间对竹屑提取物抑菌效果的影响,考察了不同水解条件下还原糖的得率,初步分析了还原糖的种类。结果表明,以95%乙醇为提取剂,在温度为50 ℃下加热回流提取2.5 h得到的竹屑提取物的抑菌效果最好,总黄酮得率也最高(0.86%),说明总黄酮可能是竹屑提取物中主要的抑菌活性成分;竹屑提取物对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌的最小抑菌浓度分别为0.062 5、0.031 3、0.125 0 g/mL;在115 ℃下用4.5%稀硫酸水解1.5 h,总还原糖得率最高(66.57%);色谱分析表明,竹屑水解后的主要还原糖有阿拉伯糖、果糖、葡萄糖。
关键词 竹屑; 提取物;抑菌活性;水解;还原糖
中图分类号 TQ914.1文献标识码 A
文章编号 0517-6611(2019)15-0064-04
doi:10.3969/j.issn.0517-6611.2019.15.019
开放科学(资源服务)标识码(OSID):
Abstract The effects of extraction time and temperature on antibacterial activities of the extract from bamboo chips against Escherichia coli, Staphylococcus aureus and Bacillus subtilis were tested. The yield of reducing sugar under different hydrolysis conditions was studied, and species of reducing sugar were analyzed.The results indicated that the extract from bamboo chips extracted for 2.5 h under 50 ℃ using 95% ethyl alcohol had the best antifungal activity and the highest yield (0.86%)of general flavone,which implied that general flavone could be the main antibacterial activity ingredients in bamboo chips extract.Minimum inhibition concentration(MIC) of the bamboo chips extract was 0.062 5, 0.031 3 and 0.125 0 g/mL for S.aureus,B.subtilis and E.coli,respectively. Bamboo chips hydrolyzed for 1.5 h under 115 ℃ using 4.5% sulphuric acid solution, the yield of total reducing sugars was the highest(66.57%). Chromatographic analysis indicated that the main reducing sugars were arabinose, fructose and glucose.
Key words Bamboo chips;Extract;Antibacterial activity;Hydrolysis;Reducing sugar
基金项目 安徽省重点研发项目(1704a0902006)。
作者简介 王嵘(1989—),女,安徽合肥人,助教,硕士,从事固体废物处理与利用研究。*通信作者,教授,博士,從事废水生物处理及其反应过程的分子光谱解析研究。
收稿日期 2019-04-25
我国有丰富的竹类资源,素有“竹子王国”之称,现有竹类植物42个属,500多个种,竹林面积421万hm2[1],无论是竹种资源、竹林面积,还是竹林蓄积产量均居世界首位。竹子广泛应用于建筑、家具、炭、制浆造纸及纺织等行业。目前,我国竹子采伐后,大量竹叶和竹竿被废弃,竹加工过程中产生的竹屑也被废弃,竹材利用率平均不到50%,有的产品竹材利用率甚至不到20%[2]。竹加工废弃物的资源化利用问题应该受到重视。
从20世纪60年代开始,抗生素作为饲料添加剂被广泛应用于畜牧及水产养殖动物的疾病防治[3]。然而动物性产品中抗生素的残留威胁了消费者身体健康,同时也造成了环境中抗生素的残留污染。开发绿色、无污染的饲料添加剂迫在眉睫。研究表明,竹叶中含有大量的黄酮类化合物和生物活性多糖等有效成分,其中的酚酸类化合物、蒽醌类化合物、萜类内酯和生物碱等都有着较强的抑菌杀菌作用[4],竹提取物也具有广谱抑菌活性[5]。因此,从竹加工废弃物中提取活性物质用于制备饲料添加剂值得研究[6]。竹屑中纤维素、半纤维素和木质素的含量较高[7],而纤维素和半纤维素在适当条件下水解发酵可制备功能性低聚糖、木糖、阿拉伯糖和半乳糖等[8],得到的糖还可进一步生产燃料乙醇、木糖醇、糠醛等工业产品[9-12]。开展竹屑的水解制糖研究可以提高竹子资源的利用率和经济价值。
笔者通过体外抑菌试验研究了不同提取条件下获得的提取物对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌效果,考察了不同水解条件下还原糖的得率,初步分析了还原糖的种类,以期为竹加工废弃物的资源化利用提供理论依据和技术支撑。
1 材料与方法
1.1 材料
竹屑样品采自安徽省广德县某竹加工厂,竹屑样品经自然风干后密封保存。试验用菌:大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)购自中国科学院微生物研究所。
1.2 药品与试剂 葡萄糖、D-木糖、L-阿拉伯糖、果糖标准品均购自上海融禾医药科技有限公司;3,5-二硝基水杨酸、氢氧化钠、丙三醇、酒石酸钾钠、醋酸钠、冰乙酸、乙腈、硫酸为分析纯,芸香叶苷、无水乙醇、纤维素酶、绿色木酶(≥15 000.0 U/g)、营养琼脂培养基等。
1.3 仪器设备
EYEL4-N-1100型旋转蒸发仪(上海爱朗);SW-CJ-2FD型超净工作台(上海博讯);AL104型电子天平(梅特勒);DHP-9082型电热恒温培养箱(上海一恒);LDZX-50KBS型立式压力蒸汽灭菌器(上海申安);UV-1800型紫外分光光度计(日本岛津);Nicolet 8700型红外光谱仪(美国热电)。
1.4 方法
1.4.1 竹屑中抑菌活性物质的提取条件。
以竹屑为原料,以95%乙醇为提取剂,固液比1∶10(g∶mL),通过抑菌圈试验,研究不同提取温度和提取时间下提取物对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌效果。
1.4.2 体外抑菌试验方法。
1.4.2.1 供试菌悬浮液制备[13]。从预先活化的菌种中分别挑取2环制成菌悬液,然后用无菌水稀释至含菌体107~108 CFU/mL,即得供试菌悬液[14],备用。
1.4.2.2 抑菌试验方法。在已灭菌的肉汤培养基平皿内分别加0.1 mL菌悬液,涂布均匀,用打孔器打1个直径6 mm圆孔,再用少量未冷却的培养基填封孔底。冷却后,圆孔加入0.5 g/mL竹提取物,在37 ℃恒温箱中培养24 h取出,测定抑菌圈直径。
1.4.2.3 最小抑菌浓度(MIC)的测定。用2倍稀释法[15]将1.0 g/mL提取物逐级稀释成不同浓度,在各平皿内分别加入2 mL不同浓度的提取液,然后将已倒入15 mL经高温灭菌的培养基充分混匀,冷却凝固后,每皿加入0.1 mL菌悬液,涂布均匀,培养方法同上,以24 h不长菌的提取液浓度为最小抑菌浓度,以上每个处理3个重复[16-17]。
1.4.3 竹屑提取物中总黄酮含量的测定。提取物中总黄酮的测定采用文献[18-19]的方法。
1.4.4 竹屑的水解方法。
1.4.4.1 硫酸水解法。称取100.0 g竹屑样品于具塞三角瓶中,按照固液比1∶10分别加入4.5%硫酸溶液或40%硫酸溶液,在115 ℃条件下水解1.5 h。
1.4.4.2 氢氧化钠水解法。称取100.0 g竹屑样品于具塞三角瓶中,按照固液比1∶10分别加入20%或40%氢氧化钠溶液,在120 ℃条件下水解45 min。
1.4.4.3 纤维素酶水解法。称取100.0 g竹屑样品于具塞三角瓶中,按照固液比1∶10加入酶活力≥15 000 U/g的纤维素酶缓冲溶液(pH=8),在120 ℃条件下反应40 min。
1.4.5 水解液中总还原糖含量的测定。总还原糖测定采用DNS法[20]。
1.4.6 水解液中主要还原糖含量的测定。10 mL水解液中加入0.1 g经处理后的活性炭,经Sep PakC18小柱(1 g/6 mL)净化后,采用HPLC法测定水解液中主要还原糖含量。测定条件如下:
高效液相色谱仪(Waters 600E);色谱柱:Zorbax NH2柱(250 mm×4.6 mm,5 μm);流动相∶乙腈/水=81∶19;流速1.0 mL/min;检测器:蒸发光检测器;进样体积10 μL。
1.4.7 竹屑红外光谱的测定。将竹屑样品与KBr一起进行充分研磨,壓片后进行红外光谱测定[21],波数范围:400~4 000 cm-1,分辨率为(波数)1 cm-1。
2 结果与分析
2.1 不同提取条件下竹屑提取物对3种病原菌的抑菌效果
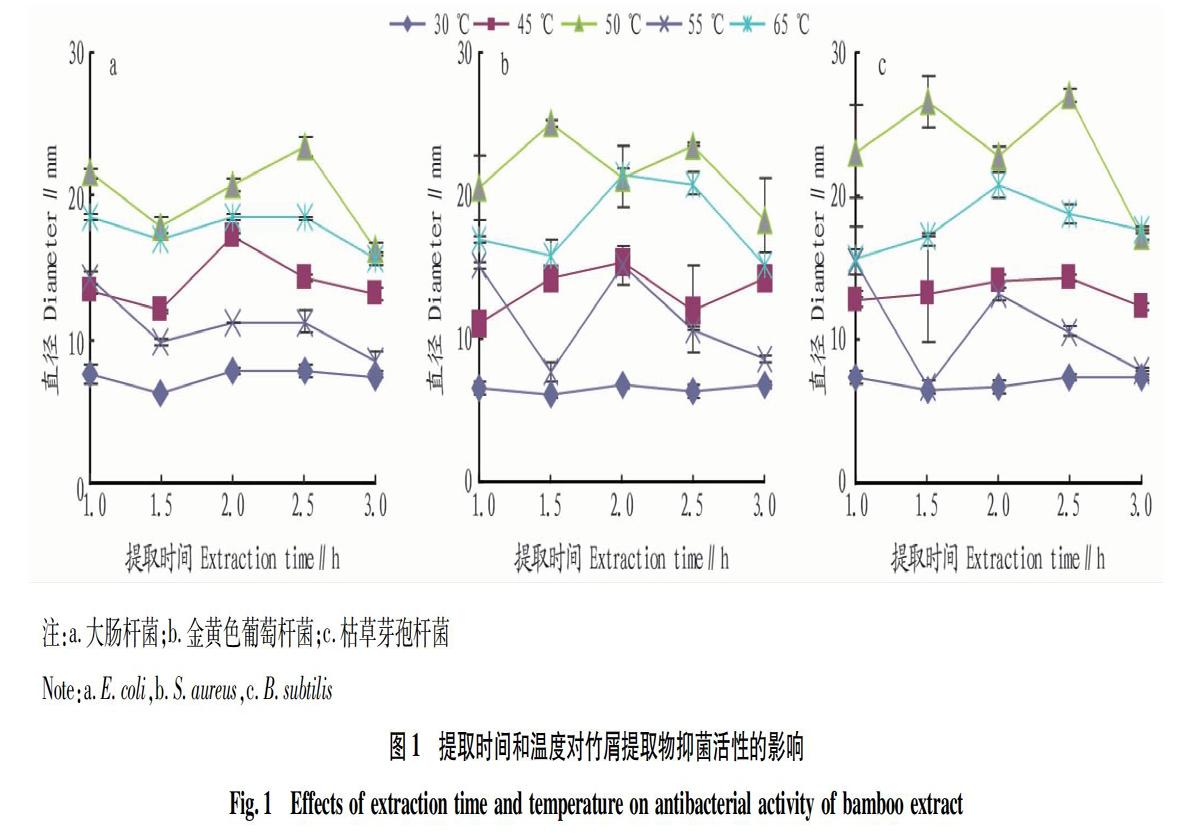
竹屑中的主要抑菌成分是多羟基类成分,包括多酚类、黄酮类、丹宁类等,植物中抗菌成分的含量、种类等除受遗传因素、环境条件等的影响外,还与植株部位、采收时间等有直接关系[22]。以大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌为供试菌种,采用抑菌圈法对不同提取条件下提取物抑菌特性进行研究。从图1可以看出,以无水乙醇稀释到95%乙醇为提取剂,不同提取条件下的竹屑提取物对3种病原菌都有一定的抑菌作用,但抑菌效果有差异。不同温度下竹屑提取物对3种病原菌的抑菌效果从好到差依次为50、65、45、55、30 ℃。对枯草芽孢杆菌抑制效果较强的是50 ℃条件下竹屑提取物,抑菌圈直径为17.20~27.30 mm,抑菌效果最差是30 ℃条件下竹屑提取物,抑菌圈直径为7.50 mm左右。提取时间对提取物抑菌效果的影响没有明显的规律性。总体来说,对3种菌抑菌效果均较好的是在50 ℃条件下提取2.5 h的竹屑提取物。
2.2 竹屑提取物的最小抑菌浓度 在相同时间内,竹提取物浓度越高,抑菌率越高;同一浓度的竹提取物,作用时间越长,抑菌率越高[23-24]。为了了解竹屑提取物对3种细菌的最小抑菌浓度,采用二倍稀释法将50 ℃条件下提取2.5 h的竹屑提取物稀释不同倍数后进行抑菌试验,观察无菌生长管所含最低药物浓度即为最小抑菌浓度(MIC)。从表1可以看出,金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌对竹屑提取物的敏感性不同,竹屑提取物对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌的最小抑菌浓度分别为0.062 5、0.031 3、0125 0 g/mL。
2.3 提取条件对提取物中总黄酮得率的影响
黄酮类化合物是自然界中存在的酚类物质,属植物次级代谢产物,是自然界药用植物中主要活性成分之一,具有抑菌和改善动物生长等作用[25]。以95%乙醇为提取剂,不同提取温度和时间条件下竹屑提取物中总黄酮得率见表2。从表2可以看出,提取温度在30~65 ℃,提取时间1.0~3.0 h,提取物中总黄酮得率为0.03%~0.86%,在提取温度为30 ℃条件下,总黄酮得率为0.03%~0.05%,且不同的提取时间黄酮得率变化不大;提取温度为45 ℃条件下,总黄酮得率为0.19%~044%,明显高于30 ℃条件下;提取温度为50 ℃条件下,提取物中总黄酮得率相对最高;提取温度升高到55 ℃后,总黄酮得率略有下降,温度从55 ℃升高到65 ℃后,总黄酮得率基本无变化。提取时间对总黄酮得率的影响程度低于提取温度的影响。由此可见,以95%乙醇为提取剂,在50 ℃条件下提取2.5 h总黄酮得率最高(0.86%)。不同提取条件下竹屑提取物中总黄酮得率的变化规律与不同提取条件下竹屑提取物对3种病原菌的抑菌效果变化规律基本一致,说明总黄酮可能是竹屑提取物中主要的抑菌活性成分。
2.4 竹屑的水解研究
2.4.1 不同水解液对还原糖得率的影响。
竹屑中纤维素、半纤维素和木质素的含量较高。纤维素是由葡萄糖组成的大分子多糖,半纤维素主要由木糖、阿拉伯糖、半乳糖、甘露糖组成,而纤维素和半纤维素在适当条件下水解可制备木糖、阿拉伯糖、半乳糖等,因此,开展了竹屑的水解研究,为竹屑的资源化利用提供参考。从图2可以看出,竹屑经硫酸溶液水解后还原糖得率明显优于氢氧化钠溶液。硫酸溶液浓度对还原糖的得率影响较大,4.5%硫酸溶液水解后还原糖得率为66.57%,而40%硫酸溶液水解后还原糖得率为4230%。竹屑经氢氧化钠溶液水解后还原糖得率较低,且氢氧化钠溶液的浓度对还原糖的得率影响不大,20%氢氧化钠溶液和40%氢氧化钠溶液水解后还原糖的得率分别为2760%和25.45%,竹屑经纤维素酶水解后还原糖得率为55.30%,高于氢氧化钠溶液水解,低于4.5%硫酸溶液水解的还原糖得率。可见,竹屑经4.5%硫酸溶液水解后还原糖的得率最高。目前,纤维素的化学水解仍以酸为主,其他的水解方法尚在探索之中。
2.4.2 竹屑水解的主要产物。
竹屑中含有25%左右的半纤维素,在适当条件下水解,可获得果糖、阿拉伯糖、葡萄糖等,竹屑水解液中含有大量色素及胶质,给直接进样分离测定带来困难。该研究探讨了试样的净化方法,水解液经活性炭、Sep PakC18小柱净化后,水解液无色透明,用HPLC测定各还原糖的含量。从图3可以看出,竹屑水解后有4个还原糖产物,通过与标准还原糖色谱图中各还原糖的保留时间比对,其中有3个还原糖分别是阿拉伯糖、果糖和葡萄糖,而Rt=8.2 min的还原糖尚未鉴定出是哪种糖。
2.4.3 竹屑水解前后红外光谱比较。
由图4可知,未水解的竹屑样品红外光谱图中,3 424 cm-1附近的吸收峰是—OH的伸缩振动吸收峰,是所有纤维素的特征谱带, 2 903 cm-1附近的吸收峰归属为C—H的伸缩振动峰,1 734 cm-1处的吸收峰是来自半纤维素中的乙酰基、酯醚键吸收峰,1 056 cm-1附近吸收峰归属为C—O伸缩振动峰或O—H的变形振动峰,993 cm-1附近的吸收峰是纤维中醚键的特征峰[17]。竹屑经酸碱水解后,3 424 cm-1吸收峰减小,2 903和1 734 cm-1处的吸收峰消失,说明纤维素和半纤维素全部或部分水解。在植物细胞壁中,半纤维素主要通过酯键同木素相连,因此这种破坏对于半纤维素和木素的溶出起到重要作用。993 cm-1处红外吸收峰的强弱变化与纤维中醚键所处晶格变化有一定关系,经酸碱处理后此处吸收峰减弱甚至消失,是由于纤维的纤维素晶格受到一定改变引起的。在所有处理中,经4.5%硫酸溶液处理后的竹屑在1 734 cm-1处吸收峰最弱,表明经4.5%硫酸溶液处理后的竹屑半纤维素结构遭到破坏,这种破坏对半纤维素转化为还原糖起到了重要的作用。
3 结论
(1)通過体外抑菌试验,研究了竹屑提取物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的抑菌效果,结果表明,竹屑的乙醇提取物对3种病原菌均有一定的抑菌作用,但提取温度和时间对抑菌效果有一定的影响,在50 ℃条件下提取2.5 h得到的竹屑提取物对3种菌的抑菌效果最好,且该条件下总黄酮得率最高,说明总黄酮可能是竹屑提取物中抑菌活性成分之一。
(2)金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌对竹屑提取物的敏感性不同,竹屑提取物对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌的最小抑菌浓度分别为0.062 5、0.031 3、0.125 0 g/mL。
(3)竹屑经硫酸溶液、氢氧化钠溶液、纤维素酶水解后均可产生还原糖,还原糖得率从高到低依次为4.5%硫酸溶液、竹屑经纤维素酶、40%硫酸溶液、20%氢氧化钠溶液和40%氢氧化钠溶液。色谱分析表明,竹屑水解的主要产物有阿拉伯糖、果糖和葡萄糖等。
参考文献
[1]侯新毅.我国竹子技术标准体系的构建研究[D].北京:中国林业科学研究院,2010.
[2]杨满国,肖辉,胡楠,等.竹制品废料加工利用研究进展[J].湖南林业科技,2012,39(2):66-68.
[3]杨彪,周刚,王倩倩,等.枯草芽孢杆菌在家禽生产中的应用[J].饲料博览,2014(4):31-34.
[4]张慧,林海萍,盛恩浩,等.箬竹提取物抑菌活性研究[J].浙江林业科技,2010,30(3):38-41.
[5]姚曦,岳永德,汤锋.竹秆提取物的抑菌及抗氧化活性[J].光谱实验室,2013,30(2):629-634.
[6]陈瑞,朱圣东,杨武,等.竹子化学成分的测定[J].武汉工程大学学报,2013,35(2):57-59,64.
[7]金强,张红漫,严立石,等. 生物质半纤维素稀酸水解反应[J].化学进展,2010,22(4):654-662.
[8]范家佑,郁建平,罗莉斯,等. 马尾松针叶提取物的抑菌活性研究[J].山地农业生物学报,2010,29(3):279-282.
[9]李丽,王捷,柳恩杰. 啶菌恶唑体外抑真菌研究[J].农药, 2004,43(9):409-411.
[10]邬建敏,贾之慎,唐云湖.竹类黄酮化合物总量及芦丁含量的测定[J].浙江农业大学学报,1998,24(4):425-428.
[11]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[12]李洪玉,孙静芸,章建民,等. HPLC 测定不同来源竹叶中荭草苷、异荭草苷和异牡荆苷的含量[J]. 中成药,2004,26(3):208-210.
[13]倪向梅,曹光群.竹叶提取物的体外抑菌及抗氧化活性的研究[J].天然产物研究与开发,2011,23(4):717-722.
[14]岳永德, 操海群,汤锋.竹提取物的化学成分及其利用研究进展[J].安徽农业大学学报,2007,34(3):328-333.
[15]刘璐, 付明哲, 王侠,等. 植物黄酮类化合物提取及测定方法研究进展[J].动物医学进展, 2011, 32(6):151-155.
[16]张勇.苜蓿总甙对肉仔鸡胴体品质、血脂及抗氧化性能的影响[D].郑州:河南农业大学,2003.
[17]王越平,高绪珊,邢声远,等.几种天然纤维素纤维的结构研究[J].棉纺织技术,2006,34(2):8-12.
[18]GARCASANCHO C,AGIRREZABALTELLERIA I,GEMEZ M B,et al. Dehydration of Dxylose to furfural using different supported niobia catalysts[J]. Applied catalysis B: Environmental, 2014,152/153:1-10.
[19]ZHANG Z H,ZHAO Z B.Microwaveassisted conversion of lignocellulosic biomass into furans in ionic liquid[J]. Bioresours technology,2010, 101(3):1111-1114.
[20]SHI X J,WU Y L,YI H F,et al.Selective preparation of furfural from xylose over sulfonic acid functionalized mesoporous Sba-15 materials[J]. Energies,2011,4:669-684.
[21]YOO C G.Pretreatment and fractionation of lignocellulosic biomass for production of biofuel and valueadded products[D].Ames:Iowa State University,2012.
[22] LIU X L,JIN H,LI Y S,et al.Metalorganic framework ZIF-8 nanocomposite membrane for effcient recovery of furfural via pervaporation and vapor permeation[J]. Journal of membrane science,2013,428:498-506.
[23]程秀蓮. 大孔吸附树脂对糠醛的吸附特性研究[J].沈阳理工大学学报,2012,29(5):77-81.
[24]CHERUBINI F.The biorefinery concept: Using biomass instead of oil for producing energy and chemicals[J].Energy conversion and management,2010,51(7):1412-1421.
[25]张盆,胡惠仁,石淑兰.半纤维素的应用[J].天津造纸,2006(2):16-18.
