深圳福田红树林弧边招潮蟹的行为习性观察研究
2019-09-24向洪勇李昆杨海军萨依拉姆姑丽阿布杜木萨张振兴
向洪勇, 李昆, 杨海军, , 萨依拉姆姑丽·阿布杜木萨, 张振兴, ,*
深圳福田红树林弧边招潮蟹的行为习性观察研究
向洪勇1, 2, 李昆3, 杨海军1, 3, 萨依拉姆姑丽·阿布杜木萨1, 张振兴1, 3,*
1. 植被生态科学教育部重点实验室, 东北师范大学, 长春 130024 2. Institute of Integrative Biology, University of Liverpool, Liverpool, L69 7ZB, United Kingdom 3. 国家环境保护湿地生态与植被恢复重点实验室, 东北师范大学, 长春 130024
弧边招潮蟹()是红树林的生态系统工程师, 然而我国对弧边招潮蟹的研究相对薄弱。为了研究弧边招潮蟹的行为习性, 作者于2013年7—9月在深圳福田红树林自然保护区, 借助望远镜观察了弧边招潮蟹的11种行为。结果表明: 弧边招潮蟹主要栖息于潮沟两侧的林缘生境, 和大多数招潮蟹一样, 弧边招潮蟹的大部分时间(69%)用于觅食(进食+边走边食), 其次是站立(11%), 用于求偶的时间最少(0.23%)。弧边招潮蟹的繁殖期有延长的现象, 观察到的交配时间比以往的研究要短。除记录的11种行为之外, 还观察到弧边招潮蟹的探洞、边走边食边挥舞大螯、“投降”等行为, 表明弧边招潮蟹的行为较复杂。弧边招潮蟹的短距离迁移能力较强, 单次迁移距离可达30 m以上。生境、性别、时间等因素对弧边招潮蟹的行为影响较大, 手性和潮汐的影响较小。污染较严重的生境中弧边招潮蟹用于觅食和洞穴行为的时间均显著减少, 导致其生物扰动作用减弱, 从而不利于红树林生态系统的健康。本文丰富了弧边招潮蟹的研究, 对全面、深入了解红树林生态系统, 及红树林的管理和保护有重要的参考价值。
招潮蟹; 行为; 红树林; 生态系统工程师
0 前言
招潮蟹()是滩涂甲壳动物中研究最多、最广泛的物种之一[1]。招潮蟹广泛分布于热带、亚热带、温带沿海的滩涂、潮沟等生境中。招潮蟹是红树林的生态工程师[2-4], 也可作为污染的指示生物[5], 其行为学特征受水质状况的影响较大[6, 7], 能反映当地的红树林健康状况和水质污染状况[6, 8-10]。我国大陆关于招潮蟹的研究较少, 集中在招潮蟹的生物学特性[11]; 招潮蟹重金属的测定及风险评估[12]; 氮磷对招潮蟹的毒性研究[13]。弧边招潮蟹()是东亚最常见的物种之一, 尤其在红树林泥滩生境中, 在中国(包括香港、台湾, 不含澳门)日本南部、韩国[14]以及越南和冲绳岛均有分布[15]。以往关于弧边招潮蟹行为学的研究仅集中在一种或少数几种行为上, 如领域行为[7]、求偶行为[16]、烟囱建造行为[17]和功能[18]; 观察的个体数量也仅为十几只到几十只[19, 20], 关于弧边招潮蟹多种行为的研究鲜见报道。因而, 有必要对弧边招潮蟹的行为学特征进行全面深入的研究。本研究于2013年7—9月研究了深圳福田红树林弧边招潮蟹的11种行为, 力求找出影响弧边招潮蟹行为的生物和非生物因子, 为更好的保护、指导红树林的生产实践提供科学依据。
1 材料与方法
1.1 实验地概况
深圳福田红树林保护区位于深圳湾东北岸(113°58′—114°05′ E, 22°30′—22°34′ N), 总面积367.64 hm2。年均气温22.4 ℃, 年均降雨量1700—1900 mm。潮汐属不规则半日潮, 但潮差不大。保护区内生境类型多样, 主要由红树林、光滩、基围鱼塘、芦苇鱼塘和陆地植被组成, 红树林呈带状分布, 面积103.03 hm2。
通过实地观察, 根据弧边招潮蟹的分布情况及取样的可实行性, 共选取三个样地: 2号鱼塘潮沟、3号鱼塘潮沟、凤塘河码头。三个样地的植物均以秋茄群落为主, 伴生有海桑、无瓣海桑、白骨壤和老鼠簕等物种。三个样地的生境各有不同: 2号鱼塘潮沟受到的人为干扰强度最大, 植被郁闭度和潮沟宽度居中; 3号鱼塘潮沟的宽度最小, 植被郁闭度最高, 但是相对于其它两个样地, 其受到的人为干扰最小; 凤塘河码头受到的人为干扰居中, 植被郁闭度最低, 潮沟宽度最大。
1.2 实验方法
1.2.1 水质
2013年9月进行了三次水质指标测量, 每个样地设三个取样点: 在2号鱼塘潮沟和凤塘河码头沿着栈道或码头的步行道分布, 在3号鱼塘潮沟考虑到取样的可实施性, 取样点则位于潮沟的左、中、右三个位置。测定指标包括总有机碳(TOC)、总氮(TN)、总无机氮(TIN)、磷酸盐、铜(Cu)、镉(Cd)、pH、盐度, 除了pH和盐度现场测定外, 其余指标均在取样保存后送至清华大学深圳研究生院测量。取样时间为涨潮时, 每次每个样点取样350 mL, 取样及分析方法均参照海水水质标准GB 3097—1997。
1.2.2 行为观察
招潮蟹行为学的研究通常借用望远镜观察[20]、录像[21, 22], 大部分研究直接用肉眼观察。实验目的的不同会影响所选择的行为类型、观察的时间和数量。综合以往的研究方法, 通过对实验地弧边招潮蟹行为的前期观察, 最终选用Weis 的方法[19], 即将招潮蟹的行为划分为进食、行走、边走边食、站立、清洁身体、进攻和防御、挥舞大螯、求偶、交配、呆在洞穴中、洞穴行为等11种行为(见表1)。于无雨的天气, 在潮水退去或者未淹没实验地之前借助望远镜观察, 每只招潮蟹观察5 min, 记录每只招潮蟹在每种行为上所花的时间, 并将每种行为的时间除以5 min得出时间比例。观察前记录该招潮蟹的性别和利手性(雄性)以及观察时间、地点、潮汐等因素, 每个样地内每种性别的弧边招潮蟹观察数量不少于12只。
1.2.3 统计分析
不同生境和时间条件下行为的分析用方差分析, 多重比较用LSD配对比较方法, 当方差不齐性时, 用Games-Howell比较分析方法。不同性别、潮汐和手性条件下行为的比较用检验, 数据分析用SPSS 17.0软件。
2 结果
2.1 水质
凤塘河码头的TOC、TN、TIN均高于其余两个样地, 而2号鱼塘潮沟的盐度则高于其余两个样地, 表明离河口越远, 污染程度越低、盐度越大。其中凤塘河码头的TN、TIN与2号鱼塘潮沟和3号鱼塘潮沟之间均有显著差异, 其余指标之间均没有显著差异(见表2)。
2.2 行为特征
本次实验共观察了673只次弧边招潮蟹的行为,在5 min的观察期内, 弧边招潮蟹用于不同行为的时间比例从高到低分别是: 进食(42.33%)、边走边食(26.89%)、站立(10.59%)、呆在洞穴中(6.61%)、行走(4.09%)、进攻和防御(2.93%)、洞穴行为(2.88%)、挥舞大螯(1.51%)、交配(0.98%)、清洁身体(0.95%)、求偶(0.23%)。不同地点、时间、性别、雌性、雄性的利手性对福田红树林弧边招潮蟹行为的影响各有差异, 其中生境、性别对弧边招潮蟹多种行为(如进食、挥舞大螯、进攻和防御等行为)有显著影响, 时间的影响次之, 潮汐和利手性对弧边招潮蟹行为的影响最弱。
2.2.1 不同生境中弧边招潮蟹的行为特征
生境对弧边招潮蟹的多种行为有显著影响(见表3)。2号鱼塘潮沟的弧边招潮蟹用于进食的时间比例(37.81%)显著低于凤塘河码头(47.10%)(= 0.002)。2号鱼塘潮沟、3号鱼塘潮沟和凤塘河码头样地中的招潮蟹用于边走边食的时间比例分别为35.6%、27.4%和18.0%, 三者之间均有显著差异。2号鱼塘潮沟的弧边招潮蟹用于站立的时间比例(6.79%)显著低于凤塘河码头(12.08%)(=0.010)和3号鱼塘潮沟(13.13%)(=0.010)。2号鱼塘潮沟的弧边招潮蟹用于进攻和防御的时间比例(1.38%)显著低于凤塘河码头(3.59%)(=0.020)和3号鱼塘潮沟(3.89%)(= 0.031)。凤塘河码头的弧边招潮蟹呆在洞穴中的时间比例(8.86%)显著高于2号鱼塘潮沟(4.97%)(=0.010)和3号鱼塘潮沟(5.21%)(=0.024)。2号鱼塘潮沟(5.04%)的弧边招潮蟹用于洞穴行为上的时间比例显著高于凤塘河码头(1.66%)(=0.026)。弧边招潮蟹用于其它行为的时间在不同生境之间没有显著差异。

表1 弧边招潮蟹的行为特征描述
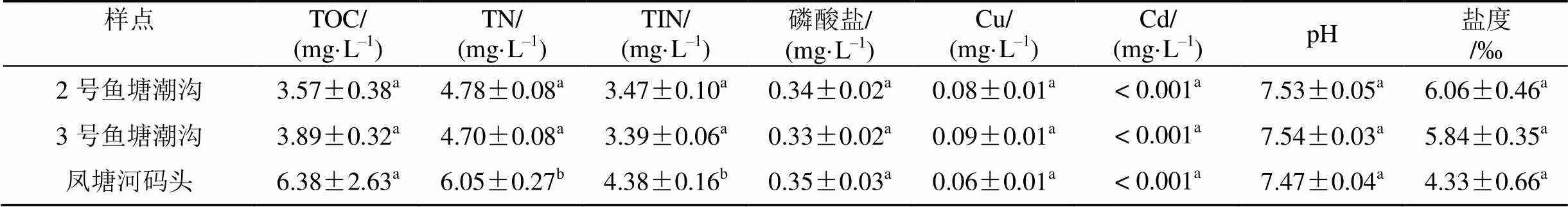
表2 不同生境的水质状况
2.2.2 不同月份下弧边招潮蟹的行为特征
月份对弧边招潮蟹的4种行为有显著影响(见表4)。弧边招潮蟹在7月用于进食的时间比例(45.03%)显著高于8月(37.26%)(=0.005); 7月用于进攻和防御的时间比例(3.72%)显著高于9月(1.11%)(=0.001); 8月呆在洞穴中的时间比例(9.70%)显著高于7月(4.99%)(=0.009); 9月用于洞穴行为的时间比例(6.87%)显著高于7月份(1.09%)(=0.002)。弧边招潮蟹用于其它行为的时间在不同月份之间没有显著差异。
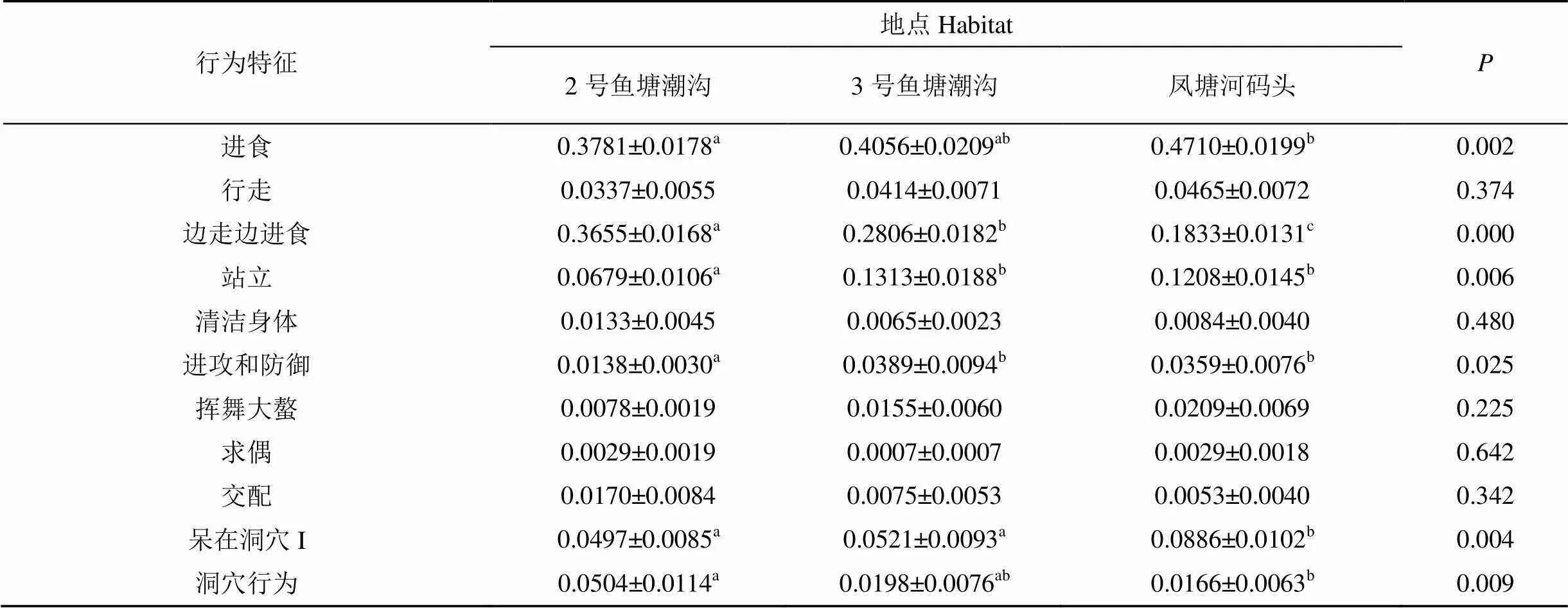
表3 不同生境中弧边招潮蟹对行为的时间分配
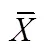

表4 不同月份下弧边招潮蟹对行为的时间分配
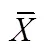
2.2.3 不同性别弧边招潮蟹的行为特征
雌性用于进食的时间比例(45.15%)显著高于雄性(40.35%)(=0.041); 雌性用于清洁身体的时间比例(0.37%)显著低于雄性(1.34%)(=0.014); 雌性用于进攻和防御的时间比例(0.83%)显著低于雄性(4.32%) (<0.001); 雄性在5 min的观察期内进行的行为种类数(3.47)显著高于雌性(3.20)(=0.009)。雌雄两性弧边招潮蟹用于其它行为的时间没有显著差异(见表5)。
2.2.4 不同潮汐下弧边招潮蟹的行为特征
潮汐仅对弧边招潮蟹呆在洞穴中这一行为有显著影响(见表6)。涨潮时弧边招潮蟹呆在洞穴中的时间(8.58%)显著高于退潮时(4.87%)(= 0.001); 涨潮时弧边招潮蟹在5 min的观察期内进行的行为种类数(3.55)显著高于退潮时(3.19) (0.001)。
2.2.5 不同手性弧边招潮蟹的行为特征
手性仅对弧边招潮蟹的行走行为有显著影响(=0.022)(见表7), 右利手雄性弧边招潮蟹用于行走的时间比例(5.29%)高于左利手雄性弧边招潮蟹(2.81%)。
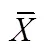
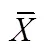

表7 不同手性下弧边招潮蟹对行为的时间分配
3 讨论
3.1 觅食行为
3.2 繁殖行为
招潮蟹可以建造除了洞穴以外的4种建筑物, 即泥球、烟囱、半穹和柱状物, 这些结构有吸引异性[28, 29]的功能。以往的研究发现, 日本、中国的香港和台湾的弧边招潮蟹(雌雄两性、幼蟹和成年蟹类)可以建造烟囱[1, 14, 17, 18], Bones发现香港米埔自然保护区的弧边招潮蟹, 最多的时候有11%的洞穴有烟囱[1]。实验期间没有发现弧边招潮蟹建造烟囱的行为, 烟囱的密度也很低, 仅在2号鱼塘潮沟和3号鱼塘潮沟见到了少数烟囱。凤塘河码头没有发现烟囱可能是因为该生境中植被稀少, 而在植被稀少的生境中很难发现烟囱[1]。
招潮蟹的求偶行为是招潮蟹研究较多的行为之一, Croll和McClintock证实了北美地区开阔地带的招潮蟹具有类似于鸟类的集体求偶行为[23]。Backwell等发现, 同一生境中的和因为雌性的优先选择效应而导致雄性进行同步的挥舞大螯动作[21]。本实验结果显示, 弧边招潮蟹用于求偶的时间比例仅为0.23%, 在11种行为中时间最少。除了观察到弧边招潮蟹像、等其它招潮蟹那样挥舞大螯展示自己的求偶方式外, 本实验还观察到雄性弧边招潮蟹在交配前以及交配过程中帮助雌蟹清除蟹壳表面的淤泥, 两只帮助雌蟹清洁身体的雄蟹最后都成功的与雌蟹进行了交配。作者认为该行为具有类似鸟类求偶时给雌性带去食物或者树枝等装饰物, 或者某些昆虫在求偶时给雌性带去的食物以增加求偶成功率的功能。
3.3 洞穴相关的行为
招潮蟹与洞穴相关的行为包括建造和修补洞穴的洞穴行为、为保卫洞穴而进行的进攻和防御行为、以及呆在洞穴中等行为。招潮蟹的洞穴行为不仅对其个体生活有重要意义, 还是一种重要的生物扰动作用。生境和时间对弧边招潮蟹的洞穴行为有显著影响: 污染程度较轻的生境中弧边招潮蟹用于洞穴行为的时间增加, 因为更多的洞穴行为能促进微生物和植物的生长, 从而直接或间接的增加了弧边招潮蟹的食物数量[30]; 9月份弧边招潮蟹用于洞穴行为的时间显著增加, 可能是因为温度的降低导致食物数量的减少, 增加洞穴活动能促进微生物的生长, 进而增加食物的数量[30]。
进攻和防御行为与性别有显著关系。雄性用于进攻和防御的时间高于雌性, 这是因为雄性有大螯, 因此为了争夺配偶权和保卫洞穴等, 需要比雌性投入更多的时间用于进攻和防御。
弧边招潮蟹在8月份呆在洞穴中的时间比例最高, 主要是由于8月份气温最高, 弧边招潮蟹进入洞穴既可以躲避高温也能补充水分[31]。不同样地中弧边招潮蟹呆在洞穴中时间的差异是由于: 凤塘河码头有大量捕食弧边招潮蟹的鸟类[24], 弧边招潮蟹为了躲避鸟类的捕食[32], 进入洞穴的时间必然增多[33]; 凤塘河码头生境相对单一, 视野开阔, 在遇到危险时招潮蟹只能躲进洞穴中, 因而增加了弧边招潮蟹呆在洞穴中的时间, 而其它两个生境中植被结构相对复杂, 遇到的危险少可供躲避的场所多; 凤塘河码头没有复杂的植被群落结构, 在炎热的夏季招潮蟹的活动场所只能暴露在阳光下, 因而弧边招潮蟹需要经常进入洞穴躲避高温环境并补充水分[34, 35]。
3.4 生境选择和其他行为
在中国深圳、中国香港[1]、中国台湾[18]、日本[17]等地, 弧边招潮蟹主要栖息于潮沟两侧的林缘生境中。和其他的招潮蟹一样[19], 弧边招潮蟹主要栖息于林缘的泥质/淤泥生境中。退潮后弧边招潮蟹从林缘到泥滩上觅食, 在离植被较远的光滩上很少见到弧边招潮蟹, 这一结果与以往的研究一致[1]。除了弧边招潮蟹, Nobbs发现,和也倾向于占领遮阴程度较高的生境, 因为在有植被的生境中, 招潮蟹的洞穴可以得到结构性的支撑, 植被对招潮蟹的形态和视觉系统也有影响[24]。黄建荣等在调查珠海淇澳岛红树林蟹类的生境时发现, 弧边招潮蟹只分布在秋茄和无瓣海桑的生境中[36], 而本实验的三个样地中均以秋茄群落为主, 但是在潮沟两侧的老鼠簕生境中也发现了弧边招潮蟹的定居。招潮蟹不在水中打洞, 但是可以涉过流水去觅食[1], 实验期间也观察到了弧边招潮蟹可以涉过流水去觅食, 但是只在2号鱼塘潮沟和3号鱼塘潮沟观察到了这一行为, 且多在低潮水流最小时发生。招潮蟹可以生活的盐度范围很广, 从淡水到高盐度的盐沼地中都有分布[1]。Miller和Maurer发现主要分布在21%—29 ‰的盐度范围内, 而则主要生活在0—12 ‰的盐度范围内[37]。本实验的结果显示, 三个样地的盐度在2‰—8‰之间(夏季雨水充足、河流水量大, 对海水的稀释作用强, 因而盐度低), 说明弧边招潮蟹可以在较低盐度下生存。
本研究旨在思考社会工作的职业自主性,由于笔者自身能力有限,以及笔者自身的主观诉求,资料收集主体比较单一,主要关注一线社工,并未涉及影响社工建立职业自主性的其他主体,比如社工的督导层、管理层等。本研究可能在解释力度和解释范围上具有一定局限性,今后需要更多的后续研究不断补充和修正。
根据招潮蟹是否占有洞穴可以将招潮蟹分为定居者和漫游者, Bones将蟹类定居者定义为从洞穴中出来, 或者在离洞穴50 cm的范围内活动, 保卫洞穴并不时的返回洞穴中[1]。漫游者是指没有洞穴, 要么是在步行、进食或者进行社交活动的蟹类, 或者是那种占领临时性洞穴, 但是在30 min内就离开的招潮蟹[16]。漫游者(以成年雄性为主)在觅食的过程中会进入路过的洞穴, 其中体型较大的雄性弧边招潮蟹探洞频率最高。作者曾经在一次行为观察期(5 min)内记录到一只雄性弧边招潮蟹在觅食过程中进入了遇到的所有洞穴(既包括招潮蟹的洞穴也包括相手蟹和弹涂鱼的洞穴, 其中仅有1个洞穴因为入口太小而无法进入)。由于弧边招潮蟹的探洞行为很普遍, 其发生的频率、持续的时间甚至都比求偶行为等行为还要高, 而且该行为对弧边招潮蟹的其它行为(如进攻和防御行为、修建半穹[38]和烟囱[18, 39, 40]等)有很大的影响。因而作者建议在今后弧边招潮蟹的行为观察中将探洞行为作为一种独立的行为列出来。
实验期间, 经常能观察到雌性弧边招潮蟹在受到雄蟹的进攻时, 会像人类投降一样举起两只小螯足, 然后迅速的离开, 当距离攻击的雄蟹一定距离(一般> 5—10 cm, 因为在该距离范围条件下, 招潮蟹通常不会对其它招潮蟹的出现做出反应[16])时才放下两只小螯足, 在雌蟹举起两只螯足后雄蟹便不再攻击雌蟹, 只是维持着挥舞大螯的动作直至雌蟹远离一定距离。Weis也曾在印尼记录到了雌性类似的行为, 然而并不是在受到雄性威胁时才发出这样的动作, 他们无法解释该做动作的意义[19]。由于该行为主要发生在弧边招潮蟹受到攻击或威胁时, 而在攻击或威胁解除后该行为便消失, 因而作者认为该行为属于一种自我保护行为, 向对方传递“认输”或者“屈服”的信息。
实验期间观察到不少雄性招潮蟹在行走的过程中一边进食一边挥舞大螯, 特别是在8月末到9月, 这一行为发生的频率更高。Choi在香港米埔也记录到了弧边招潮蟹的这一行为[26]。由于招潮蟹是以洞穴为活动中心的动物, 因而其活动范围很少超过1 m2[41]。然而某些招潮蟹(如雄性)可以进行较长距离的迁移[19], 体型较大的弧边招潮蟹也能行走5—20 m的距离[15]。本实验期间也观察到个别弧边招潮蟹一次可以行走较远的距离(在凤塘河码头观察到几次弧边招潮蟹行走了近20 m的距离, 在2号鱼塘潮沟甚至观察到一只雄性弧边招潮蟹行走了超过30 m的距离), 说明弧边招潮蟹的短距离迁移能力较强。
4 结论
弧边招潮蟹主要栖息于潮沟两侧的林缘生境中, 大部分时间用于觅食, 其次是静止不动, 用于求偶的时间最少。弧边招潮蟹的行为受生境、时间和性别的影响较显著, 潮汐和雄性的利手性对弧边招潮蟹的行为影响较小。生境对弧边招潮蟹的进食、边走边食、站立、进攻和防御、呆在洞穴中和洞穴行为有显著影响, 生境对弧边招潮蟹行为的影响主要是由于污染状态的差异导致的。时间对弧边招潮蟹行为的影响主要体现在进食、进攻和防御、呆在洞穴中和洞穴行为上, 时间对弧边招潮蟹行为的主要是由于温度变化和行为的季节性变化导致的。性别对进食、进攻和防御、清洁身体等行为有显著影响, 性别对弧边招潮蟹行为的影响主要是由于雄性有大螯, 且两性在不同行为上的能量投入差异导致的。雄性的利手性仅对行走行为有显著影响, 潮汐仅对呆在洞穴中的时间有显著影响。
福田红树林弧边招潮蟹的繁殖期有延长的现象, 弧边招潮蟹的探洞行为和边走边食边挥舞大螯行为有较高的发生频率、持续时间和重要的意义, 在今后的研究中应注意这两种行为。弧边招潮蟹的行为比以往的研究更复杂, 例如雌性在受到雄性的威胁时会表现出类似投降的行为、雄性在交配前会帮助雌性清理其身体表面的淤泥。在污染程度较高的生境中, 弧边招潮蟹的洞穴行为、进食行为等生物扰动作用减弱, 进而导致藻类和微生物的疯长, 最终不利于整个生态系统的健康。
由于实验条件和时间的限制, 没有对弧边招潮蟹的密度、生物量、个体形态学(蟹壳宽度、长度)、繁殖力、洞穴密度、底质粒径等进行研究, 因而无法准确的对福田红树林弧边招潮蟹的生态状况进行评价, 也无法全面的了解其对福田红树林生态系统的影响。因此, 今后应加强对弧边招潮蟹个体和种群生态学方面的研究, 增加对弧边招潮蟹与红树林生态系统之间关系的了解, 以促进红树林的管理和保护工作。
致谢 感谢深圳市水务局栾建国处长、李永祥主任提供的进入实验地通行证, 以及实验期间在生活上的照顾; 感谢深圳水务规划设计院的郭雁平总工在生活上的照顾; 感谢白珍建师兄在论文修改中提出的宝贵意见。
[1] Bones L. The behaviour and ecology of the hong kong fiddler crabs, with special reference toand[D]. Hong Kong: University of Hong Kong, 1983.
[2] Kristensen E. Mangrove crabs as ecosystem engineers; with emphasis on sediment processes[J]. Journal of Sea Research, 2008, 59(1/2): 30–43.
[3] Penha-Lopes G, Bartolini F, Limbu S, et al. Are fiddler crabs potentially useful ecosystem engineers in mangrove wastewater wetlands?[J]. Marine Pollution Bulletin, 2009, 58(11): 1694–1703.
[4] Costa T, Soares-Gomes A. Population dynamics and secondary production of(brachyura: Ocypodidae) in a tropical coastal lagoon, southeast brazil[J]. Journal of Crustacean Biology, 2011, 31(1): 66–74.
[5] Bartolini F, Penha-Lopes G, Limbu S, et al. Behavioural responses of the mangrove fiddler crabs (and) to urban sewage loadings: Results of a mesocosm approach[J]. Marine Pollution Bulletin, 2009, 58(12): 1860–1867.
[6] Culbertson J B, Valiela I, Peacock E E, et al. Long-term biological effects of petroleum residues on fiddler crabs in salt marshes[J]. Marine Pollution Bulletin, 2007, 54(7): 955–962.
[7] 叶春良. 弧边招潮蟹的洞口构造功能与领域行为观察[D]. 台湾: 辅仁大学, 1996.
[8] Cannicci S, Bartolini F, Dahdouh-Guebas F,et al. Effects of urban wastewater on crab and mollusc assemblages in equatorial and subtropical mangroves of East Africa[J]. Estuarine, Coastal and Shelf Science, 2009, 84(3): 305–317.
[9] Bartolini F, Cimò F, Fusi M, et al. The effect of sewage discharge on the ecosystem engineering activities of two East Africa fiddler crab species: Consequences for mangrove ecosystem functioning[J]. Marine Environmental Research, 2011, 71(1): 53–61.
[10] Delevati Colpo K, Negreiros-Fransozo M L. Comparison of the population structure of the fiddler crab(Herbst, 1804) from three subtropical mangrove forests[J]. Scientia Marina, 2004, 68(1): 139–146.
[11] 李明云. 普陀及宁波滩涂弧边招潮蟹生物学特性的研究[J]. 动物学杂志, 1996, 31(6): 32–35.
[12] 赵金秀, 胡恭任, 于瑞莲, 等. 河口湿地招潮蟹重金属 ICP-AES 法测定及风险评价[J]. 环境科学与技术, 2010, 33(12F): 535–539.
[13] 彭超, 胡威, 朱丹丹, 等. 氨氮对不同生长阶段的弧边招潮急性毒性研究[J]. 四川动物, 2013, 32(4): 568–572.
[14] Crane J. Fiddler crabs of the world: Ocypodidae: Genus Uca[M]. Princeton: Princeton University Press, 1975.
[15] Otani T, Yamaguchi T, Takahashi T. Population structure, growth and reproduction of the fiddler crab,(de Haan 1833)[J]. Crustacean research, 1997(26): 109– 124.
[16] Murai M. Courtship activity of wandering and burrow- holding male[J]. Ethology, 1992, 92(2): 124–134.
[17] Wada K, Murata I. Chimney building in the fiddler crab[J]. Journal of Crustacean Biology, 2000, 20(3): 505–509.
[18] 苏国强. 弧边招潮蟹烟囱功能之新假说[D]. 台湾: 私立东海大学, 2007.
[19] Weis J S, Weis P. Behavior of four species of fiddler crabs, genus, in southeast Sulawesi, Indonesia[J]. Hydrobiologia, 2004, 523(1/3): 47–58.
[20] Mokhlesi A, Kamrani E, Backwell P,et al. Study on the behaviour of two fiddler crabs,and(Decapoda: Ocypodidae), in bandar abbas, Iran[J]. Journal of the Marine Biological Association of the United Kingdom, 2011, 91(1): 245–249
[21] Backwell P, Jennions M, Wada K,et al. Synchronous waving in two species of fiddler crabs[J]. Acta Ethologica, 2006, 9(1): 22–25.
[22] Colby D R. Population dynamics, spatial dispersion and somatic growth of the sand fiddler crab[J]. Marine Ecology-Progress Series, 1984, 16: 269–279.
[23] Croll G A, McClintock J B. An evaluation of lekking behavior in the fiddler crabspp.[J]. Journal of Experimental Marine Biology and Ecology, 2000, 254(1): 109–121.
[24] Nobbs M. The behavioural ecology of fiddler crabs (genus:): That live in the mangrove forests of darwin harbour[D]. Northern Territory University, 1999.
[25] Caravello H E, Cameron G N. The effects of sexual selection on the foraging behaviour of the gulf coast fiddler crab[J]. Animal Behaviour, 1987, 35(6): 1864–1874.
[26] Choi KC. The ecology of fiddler crabs (Crustacea: Ocypodidae) at the mai po marshes nature reserve, Hong Kong[D]. Hong Kong: University of Hong Kong, 1991.
[27] Bergey L L, Weis J S. Aspects of population ecology in two populations of fiddler crabs,[J]. Marine Biology, 2008, 154(3): 435–442.
[28] Kim T W, Christy J H, Choe J C. Semidome building as sexual signaling in the fiddler crab(Brachyura: Ocypodidae)[J]. Journal of Crustacean Biology, 2004, 24(4): 673–679.
[29]Christy J H, Backwell P R, Goshima S, et al. Sexual selection for structure building by courting male fiddler crabs: An experimental study of behavioral mechanisms[J]. Behavioral Ecology, 2002, 13(3): 366–374.
[30] Genoni G P. Increased burrowing by fiddler crabs(Smith)(Decapoda: Ocypodidae) in response to low food supply[J]. Journal of Experimental Marine Biology and Ecology, 1991, 147(2): 267–285.
[31] Eshky A, Atkinson R, Taylor A. Physiological ecology of crabs from Saudi Arabian mangrove[J]. Marine Ecology Progress Series, 1995, 126(1): 83–95.
[32] Lim S S, Diong C. Burrow-morphologicalcharactersof the fiddler crab,(H. Milne Edwards, 1837) and ecological correlates in a lagoonalbeach on pulau hantu, Singapore[J]. Crustaceana, 2004, 76(9): 1055–1069.
[33] Reaney L T. Foraging and mating opportunities influence refuge use in the fiddler crab,[J]. Animal Behaviour, 2007, 73(4): 711–716.
[34] Atkinson R, Taylor A.Physiological ecology of burrowing decapods[M]//Fincham A A, Rainbow P S. Aspects of decapod crustacean biology. Clarendon Press: Oxford, 1988: 201–226.
[35] Qureshi N A, Saher N U. Burrow morphology of three species of fiddler crab () along the coast of Pakistan[J]. Belgian Journal of Zoology, 2012, 142(2): 114–126.
[36] 黄建荣, 刘启智, 赵一臣窦, 等. 珠海淇澳岛红树林蟹类区系[J]. 生态环境学报, 2011, 20(4): 730–736.
[37] Miller K G, Maurer D. Distribution of the fiddler crabs,and, in relation to salinity in delaware rivers[J]. Chesapeake Science, 1973, 14(3): 219–221.
[38] Christy J H, Backwell P R, Goshima S. The design and production of a sexual signal: Hoods and hood building by male fiddler crabs[J]. Behaviour, 2001, 138(9): 1065–1083.
[39] Gusmão-Junior J B L, Machado G B O, Costa T M. Burrows with chimneys of the fiddler crab: Construction, occurrence, and function[J]. Zoological Studies, 2012, 51(5): 598–605.
[40] Slatyer R A, Fok E S Y, Hocking R, et al. Why do fiddler crabs build chimneys?[J]. Biology Letters, 2008, 4(6): 616–618.
[41] Zeil J, Hemmi J M. The visual ecology of fiddler crabs[J]. Journal of Comparative Physiology A, 2006, 192(1): 1–25.
The observation study of behavior ofin Futian Mangrove Nature Reserve in Shenzhen
XIANG Hongyong1,2, LI Kun3, YANG Haijun1,3, SA Yilamuguli·Abudumusa1, ZHANG Zhenxing1, 3,*
1. Institute of Grassland Science, Key Laboratory of Vegetation Ecology Ministry of Education, Northeast Normal University, Changchun 130024, China 2. Institute of Integrative Biology, University of Liverpool, Liverpool, L69 7ZB, United Kingdom 3. State Environmental Protection Key Laboratory of Wetland Ecology and Vegetation Restoration, Northeast Normal University, Changchun 130024, China
The fiddler crab,(de Haan 1833), is known as the ecosystem engineer in mangrove ecosystems. In order to study the behavior of, we investigated 11 behaviors ofusing binoculars in Futian Mangrove Nature Reserve, Shenzhen from July to September in 2013. Our results indicated that:mainly inhabited at the edge of mangroves near the tidal creek. Similar to other fiddler crabs,spent most of their time on foraging (69%), followed by standing (11%), and spent the least time on sexual interaction (0.23%). There seemed to be an extended breeding season of. The observed mating time was shorter than previous studies. Apart from the 11 behaviors, we observed the burrow exploring behavior, feeding while walking and waving, surrendering behavior, indicating the behavior complexity of. The short distance migration ability ofwas strong, and a single migration distance could reach as far as 30 m. The habitat type, sexual, and month had strong effects on the behavior of, while the handedness and tidal had little effect. Fiddler crabs from heavy pollution habitats spent remarkable less time on foraging and burrowing behavior, leading to a weaken bioturbation effects, thus to the disadvantage of the health of mangrove ecosystem. This research helps us have a further and overall understanding of the mangrove ecosystem, and it is helpful in the management and restoration of mangroves.
Fiddler crab; Behavior; Mangrove; Ecosystem engineer
10.14108/j.cnki.1008-8873.2019.05.010
S157.2
A
1008-8873(2019)05-068-10
2014-04-30;
2018-10-10
国家水体污染控制与治理科技重大专项(2017ZX07101003); 国家自然科学基金(41501566, 41601576); 中央高校基本科研业务费专项资金资助(2412018JC002)
向洪勇(1988—), 男, 博士研究生, 主要从事底栖动物、河流生态学研究, E-mail: Hongyong.Xiang@liverpool.ac.uk
张振兴, E-mail: zhangzx725@nenu.edu.cn
向洪勇, 李昆, 杨海军, 等. 深圳福田红树林弧边招潮蟹的行为习性观察研究[J]. 生态科学, 2019, 38(5): 68-77.
XIANG Hongyong, YANG Haijun, LI Kun, et al. The observation study of behavior ofin Futian Mangrove Nature Reserve in Shenzhen[J]. Ecological Science, 2019, 38(5): 68-77.
