光裸方格星虫生物扰动对沉积物氮磷物质释放的影响
2019-09-24李俊伟胡瑞萍郭永坚陈素文朱长波颉晓勇张文文陈振国
李俊伟, 胡瑞萍, 郭永坚, 陈素文, 朱长波,*, 颉晓勇, 张文文, 陈振国
光裸方格星虫生物扰动对沉积物氮磷物质释放的影响
李俊伟1, 胡瑞萍2, 郭永坚1, 陈素文1, 朱长波1,*, 颉晓勇1, 张文文1, 陈振国3
1. 中国水产科学研究院南海水产研究所, 广东省渔业生态环境重点实验室, 农业农村部南海渔业资源开发利用重点实验室, 广州 510300 2. 广州市海威水产科技有限公司, 广州 510300 3. 湛江市碧海湾水产科技有限公司, 湛江 524000
通过测定养殖箱内(24 cm×17 cm×16 cm))的沉积物管道数量和水体氮磷指标, 研究方格星虫生物扰动对沉积物氮磷物质释放和表层物质迁移的影响。养殖箱底部铺设粗沙(3200 g, 有机质含量27.6 mg·g–1), 上层为细沙(2200 g, 有机质含量11.0 mg·g–1), 星虫密度分别为0条·箱–1(T0))、1条·箱–1(T1))、2条·箱–1(T2))和4条·箱–1(T4)), 各组均设4个重复, 实验时间为11 d。数据显示: 1)方格星虫组沉积物侧面和底部的管道数量增加, 并且表层细沙向下迁移, 方格星虫密度越大, 管道数量越多。实验期间水体悬浮颗粒物无明显变化(>0.05)), 且处理组之间亦无显著差异(>0.05)), 表明方格星虫扰动对表层沉积物的再悬浮作用无明显影响。2)实验前3天水体中的亚硝态氮、硝态氮、氨氮和总无机氮均无明显增加, 而在第4天亚硝态氮、硝态氮、总无机氮表现增加趋势, 并且星虫密度越大含量越高(<0.05))。实验期间, 各组活性磷含量呈现下降趋势, 并且T0组平均含量低于其他三组。结果表明, 底层有机质含量高于表层时, 方格星虫生物扰动可以促进底层含氮物质的释放, 并且密度越大促氮释放作用越明显; 方格星虫对沉积物含磷物质的释放影响较小, 可能与其含量较低和转化过程有关。
光裸方格星虫; 生物扰动; 沉积物; 营养盐释放
0 前言
底栖动物的生物扰动行为(筑穴、爬行、避敌; 摄食、排泄、分泌和呼吸等)会对沉积物初级结构产生影响, 进而影响滩涂沉积物的理化性质与生物特征[1-6]。底栖动物的生物扰动可以改变有机质或污染物在沉积物中的垂直分布和粒径分布[7], 其表层摄食和底部排泄行为也会加速表层有机质的迁移或封埋, 进而影响沉积物中氮磷物质释放和转化[8-9]。底栖动物对沉积物的搬运和混合作用也会加速间隙水与上覆水之间的营养物质迁移, 从而影响沉积物-水界面的营养盐通量[10]。海参、蟹类、多毛类等动物由于栖息、摄食习性不同, 其生物扰动对滩涂有机质迁移的影响具有显著区别, 多数海参底表摄食和排泄, 对有机物质水平迁移较明显; 蟹类和多毛类为筑穴类动物, 频繁活动加速有机物质向上或向下垂直迁移[8,11-13]。星虫类动物依靠吻部伸展和收缩无选择地摄食表层颗粒有机物质, 在洞穴内排泄积累, 表现出对有机物质较强的向下迁移作用[14]。
光裸方格星虫()又称方格星虫、沙虫, 是一种穴居底栖动物, 在滩涂中的筑穴深度可达50 cm[15-17]。方格星虫广泛分布于我国近海沿岸, 北至渤海湾、南至海南均有发现, 以广东、广西、福建和海南沿海资源较为丰富。方格星虫摄食表层沉积物中的营养物质, 并在洞穴深处排泄, 实现表层沉积物质向底层的搬运和封埋[18]。一般认为星虫类动物对表层沉积物及重金属具有明显的封埋和迁移效果, 在生态系统的地球化学过程中发挥着重要作用[19-20]。近年来, 随着方格星虫繁育技术的逐渐成熟, 每年在沿海滩涂投放上亿条的幼苗进行增养殖, 该生产活动对滩涂沉积物的影响较为明显。以往研究了方格星虫生物扰动对混养系统沉积物及间隙水中营养物质的影响, 表明方格星虫生物扰动在一定程度上可以促进沉积物表层的有机质向底层转移[14]。方格星虫对营养物质具有向下迁移和扰动释放的双重作用, 关于方格星虫的扰动释放能力的相关研究较少, 需要就其氮磷物质扰动释放的影响机理需要进一步研究。
本研究通过在室内设置不同密度的方格星虫生物扰动实验, 研究方格星虫生物扰动对于水体中氮、磷浓度变化的影响, 确定方格星虫的生物扰动对沉积物底层氮磷物质释放的效果, 为沿海滩涂科学增养殖方格星虫提供理论依据。
1 材料与方法
1.1 实验材料与实验设计
方格星虫对沉积物底层氮、磷物质的扰动实验在塑料养殖箱(24 cm×17 cm×16 cm)中进行, 实验时间共11 d。实验共四个密度处理组, 分别为0条·箱–1(T0组)、1条·箱–1(T1组)、2条·箱–1(T2组)和4条·箱–1(T4组), 分别设置4个重复, 且对养殖箱随机区组放置。养殖箱底层铺设3200 g(厚度5 cm)的河沙(干重), 其有机质含量为27.6 mg·g–1; 上层铺设2200 g(厚度3 cm)的细沙(过筛并混匀), 有机质含量为11.0 mg·g–1, 然后加入500目筛绢布过滤的海水3500 mL(深度15 cm), 待方格星虫钻入沙层后采集初始水样。实验用方格星虫采自湛江遂溪, 养殖箱内方格星虫的生物量分别为0 g·箱–1、7.80 g·箱–1、13.19 g·箱–1、21.38 g·箱–1(表1)。
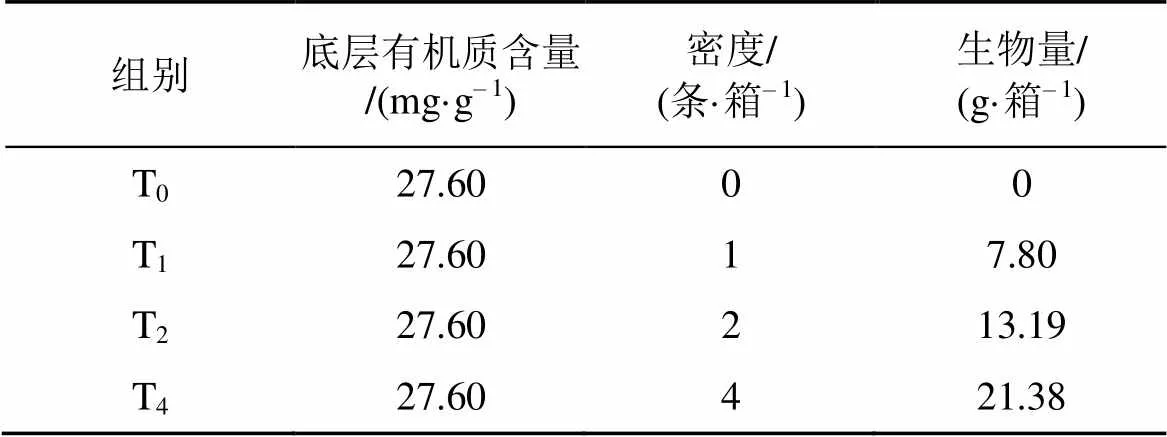
表1 方格星虫生物扰动对底层沉积物氮磷物质释放影响的实验设计
1.2 日常管理
采用充气石进行连续充氧, 溶解氧质量浓度高于6 mg ·L–1, 实验期间不换水。水体的温度、盐度、pH 以及溶解氧采用YSI(556, YSI Incorporated, Yellow Springs, USA)进行现场测定。
1.3 样品的收集及测定
第1—7天的采样间隔为24 h, 最后一次采样间隔为96 h。采用50 ml注射器取距离沙底2 cm处的水样。每次采集水样50 ml, 采用孔径为0.45 μm的滤膜过滤后加入氯仿冷冻保存, 用于测定氨氮(NH4+—N)、硝态氮(NO3-—N)、亚硝氮(NO2-—N)和活性磷(SRP)含量。NH4+—N采用靛酚蓝法测定, NO3—N采用锌镉还原法测定, NO2—N采用重氮—偶氮光度法测定, SRP采用磷钼蓝法测定[21]。在第1 d和第11 d分别采集中层水样50 ml, 过滤后测定水样中的悬浮颗粒物质含量。
1.4 数据分析
采用 SPSS 17.0进行数据统计和分析。不同处理组间的数据差异采用 One-way ANOVA 进行分析, 显著度为<0.05。
2 结果
2.1 方格星虫生物扰动对沉积物物理特征的影响
方格星虫生物扰动明显增加了沉积物侧面和底部的管道网络结构, 并且造成表层细沙物质的向下迁移(图1)。实验结束时, 养殖方格星虫的沉积物中管道数量明显增加, T4组沉积物侧面的垂直管道平均数量为24个, 显著高于T2(9个)与T1组(3个)(<0.05)。

图1 实验期间沉积物的物理结构变化
Figure 1 Physical structural change of the sediment during the experiment
2.2 方格星虫生物扰动对沉积物再悬浮的影响
实验结束时, 四个处理组水体中的悬浮颗粒物质含量与初期含量相近, 均无显著差异(>0.05), 并且四个处理组之间的悬浮颗粒物质含量亦无显著差异(>0.05), 表明方格星虫生物扰动对于表层颗粒物质的再悬浮作用影响较小。
2.3 方格星虫生物扰动对底层沉积物氮、磷释放的影响
实验期间第1—2 d, 各处理组水体中的亚硝态氮含量均无明显增加, 第3—6 d T1、T2和T4组水体的亚硝态氮含量均表现出增加的趋势, 并且随着方格星虫密度增加亚硝态氮含量显著增加(<0.05); T0组水体中的亚硝态氮含量变化趋势较小, 其含量变化范围为0.014—0.042 mg·L–1, 平均值为0.03 mg·L–1, 显著低于其它三组(0.11 mg·L–1、0.22 mg·L–1和0.37 mg·L–1) (<0.05)。
实验期间第1—3d, 各处理组水体中的硝态氮含量均无明显增加, 第4—11d, T1、T2和T4组水体中的硝态氮含量表现出明显的增加趋势, 而T0组水体中的硝态氮含量变化范围为0.014—0.039 mg·L–1, 平均值为0.089 mg·L–1, 低于其它三组(0.34 mg·L–1、0.76 mg·L–1和1.62 mg·L–1)(<0.05)。在第4—11 d, T4组硝态氮含量显著高于T0、T1组(<0.05), 且在第4、5、11 d显著高于T2组(<0.05)。在第6、7、11 d时T2组显著高于T0组, 在第7 d时显著高于T1组(<0.05)。仅在第6 d时T1组显著高于T0组(<0.05), 其它采样时间硝态氮含量相近。
实验期间, 各处理组的氨氮含量变化范围较大, 无明显的升高趋势, 但在大部分采样阶段高密度处理组水体中的氨氮含量高于低密度组和对照组, 未达到显著差异水平(>0.05), 只有T4组在第4 d显著高于T0组(<0.05)。实验期间, T0、T1、T2和T4组中的氨氮含量分别为0.48mg·L–1、0.59mg·L–1、0.58mg ·L–1和0.73mg·L–1。溶解态无机氮(DIN)含量的变化趋势和亚硝态氮、硝态氮含量变化趋势相近, 高密度组养殖水体中溶解态无机氮的含量均高于低密度组, 且在第4—11 d不同处理组之间出现了显著差异(<0.05)。在第3—11 d, T4组均显著高于T0组(<0.05); 在第3、5—11 d, T2组显著高于T0组(<0.05), 而T1组仅在第6、11 d显著高于T0组(<0.05) (图3)。
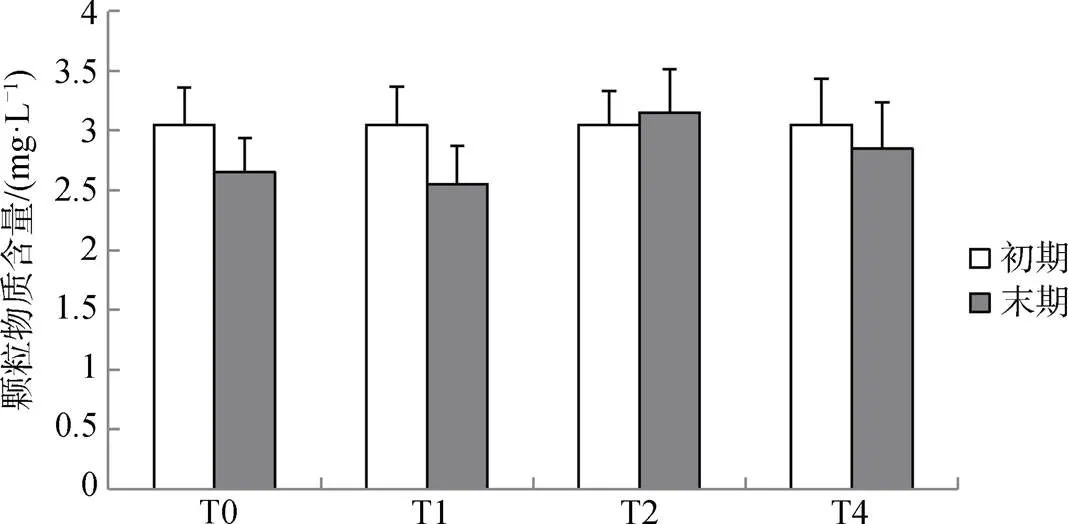
图2 实验期间水体内悬浮颗粒物质含量的影响
Figure 2 The particulate matter content in the water at the beginning and end of the experiment
实验期间, 各处理组水体中活性磷含量具有相近的变化趋势, T0组活性磷平均含量(0.035 mg·L–1)低于其它三组(0.048 mg·L–1、0.037 mg·L–1和0.046mg·L–1) (图4)。实验结果表明, 方格星虫生物扰动可以促进底层沉积物含氮物质的释放, 并且方格星虫的养殖密度越大, 底层含氮物质的释放越明显。实验期间, 养殖箱内未投入有机质, 因此方格星虫的排泄、代谢等作用对水体中含氮物质量的影响较小,可知方格星虫的钻穴与扰动在含氮物质释放过程中发挥较大作用。实验期间, 方格星虫对沉积物中含磷物质的释放影响较小, 可能与活性磷物质的转化和含量较低有关。
3 讨论
底栖动物的扰动作用会对沉积物氮、磷的释放造成显著影响[22-25]。星虫类和颤蚓等动物通过其管道网络结构及扰动作用加速了沉积物间隙水与上覆水之间的物质流动[26]。本研究表明方格星虫生物扰动可以增加沉积物管道网络结构(图1), 并且可以提高沉积物含水率, 这与其它生物扰动实验的结果相近[25-28]。通过实验结束与初始时养殖水体内颗粒物质含量的比较, 方格星虫生物扰动对于表层沉积物的再悬浮作用不明显, 这一结果与颤蚓、沙蚕生物扰动促进沉积物再悬浮的特征有所不同[25,29-31], 这可能与方格星虫特殊的摄食方式和较弱的扰动程度有关系。方格星虫摄食过程中通过伸缩吻部结构以摄取沉积物表层有机质, 无需将吻部伸出表面, 在沉积物表面形成明显的花穴或漏斗穴[32], 因此, 方格星虫生物扰动的程度较低是未造成表层颗粒物质再悬浮的主要原因。可以推测, 方格星虫滩涂增养殖对于表层沉积物的颗粒再悬浮影响较小。

图3 实验水体中亚硝态氮、硝态氮、总氨氮、溶解态无机氮含量变化
Figure 3 NH4+—N, NO3—N, NO2—N, DIN content in the water column during the experiment
Mermillod-Blondin 等[23]研究表明, 颤蚓生物扰动对沉积物的氮释放表现出促进作用, 这与颤蚓的迁移钻行和在泥水界面的颤动有直接关系。颤蚓的生物密度越大, 沉积物中的总氮释放越明显[25]。本实验方格星虫对沉积物的氮释放影响也表现出促进作用。实验期间, 养殖水体中的亚硝态氮、硝态氮和总无机氮含量均随着方格星虫密度增加而显著增加(<0.05), 并且低密度组与高密度组之间也具有显著差异(<0.05)(图3)。在实验中, 方格星虫的扰动作用表现为水体“氮源”的动力, 且生物密度越大, 对底层沉积物的扰动释放作用越明显。实验水体中总无机氮的增加情况表明方格星虫的密度越大, 其个体扰动强度会有所增加, 高密度组沉积物侧面的垂直管道数量显著高于低密度组也证实了方格星虫生物扰动或筑穴行为会随着密度增加而增强, 水体中无机氮增加的主要原因是管道增加了沉积物氮磷物质与外界水的交换面积。北部湾适养方格星虫的滩涂面积约20万亩, 方格星虫扰动造成的无机氮、磷释放会成为该海区氮磷循环的重要组成。本研究主要量化了底层沉积物有机质含量明显高于表层, 且表层有机质含量较低情况下方格星虫对底层无机氮磷的释放作用。在方格星虫滩涂增养殖区, 表层沉积物的有机质含量较高, 因此方格星虫对于滩涂表层有机质的向下迁移和底层氮磷释放的综合作用仍需深入研究。
图 4 实验水体中活性磷含量变化
Figure 4 SRP content in the water column during the experiment
以往研究表明, 颤蚓扰动可以显著影响间隙水中的磷浓度, 造成活性磷含量增加[23], 其扰动行为又会加快底层磷迁移到表层并释放到水体中[24,33], 也有研究表明刺参生物扰动会促进有机磷的降解和矿化, 有助于部分磷向铁/铝结合态磷(NaOH-P)转变, 可以增强沉积物对磷的吸附能力, 减少水体富营养化的风险[5]。本研究发现方格星虫扰动对于沉积物中磷释放无明显促进作用, 而且各处理组活性磷含量在实验后期表现出降低趋势。本研究在室内开展扰动试验, 仍具有一定光照强度, 未进行完全黑暗试验可能是少量硅藻生长造成磷降低的因素之一。方格星虫生物扰动对沉积物中磷等其它元素的形态转化影响仍需进一步研究。
4 结论
方格星虫生物扰动对沉积物的管道网络结构影响显著, 明显增加沉积物管道数量, 在底层有机质含量高于表层时, 其扰动作用表现为水体“氮源”的动力。方格星虫密度越大, 对底层沉积物氮的扰动释放作用越明显。实验水体中总无机氮的增加情况表明密度越大, 方格星虫的个体扰动强度会有所增加, 可能是由于食物或空间等竞争而导致摄食频率和强度增加。
[1] 于子山, 王诗红, 张志南, 等. 紫彩血蛤的生物扰动对沉积物颗粒垂直分布的影响[J].青岛海洋大学学报, 1999, 29(2): 279–282.
[2] KRISTENSEN E. Impact of polychaetes (spp. andmarina)on carbon biogeochemistry in coastal marine sediments[J]. Geochemical Transactions, 2001, 2(1): 1–12.
[3] 杜永芬, 张志南. 菲律宾蛤仔的生物扰动对沉积物颗粒垂直分布的影响[J].中国海洋大学学报, 2004, 34(6): 988–992.
[4] 宋进喜, 任朝亮, 李梦洁, 等. 河流潜流带颤蚓生物扰动对沉积物渗透性的影响研究[J]. 环境科学学报, 2014, 34 (8): 2062–2069.
[5] 侯诒然, 高勤峰, 董双林, 等. 不同规格刺参的生物扰动作用对沉积物中磷赋存形态及吸附特性的影响[J]. 中国海洋大学学报, 2017, 47 (9): 36–45.
[6] 张雷, 古小治, 邵世光, 等. 河蚬扰动对湖泊沉积物性质及磷迁移的影响[J].环境科学, 2011, 32(1): 88–95.
[7] 孙思志, 郑忠明. 大型底栖动物的生物干扰对沉积环境影响的研究进展. 浙江农业学报, 2010, 22 (2): 263–268.
[8] FANJUL E, ESCAPA M, MONTEMAYOR D, et al. Effect of crab bioturbation on organic matter processing in South West Atlantic intertidal sediments[J]. Journal of Sea Research, 2015, 95: 206–216.
[9] HULTH S, ALLER R C, CANFIELD D E, et al. Nitrogen removal in marine environments: Recent findings and future research challenges[J]. Marine Chemistry, 2005, 94(1–4):125–145.
[10] WIDDOW J, BRINSLEY M D, BOWLEY N, et al. A benthic annular flume for in situ measurement of suspension feeding/biodeposition rates and erosion potential of intertidal cohesive sediments[J]. Estuarine Coastal & Shelf Science, 1998, 46(1): 27–28.
[11] AHIGREN M O. Consumption and assimilation of salmon net pen fouling debris by the red sea cucumber: implications for polyculture[J]. Journal of the World Aquaculture Society, 1998, 29(2): 133–139.
[12] PALMER P J. Polychaete–assisted sand filters[J]. Aquaculture, 2010, 306(1): 369–377.
[13] LUPPI T, BAS C, CASARIEGO A M, et al. The influence of habitat, season and tidal regime in the activity of the intertidal crab[J]. Helgoland Marine Research, 2013, 67(1): 1–15.
[14] 李俊伟, 朱长波, 郭永坚, 等. 光裸方格星虫生物扰动对混养系统沉积物及间隙水中营养物质的影响[J]. 渔业科学进展, 2015, 36(1): 103–110.
[15] 李凤鲁, 周红. 中国沿海星虫动物门名录[J]. 青岛海洋大学学报, 1992, 22(2): 72–88.
[16] 张琴, 许明珠, 童潼, 等. 饲料糖脂比对方格星虫稚虫生长、体成分和消化酶活性的影响[J]. 动物营养学报, 2014, 26(1): 153–160.
[17] 李俊伟, 朱长波, 颉晓勇, 等. 方格星虫的繁育、养殖及研究开发进展[J]. 南方水产科学, 2014, 10 (5): 94–98.
[18] 孙刚, 房岩. 底栖动物的生物扰动效应[M]. 科学出版社, 2013: 80–98.
[19] SHIELDS M A, KEDRA M A. Deep burrowing sipunculan of ecological and geochemical importance[J].Deep Sea Research Part I Oceanographic Research Papers, 2009, 56 (11): 2057–2064.
[20] WANG Fei, WANG Weixiong, HUANG Xiaoping. Spatial distribution of gut juice extractable Cu, Pb and Zn in sediments from the Pearl River Estuary, Southern China[J]. Marine Environmental Research, 2012, 77(6): 112–119.
[21] 雷衍之. 养殖水环境化学实验[M]. 北京: 中国农业出版社, 2006: 80–85.
[22] 余婕, 刘敏, 侯立君, 等. 底栖穴居动物对潮滩N迁移转化的影响[J].海洋环境科学, 2004, 23(2): 1–4.
[23] MERMILLOD B F, NOGARO G, VALLIER F, et al. Laboratory study highlights the key influence of stormwater sediment thickness and bioturbation by tubificid worms on dynamics of nutrients and pollutants in stormwater retention systems[J]. Chemosphere, 2008, 72(2): 213–223.
[24] 聂小保, 吴淑娟, 吴方同, 等. 颤蚓生物扰动对沉积物氮释放的影响[J].环境科学学报, 2011, 31(1): 107–113.
[25] 郑余琦, 郑忠明, 秦文娟. 缢蛏生物扰动对养殖废水处理系统中沉积物磷赋存形态垂直分布的影响. 海洋与湖沼, 2017, 48 (1): 161–170.
[26] ALLER R C. Transport and reactions in the bioirrigated zone[M]// BOUDREAU B P, JORGENSEN B B (Eds.), The Benthic Boundary Layer. Oxford University Press, Oxford, 2001, 269–301.
[27] KRISTENSEN E, LIEBEZEIT G, DITTMANN S, et al. Organic matter diagenesis at the oxic/anoxic interface in coastal marine sediments,with emphasis on the role of burrowing animals[J]. Hydrobiologia, 2000, 426(1): 1–24.
[28] LI Junwei, ZHU Changbo, GUO Yongjian, et al. Experimental study of bioturbation byin a polyculture system[J]. Aquaculture, 2015, 437(9): 175– 181.
[29] 高丽. 生物扰动对黄河口潮滩沉积物侵蚀性的试验研究[D].青岛: 中国海洋大学, 2008:28–52.
[30] 李俐俐, 武安泉, 覃雪波. 沙蚕生物扰动对河口沉积物中菲释放的影响[J].环境科学学报, 2014, 34(9): 2355– 2361.
[31] 覃雪波, 孙红文, 彭士涛, 等. 生物扰动对沉积物中污染物环境行为的影响研究进展[J].生态学报, 2014, 34(1): 59–69.
[32] LI Junwei, XIE Xiaoyong, ZHU Changbo, et al. Edible Peanut Worm in the Beibu Gulf: Resource,aquaculture, Ecological Impact and Counterplan[J]. Journal of ocean university of China, 2017, 16(5): 823–830.
[33] 吕敬, 郑忠明, 陆开宏, 等. 铜锈环棱螺生物扰动对“蓝藻水华”水体底泥及其间隙水中碳、氮、磷含量的影响. 生态科学, 2010, 29 (6): 538–542.
Effects of the bioturbation activity ofon nitrogen and phosphorus release from sediments
LI Junwei1, HU Ruiping2, GUO Yongjian1, CHEN Suwen1, ZHU Changbo1*, XIE Xiaoyong1, ZHANG Wenwen1, CHEN Zhenguo3
1. Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture of China, Guangdong Provincial key Laboratory of Fishery Ecological Environment, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China 2. Guangzhou Haiwei Aquatic Science and Technology Co., Ltd, Guangzhou 510300, China 3. Bihaiwan Aquatic Science and Technology Co., LTD, Zhanjiang, Guangdong 524000, China
The effects of bioturbation ofon the release of nitrogen and phosphorus from sediments and the migration of surface material were studied by measuring the sediment structure and the nitrogen and phosphorus contents of the water in the breeding tanks (24 cm×17 cm×16 cm). The bottom layer was composed of coarse sand (3200 g, organic matter 27.6 mg·g-1), and the top layer was composed of fine sand (2200 g, organic matter 11.0 mg·g-1).The densities ofwere 0 (T0), 1 (T1), 2 (T2), 4 (T4) individuals per tank with 4 replicates in each group, and the experiment lasted for 11 days. The data showed that: 1) The number of pipelines on the sides and bottom of the sediments ofgroup increased, and fine sand on the surface migrated downwards. With the increment of the density of, the number of pipelines increased. During the experiment, there was no significant change in the suspended particulates (>0.05), and there was no significant difference between the groups (>0.05), indicating that the bioturbation ofhad no significant effect on the suspension of surface sediments. 2) No significant increase in nitrite nitrogen, nitrate nitrogen, ammonia nitrogen, and total inorganic nitrogen was found in the first three days of the experiment. However, the nitrogen showed a certain increasing trend on the fourth day of the experiment. And the higher density of group ofhad higher nitrogen contents (<0.05). During the experiment, the content of active phosphorus in each group had a decreasing trend, and the average content in the T0group was lower than the other three groups. The results showed that the bioturbation ofcould promote the release of nitrogen from the bottom layer, and the effect of nitrogen releasing increased with density of. The release of phosphorus in sediment was less affected by, which might be related to the low content of phosphorus and slow transformation process.
; Bioturbation; Sediment; Nutrient release
10.14108/j.cnki.1008-8873.2019.05.002
S96
A
1008-8873(2019)05-008-07
2018-10-30;
2018-11-15
海南省自然科学基金(318MS117); 国家自然科学基金(41606137); 中国水产科学研究院中央级公益性科研院所基本科研业务费项目(2019ZY13); 广东省渔业生态环境重点实验室开放基金(LFE-2016-9); 湛江市科技计划项目(2018A03004)
李俊伟(1982—), 男, 助理研究员, 博士, 从事养殖生态学研究, E-mail: lijunwei303@163.com
朱长波(1978—), 男, 副研究员, 养殖容量学研究, E-mail: changbo@scsfri.ac.cn
李俊伟, 胡瑞萍, 郭永坚, 等. 光裸方格星虫生物扰动对沉积物氮磷物质释放的影响[J]. 生态科学, 2019, 38(5): 8-14.
LI Junwei, HU Ruiping, GUO Yongjian, et al. Effects of the bioturbation activity ofon nitrogen and phosphorus release from sediments[J]. Ecological Science, 2019, 38(5): 8-14.
