大豆Kunitz胰蛋白酶抑制因子单克隆抗体的制备与鉴定
2019-09-24李燕虹曹金博孙亚宁邢云瑞陈秀金邓瑞广胡骁飞
王 耀 李燕虹 曹金博 孙亚宁 邢云瑞 陈秀金 邓瑞广 胡骁飞
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省农业科学院动物免疫学重点实验室,河南 郑州 450002)
大豆含有丰富的蛋白质和油脂资源,是重要的食品和饲料加工原料,但其也含有多种抗营养因子和致敏蛋白[1],这些物质可能诱发过敏反应,降低大豆营养价值,影响大豆利用效率[2]。大豆胰蛋白酶抑制因子(Soybean trypisin inhibitor,STI)是其中重要的一种,主要包括Kunitz胰蛋白酶抑制因子(Kunitz trypsin inhibitor,KTI)和Bowman-Birk胰蛋白酶抑制因子(Bowman-Birk trypsin inhibitor,BBI)两种类型,分别约占大豆蛋白总量的1.4%,0.6%[3]。STI虽已被证明具有抗癌和抗炎生物活性[4],在医药领域具有潜在应用价值[5],但其也可抑制机体胰蛋白酶和胰凝乳蛋白酶活性,导致消化不良,阻碍生长发育[6]。因此建立特异、高效的检测方法来监测大豆及其制品中STI的含量显得尤为重要。
目前,胰蛋白酶抑制因子多采用脲酶检测法、酶化学分析法进行检测,但是这些检测方法的灵敏度、特异性和稳定性较差[7]。近年来,利用特异性抗体建立起来的酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)能够准确、灵敏地检测STI含量,已成为STI快速检测方法研究的主要趋势[8]。张国龙等[9]利用兔源多克隆抗体建立了可用于大豆和大豆产品中KTI定量检测的直接竞争ELISA方法;邢春芳等[10]也利用兔源多克隆抗体建立了STI的间接竞争ELISA检测方法,能够代替酶化学分析法用于豆粕及豆制品中胰蛋白酶抑制因子的检测。而单克隆抗体(Monoclonal antibody,mAb)相对于多克隆抗体具有均一性和特异性强等优势,更有利于建立灵敏、特异的ELISA方法。目前已有相关研究[11-12]利用mAb建立了用于KTI定量分析的ELISA检测方法,但缺乏对抗体免疫学特性的鉴定与描述。试验拟通过动物免疫和细胞融合,筛选稳定分泌KTI mAb的杂交瘤细胞株,并对所制备抗体的效价、亚型、敏感性、亲和力、特异性等免疫学特性进行鉴定,旨在为建立KTI的ELISA检测方法及其他免疫学检测方法提供可靠的抗体保障,为大豆及其制品中KTI的高效监测提供有力的技术支撑。
1 材料与方法
1.1 试剂溶液
弗氏佐剂(Freund’s complete/incomplete adjuvant,FCA/FIA),KTI、BBI、大豆凝集素(Soybean agglutinin,SBA)、大豆球蛋白(Glycinin)、β-伴大豆球蛋白(β-conglycinin)等标准品,鼠源mAb分型试剂:美国Sigma-Aldrich公司;
胎牛血清、选择性培养基(HAT、HT)、不完全培养基(RPMI-1640)等细胞培养试剂,SDS-PAGE蛋白Marker,酶标羊抗鼠IgG抗体(GaMIgG-HRP),NC膜等试验材料:索莱宝生物科技公司;
ELISA所用包被液(0.05 mol/L碳酸盐缓冲液,CBS)、稀释液(0.01 mol/L磷酸盐缓冲液,PBS)、封闭液(含5%脱脂奶的PBST溶液)、显色液(TMB磷酸—柠檬酸缓冲液)、终止液包被液(2 mol/L H2SO4溶液)等溶液:实验室配置;
其他试剂均为市售分析级试剂。
1.2 主要仪器
电子天平:ME204E型,德国Mettler Toledo公司;
CO2培养箱:INCO153型,德国Memmert公司;
倒置生物显微镜:DMI3000型,德国Leica公司;
生物洁净工作台:BCM-1000A型,苏净安泰有限公司;
酶标仪:iMark450/550型,美国Bio-Rad公司;
蛋白凝胶电泳系统:Mini-PROTEAN型,美国Bio-Rad公司;
转膜系统:Trans-Blot型,美国Bio-Rad公司。
1.3 试验动物及骨髓瘤细胞
免疫动物为6~8周龄无特定病原体(SPF)级雌性BALB/c小鼠,液体石蜡预处理的SPF级BALB/c小鼠用于腹水制备。骨髓瘤细胞为小鼠NS0骨髓瘤细胞。
1.4 小鼠免疫及多抗血清鉴定
首次免疫,将KTI与等量FCA混合,取3只小鼠以50 μg/(200 μL·只)的剂量背部皮下多点注射。此后每隔3周加强免疫1次,免疫剂量和方式与首次免疫相同。共进行4次免疫,免疫结束3周后,对小鼠断尾采血,获得多抗血清。
多抗血清效价采用间接ELISA进行测定[13],首先在已包被抗原的酶标板中加入倍比稀释的抗体,37 ℃孵育15 min,洗板后加入GaMIgG-HRP,37 ℃孵育30 min,洗板后加入显色液,10 min后终止显色并读取OD450 nm值,以测定OD450 nm的P/N值≥2.1判定多抗血清效价(P为阳性孔OD450 nm值,N为阴性孔OD450 nm值)。
多抗血清敏感性采用间接竞争ELISA进行鉴定[13],首先向酶标板中加入效价测定中OD450 nm值为1.0左右的血清稀释液和具有梯度抗原标准溶液(作为酶标板上已包被抗原的竞争物),余下步骤按上述效价测定步骤进行。待酶标仪读取OD450 nm值之后,求出抑制率B/B0,其中B0为抗原浓度为0时的OD450 nm值,B为抗原不同标准浓度所对应的OD450 nm值。然后将抗原浓度对数值和抑制率分别作为横、纵坐标绘制抑制曲线,根据曲线线性回归方程计算半数抑制浓度IC50衡量多抗血清敏感性。
1.5 细胞融合与筛选
复苏NS0瘤细胞,选取生长状态良好的瘤细胞进行扩大培养准备融合。取多抗血清效价高、敏感性好的小鼠进行腹腔注射超免,剂量仍为50 μg/(200 μL·只),但不加佐剂,超免3 d后,取小鼠脾脏分离脾细胞与NS0细胞进行融合[14]34,将细胞悬液铺于细胞培养板并进行培养,7 d后用HT培养基半量换液,并密切观察细胞生长情况,10 d左右抽取细胞培养上清液,同样采用间接ELISA和间接竞争ELISA进行筛选,挑选效价高、敏感性好、生长旺盛的细胞采用有限稀释法进行亚克隆[15],反复筛选直至建立稳定分泌KTI mAb的阳性杂交瘤细胞株。
1.6 KTI mAb的大量制备及免疫学特性鉴定
扩大培养已筛选的阳性杂交瘤细胞,将杂交瘤细胞(约106个)腹腔注射经液体石蜡预处理的BLAB/c小鼠。待小鼠腹部明显肿胀时便可用无菌注射器采集腹水,将腹水以5 000 r/min离心10 min,取上清液采用饱和硫酸铵盐析法纯化[14]22,并用PBS透析3 d得到KTI mAb。
抗体免疫学特性鉴定包括效价、亚型、亲和常数、敏感性和特异性5个方面。效价和敏感性鉴定方法同1.3中多抗血清效价测定和敏感性的鉴定。
亚型通过鼠源mAb分型试剂进行鉴定,利用间接ELISA原理将mAb稀释包被酶标板,然后加入IgA、IgG1、IgG2a、IgG2b、IgG3、IgM分型试剂,最终根据OD450 nm值判断mAb亚型。
亲和常数(Affinity constant,Ka)根据饱和ELISA法[16],在不同浓度抗原包被情况下,测定抗体半饱和浓度,按式(1)计算。
Ka=(n-1)/2(n[Ab’]t-[Ab]t),
(1)
式中:
Ka——亲和常数,L/mol;
n——不同包被浓度的比值;
[Ab]t、[Ab’]t——不同包被浓度下抗体半饱和浓度,mol/L。
特异性通过测定交叉反应率和免疫印迹试验进行鉴定,交叉反应率通过间接竞争ELISA测定大豆中其他抗营养因子和致敏蛋白竞争物(大豆球蛋白、β-伴大豆球蛋白、SBA、BBI)的IC50进行计算(交叉反应率CR=KTI的IC50/其他竞争物的IC50)[17];免疫印迹试验首先将上述交叉反应竞争物与KTI以同一浓度进行SDS-PAGE,试验时在同一凝胶上做一重复,一半用于考马斯亮蓝染色并脱色观察,另一半进行转膜后,加入抗体37 ℃条件下孵育2 h,经过PBST洗涤,再与GaMIgG-HRP孵育2 h,经PBST洗涤后ECL荧光显色液显色,将显色结果与SDS-PAGE结果进行对照,判断KTI mAb的特异性[18]。
2 结果与分析
2.1 小鼠多抗血清的鉴定
间接ELISA方法测定多抗血清的效价结果(见表1)表明,3只小鼠免疫效果良好,效价均能达到1∶12 800以上,其中1号小鼠免疫效果最为显著。

表1 多抗血清效价的间接ELISA测定结果Table 1 Titer of mouse antiserum detected by indirect ELISA (OD450 mm)
通过间接竞争ELISA鉴定各小鼠多抗血清的敏感性,其中1号小鼠多抗血清敏感性最好,间接竞争ELISA抑制曲线如图1所示,KTI对1号小鼠多抗血清产生了明显的抑制效果,将抑制率B/B0作为纵坐标,KTI浓度对数值作为横坐标绘制抑制曲线,得到线性方程,计算抑制率B/B0为0.5时的多抗血清的IC50为157.33 ng/mL。
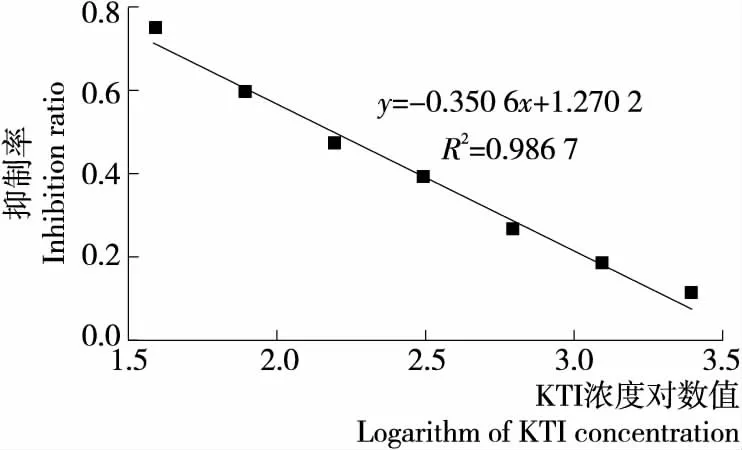
图1 KTI对多抗血清的抑制曲线Figure 1 Inhibitive curve for antiserum to KTI
2.2 KTI mAb的制备
根据免疫小鼠多抗血清效价及敏感性鉴定结果选择1号小鼠进行细胞融合,初次筛选96孔细胞板中强阳性细胞株,然后转入24孔细胞板中扩大培养后复筛,挑选强阳性细胞株,将阳性细胞株进行亚克隆,最终筛选到1株效价高、敏感性好的杂交瘤细胞,命名为4E6-E9,经过多次冻存与复苏后,仍能够稳定分泌抗体。通过小鼠体内诱生腹水法得到4E6-E9腹水,纯化后用于鉴定抗体的免疫学特性。
2.3 KTI mAb效价的测定
通过间接ELISA测定4E6-E9 mAb的效价结果如表2 所示,3次平行重复测定4E6-E9 mAb效价OD450 nm值较为稳定,效价能够达到1∶1 638 400,相对于小鼠多抗血清有显著提高,且高于张国龙等[9]制备的兔源多抗血清效价(1∶128 000)。

表2 4E6-E9 mAb效价测定Table 2 Determination of the titer of 4E6-E9 mAb (OD450 nm)
2.4 KTI mAb亚型的鉴定
采用mAb分型试剂通过间接ELISA方法对4E6-E9 mAb亚型进行鉴定,结果如图2所示,根据分型试剂与4E6-E9 mAb结合的OD450 nm值判断获得抗体亚型,结果IgG1分型试剂对应的OD450 nm值最高,且其他分型试剂对应的OD450 nm值均较小,说明所制备的4E6-E9 mAb亚型为IgG1型。

图2 4E6-E9 mAb亚型鉴定Figure 2 Identification of subtype of 4E6-E9 mAb
2.5 KTI mAb亲和常数的测定
将KTI以5,1 μg/mL两个浓度分别包被ELISA酶标板,通过ELISA饱和法绘制的亲和常数测定曲线如图3 所示,5 μg/mL包被时,4E6-E9 mAb与KTI结合达到半饱和状态的浓度为794.18 ng/mL;1 μg/mL包被时,4E6-E9 mAb与KTI结合达到半饱和状态的浓度为600.96 ng/mL。根据公式计算可得Ka=1.45×108L/mol,通常Ka>107L/mol即为高亲和力抗体[19],因此试验所制备的4E6-E9 mAb具有较高的亲和力。

图3 4E6-E9 mAb亲和常数测定曲线Figure 3 Affinity constant measurement curve of 4E6-E9 mAb
2.6 KTI mAb敏感性的鉴定
间接竞争ELISA抑制曲线如图4所示。由抑制曲线的线性回归方程可以计算得到4E6-E9 mAb的IC50为28.39 ng/mL,相对于小鼠多抗血清,敏感性有了显著提升。邢春芳等[10]制备兔源多抗血清所建立的ELISA方法的IC50为360 ng/mL,与其相比,试验所制备的4E6-E9 mAb 具有较低的IC50,说明单抗的敏感性高于多抗敏感性,更有利于ELISA检测方法的建立。

图4 KTI对4E6-E9 mAb的抑制曲线Figure 4 Inhibitive curve for 4E6-E9 mAb to KTI
2.7 KTI mAb特异性的鉴定
由表3可知,4E6-E9 mAb与大豆球蛋白、β-伴大豆球蛋白、BBI、SBA的交叉反应率>0.3%,表明4种竞争物与4E6-E9 mAb之间基本没有交叉反应。
将4种竞争物与KTI进行SDS-PAGE,同一凝胶上做一重复,将所做重复进行免疫印迹试验。4E6-E9 mAb特异性鉴定结果如图5所示,对比结果表明4E6-E9 mAb仅与第6泳道KTI蛋白结合,表明试验所制备的4E6-E9 mAb具有较强的特异性。

表3 4E6-E9 mAb的交叉反应结果Table 3 The cross-reactivity of 4E6-E9 mAb

1. Marker 2. 大豆球蛋白 3. β-伴大豆球蛋白 4. SBA 5. BBI 6. KTI
3 结论
试验在免疫BALB/c小鼠,获得效价和敏感性良好的多抗血清基础上,进行细胞融合,筛选阳性杂交瘤细胞株,得到稳定分泌KTI mAb的4E6-E9杂交瘤细胞株。通过体内诱生腹水法制备4E6-E9 mAb,并对抗体免疫学特性进行充分鉴定,其效价达到1∶1 638 400,亚型为IgG1型,亲和常数为1.45×108L/mol,IC50为28.39 ng/mL,且只与KTI特异性结合,与其他抗营养因子和致敏蛋白结合无交叉反应。试验制备的KTI mAb具备良好的免疫学特性,可用于灵敏、特异的大豆及其制品中KTI免疫学检测方法的建立,但在具体免疫学检测方法研究中,仍需对其应用条件和方式进行进一步探索,若将其与功能性纳米材料及高通量传感技术相结合,开发新型快速检测方法与装备,将会为饲料中抗营养因子以及食品中大豆致敏蛋白的高效监测提供有力技术支撑。
