综合方法治疗非酒精性脂肪性肝炎临床疗效分析
2019-09-24孙潇泱常薪霞夏明锋颜红梅
孙潇泱,常薪霞,夏明锋,王 柳,卞 华,颜红梅
复旦大学附属中山医院内分泌科,上海 200032
随着我国经济发展及生活方式的改变,非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)等肥胖相关代谢性疾病患病率逐渐增加,已成为严重威胁国民健康的重大公共卫生问题。NAFLD是指除外过多饮酒史和病毒性肝炎等明确损肝因素后,过多脂肪沉积于肝脏的一组疾病,包括预后相对良好的单纯肝脂肪变性及代表进展期肝病的脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。NAFLD一方面可引起糖尿病、心血管疾病(CVD),另一方面可进展为肝硬化,甚至肝癌,是引起终末期肝病和肝癌的首要病因之一[1]。早期防治NAFLD,对防治糖尿病等代谢相关疾病及肝病不良结局具有重要意义。但是,NAFLD目前主要依靠生活方式干预[2],缺少有效的治疗药物[3]。而且,目前国内用于治疗脂肪肝的保肝药物对NASH的疗效也不明确,同时也缺乏肝脏组织学证据[4-6]。
因此,本研究依据国内外指南[2,7],对NASH患者进行综合治疗,在生活方式干预的基础上,采用联合药物控制血压、血糖、血脂及保护肝功能等的综合治疗方法,通过分析患者治疗前后肝脏组织学改变及相关代谢指标的变化,总结综合治疗的经验,为将来开展大规模中国脂肪肝人群研究提供参考依据。
1 资料与方法
1.1 一般资料 选择2011年1月至2018年11月在复旦大学附属中山医院内分泌科住院的NAFLD患者。纳入标准:18~79岁;符合中华医学会内分泌学分会2010年发布的《非酒精性脂肪性肝病与相关代谢紊乱诊疗共识》[2]中NAFLD的诊断标准;经肝组织活检病理诊断符合NASH;愿意接受治疗后肝脏穿刺检查者。排除标准:合并心、脑、肾和造血功能系统等严重疾病者;妊娠或哺乳期妇女;精神疾病患者。本研究经医院伦理委员会审核批准。
1.2 NASH的诊断标准 病理诊断标准:肝细胞大泡性或以大泡性为主的脂肪变性≥5%。NASH的诊断和严重程度分级依据《美国国立卫生研究院NASH临床研究网病理工作组指南》,并进行NAFLD活动度积分(NAFLD activity score, NAS)和肝纤维化评分。NAS评分系统由3个部分组成:脂肪变性0~3分,肝小叶炎症0~3分,气球样变性0~2分;总分0~8分。NAS总分>4分定义为NASH,3~4分提示NASH可能;当NAS=4分,且组织学表现同时存在脂肪样变性、小叶内炎症、气球样变性时,也可诊断为NASH。肝纤维化评分:无纤维化为0分(F0),窦周或门管区周围纤维化为1分(F1),窦周和门管区或门管区周围纤维化为2分(F2),桥接纤维化为3分(F3),肝硬化为4分(F4)。
除了NAS评分系统,同时采用2016年由欧洲肝病学会、欧洲糖尿病研究学会、欧洲肥胖研究学会联合发布的《NAFLD临床实践指南》[7]中推荐的肝脂肪变性、活动度、纤维化评分系统(the steatosis, activity and fibrosis score,SAF)对NASH严重程度进行评价。SAF评分系统:脂肪变性0~3分,活动度0~4分,纤维化0~4分;总分0~11分;活动度评分为肝小叶炎症(0~2分)和气球样变性(0~2分)之和;纤维化评分标准同上述肝纤维化评分。基于SAF评分系统,根据肝纤维化程度,将NASH分为早期NASH(early NASH, F0~F1)和纤维化性NASH(fibrotic NASH, F2~F4);纤维化性NASH又可进一步分为显著纤维化性NASH (F2),进展性纤维化性NASH (F3),NASH肝硬化 (F4)。
1.3 健康教育 患者首次住院期间给予相关疾病知识科普教育,帮助其树立逆转NASH的信心,同时给予饮食控制、运动强度、用药依从性方面的指导。出院后进行电话、线上随访,督促患者坚持治疗。住院期间给予患者减少500 kJ热量的饮食,教会患者进行食物热量换算,嘱其出院后坚持饮食控制。嘱患者每周运动5 d,每天进行30 min以上中等强度的运动。
1.4 代谢性疾病的药物控制 降糖药物包括二甲双胍、磺脲类促泌剂、噻唑烷二酮类(吡格列酮)、α糖苷酶类、胰岛素。降压药物包括血管紧张素Ⅱ受体拮抗剂(ARB)、钙离子受体拮抗剂(CCB)。降脂药物包括他汀类、贝特类。保肝药包括水飞蓟宾葡甲胺片、多烯磷脂酰胆碱胶囊、复方甘草酸苷片、双环醇、还原型谷胱甘肽。中药包括扶正化瘀胶囊、盐酸小檗碱片。此外还有甲状腺激素、维生素D、苯溴马隆等。
1.5 疗效判定标准 NASH改善:NAS总分至少减少1分,即肝细胞脂肪变性、气球样变性、肝小叶炎症评分中至少有1项减少,肝纤维化评分不增加;或上述3项评分未增加,肝纤维化评分至少减少1分。NASH进展:NAS总分增加,或肝纤维化评分至少增加1分。
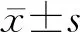
2 结 果
2.1 患者基本特征及用药情况 接受治疗前肝穿刺的病例有249例,治疗后接受肝穿刺者仅11例,排除临床资料不完整者1例,共纳入10例患者。结果(表1、表2)表明:10例患者中,男性2例、女性8例,治疗期前患者年龄(54.2±9.6)岁;合并糖尿病7例,糖耐量异常1例,合并高血压6例,合并血脂异常4例,合并甲状腺功能减退4例。患者的代谢及肝功能指标见表2。患者的药物治疗方案及治疗时长见表3。

表1 治疗前患者的一般情况
1 mmHg=0.133 kPa
表2 治疗前患者的相关实验室指标
FPG: 空腹血糖; HbA1c: 糖化血红蛋白; TC: 总胆固醇; TG: 三酰甘油; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALT: 丙氨酸氨基转移酶; AST: 天冬氨酸氨基转移酶; GGT: γ-谷氨酰转肽酶
2.2 患者治疗前后肝脏病理改变 治疗前,10例患者中有3例为早期NASH、2例为显著纤维化性NASH、4例为进展性纤维化性NASH、1例NASH肝硬化。结果(表4)表明:经过1.04(0.73,1.54)年的治疗,80%(8/10)的患者获得了NASH的改善,NAS总分下降1 (0.5,3.5)分,SAF总分下降了2.5(0,4)分。3例患者肝脂肪变性、气球样变性、肝小叶炎症均完全消失,其中2例肝组织恢复正常(图1)、1例肝纤维化仍存在。7例肝纤维化等级下降了1 (0.5,1.5)分。2例患者未获得NASH的改善,其中1例NAS总分不变、另1例脂肪变性评分减少,但2例患者纤维化评分均增加。患者9在治疗前无自身免疫性肝病证据,肝脏病理结果提示NASH,治疗后肝脂肪变性完全消失,同时发生了轻度界面性肝炎、胆管炎、胆管周围炎伴门管区纤维增生,故病理诊断为原发性胆汁性肝硬化。

表3 患者的药物治疗方案

表4 患者治疗前后肝脏病理学评分及诊断 治疗前/治疗后

图1 患者2治疗前后肝脏病理检查结果
A:苏木精-伊红(H-E)染色示治疗前肝细胞脂肪变性(NAS脂肪变性2分);B:H-E染色示治疗后肝细胞脂肪变消失;C:网状纤维染色示治疗前肝脏纤维间隔形成;D:网状纤维染色示治疗后肝脏纤维间隔消失. Original magnification: ×400(A、B),×100(C、D)
2.3 患者代谢及肝功能改善情况 结果(表5)表明:治疗后,患者体质量下降,降幅为9.92%(1.16%,17.6%),体质指数(BMI)下降(P<0.05),同时糖化血红蛋白(HbA1c)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(GGT)均下降(P<0.05)。治疗前后空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)均控制在合理范围。
结果(图2)表明:治疗后,NASH改善患者的体质量明显下降[(63.5±7.54) kgvs(73.14±7.69) kg,P<0.05],且降幅更明显,为12.56%(8.95%,17.54%),收缩压控制在(128.14±8.8) mmHg(1 mmHg=0.133 kPa)、舒张压(83.14±7.47) mmHg;NASH进展患者上述指标无明显改变。
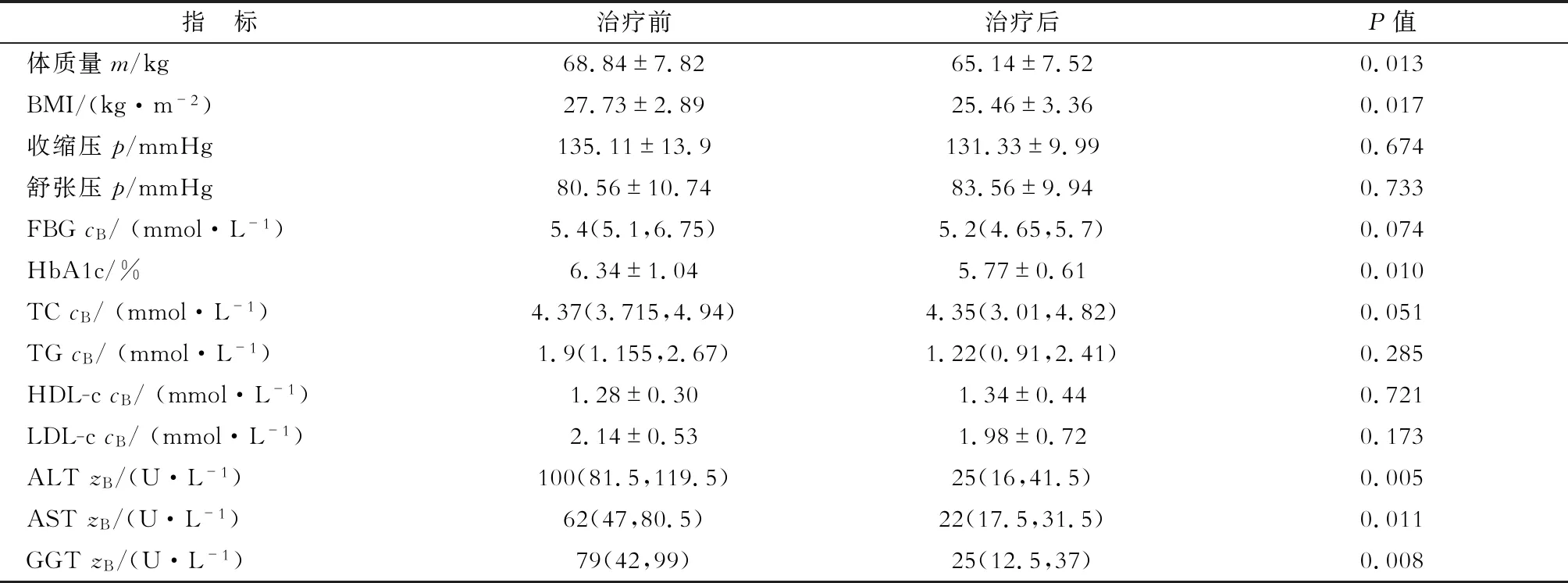
表5 患者治疗前后相关代谢及肝功能指标改变
BMI:体质指数,FPG: 空腹血糖, HbA1c: 糖化血红蛋白, TC: 总胆固醇, TG: 三酰甘油, HDL-c: 高密度脂蛋白胆固醇, LDL-c: 低密度脂蛋白胆固醇, ALT: 丙氨酸氨基转移酶, AST: 天冬氨酸氨基转移酶, GGT: γ-谷氨酰转肽酶. 1 mmHg=0.133 kPa

图2 NASH改善患者(A、C、E)及NASH进展患者(B、D、F)治疗前后体质量及血压的变化情况
3 讨 论
本研究采用肝脏穿刺病理学检查判断组织学改变,从而评价综合治疗对NASH患者的疗效。结果发现,经过综合治疗,早期NASH和进展性肝纤维化患者的肝脏组织学改变多获得改善,其中部分患者肝组织还恢复正常。对NASH患者采用综合治疗,控制其体质量、血压、血糖、血脂,可以延缓其肝脏病变进展。
本研究中,80%(8/10)的患者NASH得到了改善,同时有20%的患者(2/10)出现疾病进展。与进展患者相比,NASH改善患者的体质量改变最明显。NASH改善患者中,中位体质量下降百分比为12.56%,最高达23.61%。一项纳入293例NASH患者的国外研究[8]发现,减重超过5%的患者中58%可发生NASH的逆转;减重超过10%的患者中则有高达90%的患者可实现NASH的逆转,其中45%的患者可实现肝纤维化的改善。本研究中5例患者减重超过10%,肝纤维化程度均减轻,其中3例肝细胞脂肪变性和气球样变性完全逆转。因此,对于中国NASH患者来说,减重同样是改善NASH的重要有效手段。
除了肥胖之外,高血压、糖尿病也是NASH患者小叶间隔纤维化和肝硬化的危险因素[9]。因此,改善代谢异常的药物可能对NASH有治疗作用。本研究结果发现,8例伴随糖代谢异常的患者中,FBG和HbA1c水平均较治疗前下降或与治疗前持平,其中7例NASH改善。噻唑烷二酮类药物是本研究中主要的降糖药物之一。一项纳入8项噻唑烷二酮类药物相关的随机对照试验的meta分析[10]显示,应用吡格列酮与进展期纤维化改善(OR=3.15)、不同程度的纤维化改善(OR=1.66)及NASH的缓解(OR=3.22)有关。本研究中6例患者伴高血压,其中4例发生了NASH改善,2例出现了进展。改善的4例患者均将血压控制在140/90 mmHg以下,而进展的2例血压水平较前升高,收缩压大于或约等于140 mmHg。此外,高血压与胰岛素抵抗也密切相关。上述结果提示,除控制血糖外,积极治疗代谢综合征其他组分,如高血压,也有助于改善肝脏组织学病变。血管紧张素Ⅱ受体阻滞剂(ARB)类降压药是本研究中主要的降压药物之一。该类药物除了具有减重效果、降低胰岛素水平之外,还能增加脂肪β氧化水平,下调转化生长因子-β(TGF-β),进而改善肝脏脂肪沉积及纤维化[11]。
此外,本研究对无禁忌证的患者给予了扶正化瘀胶囊和盐酸小檗碱,NASH的改善也可能与这些药物的作用有关。已有多中心临床研究[12]发现,扶正化瘀胶囊可以显著降低慢性乙型肝炎患者的肝组织学纤维化评分。但目前扶正化瘀胶囊对NASH患者的作用尚缺乏肝组织学评价依据。本课题组前期发现,相比于单纯生活方式干预,盐酸小檗碱联合生活方式干预减轻体质量、改善胰岛素敏感性的效果更佳[13]。盐酸小檗碱还可降低肝脏脂肪含量[13],而其对NAFLD患者肝脏组织学层面的疗效的随机对照试验(RCT)目前尚在进行中。另外,本研究中有4例合并甲状腺功能减退,均长期进行甲状腺素补充替代治疗。这4例患者均发生了NASH的改善。研究发现,亚临床甲状腺功能减退及正常偏低的甲状腺功能独立预测NASH与进展期纤维化[14];补充左甲状腺素钠可降低12%的肝脏脂肪含量[15],但补充左甲状腺素钠对肝纤维化的影响则尚无文献报道。
值得注意的是,治疗后,肝脏组织学病变进展的2例患者ALT、AST、GGT均较治疗前明显下降,提示肝功能指标与肝脏组织学病变程度并不一致。因此,肝组织活检依然是诊断及评价NASH治疗效果的金标准。国内关于NASH药物疗效的研究多采用血清学、影像学等无创评价方法[6,16],但这些方法尚不能替代肝组织学评估[7,17]。因此,对于中国脂肪肝相关药物研究,建议建立以肝脏组织学为疗效评估手段的理念。
综上所述,本研究通过比较NASH患者治疗前后的肝脏组织学表现及代谢参数,发现降糖、降脂、降压、护肝等综合治疗可以减轻NASH患者的病情,该效应可能与体质量与血压的下降有关。肝脏组织学活检是判断NASH患者肝功能改善的金标准。本研究存在一定的局限性:由于患者对于重复肝脏有创检查接受度低,本研究样本量小;属于观察性研究,患者伴随疾病与用药不统一,综合治疗疗效的影响因素较多。生活方式干预及各类药物对NASH的改善作用,尚需多中心、大样本的更高质量的RCT研究加以验证。
