不同心肌显像测定左心室功能参数对左心室室壁瘤患者临床诊疗决策及预后评估的价值
2019-09-24王伟学张晓丽
王伟学,张晓丽
1. 桂林医学院附属医院中医科,桂林 541001 2. 北京协和医学院中国医学科学院国家心血管病中心,阜外医院核医学科,北京100037 3.首都医科大学附属北京安贞医院核医学科,北京 100029
左心室室壁瘤(left ventricular aneurysm, LVA)是急性心肌梗死(acute myocardial infarction,AMI)患者常见并发症,可导致严重左心室重构、进展性慢性心力衰竭、室性心律失常和猝死[1-2]。心肌存活性、左心室重构指数等左心室功能参数与LVA患者预后密切相关[3-4]。因此,筛选客观有效的左心室功能指标对指导AMI后LVA患者临床诊治决策及预后评估具有重要价值及意义。
既往研究[5-8]表明,左心室造影或心脏磁共振显像(cardiac magnetic resonance imaging,CMR) 测定的左心室收缩末期容量(end systolic volume,ESV)或收缩末期容量指数(ESV index, ESVI)是预测急性心肌梗死(myocardial infarction,MI)患者心源性死亡的独立危险因素。但相关检查耗时较长,采集序列复杂,对技术要求高,采集时间较长,且不能用于某些有金属植入物的患者,严重制约了其临床应用。
近年来,随着核医学技术的快速发展,门控单光子发射型计算机断层显像 (single-photon emission computed tomography,SPECT)心肌灌注显像和门控18F-FDG正电子发射型计算机断层显像(positron emission tomography,PET)心肌代谢显像,均可获得客观的左心室功能参数[9],但目前缺乏上述不同影像学方法获取的左心室功能参数对于同一队列LVA患者的预后评估价值的相关研究。因此,本研究在前期研究[10]的基础上,探讨门控SPECT心肌灌注显像、门控PET心肌代谢显像和CMR所测的左心室重构参数与LVA患者预后的相关性,并进一步评估心肌存活性、左心室重构对LVA患者预后的预测价值,为后续研究提供参考。
1 资料与方法
1.1 一般资料 入选标准:2009年7月至2012年4月,于中国医学科学院阜外医院就诊,经CMR明确诊断的LVA患者。所有患者在2 d内均行99mTc-MIBI SPECT静息心肌灌注显像和18F-FDG PET心肌代谢显像,并在2周内行CMR和超声心动图检查。排除标准:(1)心律失常,包括房颤、频发期前收缩、阵发性心动过速等;(2)合并瓣膜病;(3)心肌病;(4)MRI检查禁忌证,包括植入起搏器、人工瓣膜及其他金属植入物;(5)患者接受室壁瘤切除术。
1.2 心肌显像方法及结果判定 静息门控SPECT心肌灌注显像:采用德国Siemens公司E-CAM双探头SPECT仪,配平行孔低能高分辨率准直器。静息门控心肌PET心肌代谢显像:采用德国Siemens公司PET仪(Truepoint Biography 64, Siemens Healthcare)。具体图像采集、处理与分析方法参照文献[9-10]。
心肌存活的判定:采用17节段5分法[11],分别获得静息心肌灌注异常总积分(SRS)和心肌代谢异常总积分(SFS),并计算二者差值,定义为灌注-代谢不匹配分(mismatch score,MMS),通过17节段的SRS减去SFS的差值获取,代表心肌存活的程度和范围,值越高,提示心肌存活量越多。
室壁瘤心肌存活的判定:为判断不同心肌区域的存活心肌对室壁瘤患者的预后价值,将左心室17个节段区分为室壁瘤节段、室壁瘤+室壁瘤周边节段和非室壁瘤节段(室壁瘤周边+室壁瘤远端)。室壁瘤区域被定义为CMR表现为无运动或反向运动。所有与室壁瘤区域毗邻节段均被定义为室壁瘤周边。分别计算室壁瘤周边、室壁瘤+室壁瘤周边和非室壁瘤区域的SRS、SFS、MMS,以及左心室总的SRS、SFS、MMS。如1名心尖室壁瘤患者,获取心尖、前壁心尖段、间隔心尖段、下壁心尖段和侧壁心尖段的所有SRS、SFS,并计算MMS。由于室壁瘤常累及多个节段,所以按照前期研究[10]的结果,如果室壁瘤部位MMS≥2.0,定义为室壁瘤部位有存活心肌。
1.3 心脏磁共振成像及心室重构程度的分析 采用德国Siemens公司 Magnetom Avanto 1.5 T超导型磁共振成像仪,场强为40 mT/m,梯度切换率200 T/m,利用相控阵表面线圈和心电门控技术采集图像。True FISP cine序列扫描参数:翻转角为80°,矩阵256×256,视野350~400 mm,层厚8 mm,每个心动周期采集25帧图像。采用德国Siemens公司的ARGUS软件半自动勾画左心室短轴舒张末期和收缩末期心内外膜边界,Simpson法计算舒张末期容积(EDV)、ESV和左室射血分数(LVEF)。
门控PET、门控SPECT和CMR获得的EDV和ESV均通过中国成人体表面积(BSA)校正[11],从而获得舒张末期容积指数(EDV index,EDVI) 和收缩末期容积指数(ESV index,ESVI),用来表示左心室重构的严重程度。中国成人BSA公式: BSA=0.006 1×身高+0.012 4×体质量—0.009 9。
1.4 术后随访 平均随访时间为(3.9±1.5)年 (0.1~6.1年,中位数4.1年)。唯一的随访终点事件为心源性死亡,包括死于再发心肌梗死、充血性心力衰竭或猝死(指出现心脏病症状后1 h内死亡)。
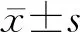
2 结 果
2.1 入选患者基本资料及分组情况 入选136 例患者,其中6例 (4.4%) 失访,4例患者由于图像质量差被排除,最后共入选126例患者。126例患者中包括111例男性和15例女性,平均年龄为(56.9±9.6)岁。随访期间,21例 (16.7%) 发生心源性死亡。
126例患者根据室壁瘤存活性(MMS ≥ 2.0)和左心室重构(门控PET ESVI > 60 mL/m2)分为3组,组1:室壁瘤无心肌存活且无左心室重构 (室壁瘤存活-/左心室重构-,n=50);组 2:室壁瘤无心肌存活但有左心室重构 (室壁瘤存活-/左心室重构+,n=37);组3:室壁瘤心肌存活且伴或不伴左心室重构(室壁瘤存活+/左心室重构+,n=15;室壁瘤存活+/左心室重构-,n=24)。结果(表1)表明:组2比组1合并中重度二尖瓣反流患者比例较高(P<0.05),与组2、组3相比,组1中更多患者既往有PCI术治疗史(P<0.05)。3组患者间其他临床特征数据差异无统计学意义。
BMI:体质指数; CAD:冠状动脉疾病; MI:心肌梗死; PCI:经皮冠脉介入治疗; CABG:冠状动脉旁路移植; YHA:纽约心脏病协会功能分级; ACE-I:血管紧张素转换酶抑制剂; ARB:血管紧张素受体拮抗剂.*6例临床诊断为CAD患者,其冠脉造影冠脉狭窄低于50%
2.2 各组间左心室功能参数及预后的比较 结果(表2)表明:3组间患者治疗决策、左心室总的灌注异常积分(LV-SRS)和室壁瘤总灌注积分(LVA-SRS)差异无统计学意义。组 2患者采用门控PET、门控SPECT和CMR测定的EDVI和ESVI显著高于组1 (P<0.001)。

表2 不同影像学方法的LV 重构与存活参数
GPET:门控PET; CMR:心脏磁共振;GSPECT:门控SPECT; LV:左心室;LVEF:左心室射血分数; EDVI:左心室舒张末期容积指数; ESVI:左心室收缩末期容积指数; SRS:总静息灌注积分; MMS:不匹配分
Kaplan-Meier生存曲线结果(图1)表明:组1患者的年死亡率(0.9%)最低,明显低于组3的年死亡率(9.3%,P=0.001)。组2患者年死亡率为4.1%,与组3(P=0.065)、组1(P=0.052)相比,差异无统计学意义。

图1 3组患者的Kaplan-Meier生存曲线
2.3 再血管化治疗对各组患者预后的影响 结果(图2)表明:与药物治疗相比,再血管化治疗没有明显改善组1 [(96±4)%vs(96±4)%,P=0.908)]和组 2 [(84±7)%vs(83±11)%,P=0.999)患者的生存率。再血管化治疗可明显改善组3患者的生存率[(82±10)%vs(47±12)%,P=0.012)。
2.4 LVA预后Cox回归分析
2.4.1 单变量Cox比例回归分析 结果(表3)表明,可独立预测LVA患者心源性死亡的主要变量包括:女性、年龄、BMI、室壁瘤SRS、室壁瘤MMS、3种方法(门控PET、门控SPECT和CMR)测定的EDVI和ESVI、门控PET测定的LVEF (P<0.05)。PET-ESVI与室壁瘤MMS存在交互作用(HR 1.004, 95% CI 1.002~1.007,P<0.000 1),门控PET-ESVI、室壁瘤MMS与再血管化治疗无交互作用。

图2 不同治疗方案对3组患者生存率的影响
2.4.2 多变量Cox比例回归分析 进一步的多因素分析结果(表3)表明,门控PET-ESVI(HR 1.024, 95%CI 1.011~1.037,P=0.000 4)和室壁瘤MMS(HR 1.284, 95%CI 1.051~1.577,P=0.015)是预测心源性死亡的独立危险因子。

表3 患者心源性死亡的单变量与多变量Cox回归分析
BMI:体质指数; CAD:冠状动脉疾病; MI:心肌梗死; PCI:经皮冠脉介入治疗; CABG:冠状动脉旁路移植; NYHA:纽约心脏病协会功能分级; ACE-I:血管紧张素转换酶抑制剂; ARB:血管紧张素受体拮抗剂;GPET:门控PET; CMR:心脏磁共振;GSPECT:门控SPECT; LV: 左心室;LVEF:左心室射血分数; EDVI:左心室舒张末期容积指数; ESVI:左心室收缩末期容积指数; SRS:总静息灌注积分; MMS:不匹配分.*圆括号内为95% 可信区间(CI)
3 讨 论
本研究结果表明,门控SPECT、门控PET和CMR所评估的EDVI和ESVI相比较,门控PET-ESVI对预测LVA长期心源性死亡预后价值更高,推测其部分原因如下:对于有严重重构的LVA患者来说,Laplace原理可以较好地解释PET-ESVI预测心源性死亡优于CMR-ESVI的原因。Laplace公式为:心室壁张力= (心腔压力×半径)/(2 ×室壁厚度)。该公式提示,随着心脏扩张而左心室半径会增大,室壁会变得更薄,同时,大心腔的左心室壁张力增加会更明显[12]。这些因素显著影响了心内膜下血供,心肌摄取显像剂FDG也会受到影响,从而导致PET显像测定左心室容积,勾画心内膜的范围比CMR勾画心内膜范围更大。即心内膜下微血管功能障碍使得局部心肌对FDG摄取减少,从而导致高估左心室心腔大小。而在没有明显左心室重构的患者,PET-ESVI比CMR-ESVI值小,这可能是由于部分容积效应(partial volume effects)所致。相反地,部分容积效应对严重重构患者ESVI值的影响较上述无明显重构的患者相对较小。
本研究还发现作为量化室壁瘤存活心肌的指标——室壁瘤MMS是预测心源性死亡的阳性独立危险因子,与既往研究[10]结果一致。既有室壁瘤存活又有心室重构的高危患者,早期进行血管重建术治疗,可明显改善患者预后。而二者皆为阴性的患者,可以只接受药物治疗,避免手术风险。
近期的STICH 试验[7]显示左心室重构与缺血性心肌病患者预后显著相关, 与本研究结果一致。本研究存在一定的局限性:首先,该研究是回顾性单中心研究,患者采取药物还是单独再血管治疗或联合室壁瘤切除/手术心室重建(SVR)并非随机,因此,会导致选择性偏倚。其次,样本较小,相关结论仍需大样本研究进一步证实。尽管如此,本研究仍然是目前已知同时获取了左心室室壁瘤患者3种不同影像学方法测定的左心室重构参数,并进行长期随访的最大队列。
综上所述,在门控SPECT心肌灌注显像、门控PET心肌代谢显像、CMR等3种不同影像学方法测定的左心室重构参数中,门控PET-ESVI具有较高的预测室壁瘤患者心源性死亡的价值。室壁瘤有心肌存活且有明显左心室重构的患者心源性死亡的风险明显增高,再血管化治疗与此类患者长期心源性生存率改善相关。既无左心室重构又无室壁瘤心肌存活的患者,长期预后良好,5年生存率可以高达95%,可采用单纯药物治疗。
