短序润楠扦插生根特性及相关生理生化分析
2019-09-23徐茵卢艺菲袁森
徐茵 卢艺菲 袁森


摘要:以10年生短序润楠(Machilus breviflora)1年生嫩枝为插穗,分别用清水(CK)和500 mg/L ABT生根粉溶液浸泡30 min,采用随机区组设计,扦插于体积比为1 ∶ 1 ∶ 1的黄心土、河沙、珍珠岩混合基质中,分析其生根特性,并动态监测生根过程中插穗内可溶性糖和可溶性蛋白质含量、超氧化物歧化酶(SOD)和吲哚乙酸氧化酶(IAAO)活性、丙二醛(MDA)和叶绿素含量的变化。结果表明,可溶性糖和可溶性蛋白含量与插穗生根率呈极显著正相关(P<0.01),扦插过程中二者含量的高低以及变动幅度的大小直接会对扦插效果造成影响;短序润楠扦插生根率与SOD活性呈显著正相关(P<0.05),并与叶绿素(a+b)含量呈极显著正相关(P<0.01),与IAAO活性及MDA含量呈显著负相关(P<0.05);ABT处理提高了插穗内SOD活性,减缓了叶绿素(a+b)的分解速率,降低IAAO活性和MDA含量,增加插穗抵御逆境能力和促根激素IAA含量,延缓插穗衰老,从而促进生根。此外,扦插过程中各生理指标之间相关性也十分密切,说明各生理指标并不是单一地对插穗生根起作用,而是相互影响。
关键词:短序润楠;扦插;生根特性;生理生化;相关性
中图分类号: S718.43 文献标志码: A 文章编号:1002-1302(2019)14-0153-04
短序润楠(Machilus breviflora)隶属于樟科(Lauraceae)润楠属(Machilus),是华南地区的乡土树种。其春季嫩叶呈红色,叶及树皮含挥发油,枝叶浓密,分枝呈层状伸展,有较高的观赏价值和潜在的药用价值[1],目前在园林造景中应用较少,具有广阔的市场前景。
关于短序润楠人工繁育的报道并不多见。种子繁殖是目前主要且成活率较高的繁殖途径,用赤霉素(GA3)处理后,其发芽率高达100%[2],但扦插育苗生根率仅为48.89%[3]。传统的种子繁殖虽然成活率高,但成苗速度慢,且存在严重的变异分化现象,优良性状易丧失,因此为了能持续稳定地获得短序润楠优良无性繁育苗,本研究将对短序润楠插穗内的生理指标进行动态监测,探究扦插生根过程中的生理学特性,以期为提高种质资源的保存、繁殖效率以及为今后的开发利用提供一定的理论依据和技术支撑。
1 材料与方法
1.1 试验材料
试验所用插穗来源于广东省江门市鹤山共和林业示范基地,以10年生短序润楠做采穗母株。促根剂为购自博翔生物科技有限公司的ABT生根粉,扦插基质为黄心土、河沙、珍珠岩混合(体积比为1 ∶ 1 ∶ 1)而成。
1.2 试验方法
1.2.1 插穗制备 扦插前1 d在基地内剪取生长健壮、整齐一致、无病虫害的短序润楠半木质化枝条带回试验地,截取枝条上端8~12 cm作为插穗,下切口斜剪,当晚将插穗基部置于清水内浸泡。
1.2.2 扦插方法 于2017年6月8日在广州市华南农业大学树木园温室大棚内进行扦插。扦插前3 d用0.5%高锰酸钾溶液对插床进行消毒。将制备好的插穗分成2组:处理组(ABT)和对照组(CK)。处理组用500 mg/L ABT浸泡插穗基部30 min,对照组用清水处理。在插床上采用随机区组设计,3次重复,每个区组处理组和对照组的插穗各120条。
1.2.3 插后管理 插床的遮阴率控制在75%左右(用遮阳网控制)。棚内配置自动间歇喷水装置,视情况调节喷水次数。插后每隔2周喷洒0.5%高锰酸钾溶液消毒,并及时清除干枯霉变的插穗,保证各区组环境条件相同。
1.3 取样及指标测定
1.3.1 取样方法 扦插前(0 d)采样1次,扦插后每隔14 d取1次样,共取样7次,每次均在3个区组各随机取8株,进行3次重复测定。
1.3.2 生理指标 可溶性糖含量采用蒽酮法测定;可溶性蛋白含量、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量采用李合生的方法[4]测定;吲哚乙酸氧化酶(IAAO)活性采用比色法[5]测定;叶绿素含量采用丙酮提取法[6]测定。
1.3.3 形态指标 扦插后100 d统计插穗生根情况,包括生根率、愈伤率、鲜活率、平均根数、平均根长。
1.4 数据分析
采用Excel 2013和SPSS 19.0对相关数据进行整理、分析及图表绘制。
2 结果与分析
2.1 短序润楠扦插苗的生根特性
试验观察发现,ABT处理组和清水对照组愈伤组织形成期基本一致,均在扦插后的20 d左右,但前者不定根形成期比后者提前15 d左右。可将短序润楠扦插苗不定根的形成过程划分为3个阶段:愈伤组织形成阶段(0~20 d)、不定根表达阶段(21~60 d)和不定根伸长阶段(61~100 d)。
100 d后生根情况调查显示,ABT处理组的插穗平均根数为2.9条/穗,平均根长为17.5 mm,愈伤率为19.7%,鲜活率为79.2%,生根率为46.8%;对照组平均根数为 1.0条/穗,平均根长为7.6 mm,愈伤率为7.0%,鲜活率为55.6%,生根率为31.1%(表1)。
对2组处理的根系指标进行方差分析(表2)可知,处理组和对照组插穗的愈伤率、鲜活率、生根率差异极显著(P<0.01),2组插穗的平均根数和平均根长差异显著(P<0.05),說明使用ABT促根剂能显著或极显著影响插穗的生根情况。
2.2 短序润楠扦插生根过程中营养物质含量的变化
2.2.1 可溶性糖含量的变化 如图1所示,在0~28 d,ABT处理组插穗内可溶性糖含量持续下降,此时插穗处于愈伤组织和根原始体形成期,需消耗大量营养。在42~84 d,可溶性糖含量又逐渐上升,这期间大部分插穗逐渐形成不定根,可以从基质中吸取养分,光合作用逐渐恢复,插穗能够自身合成糖类。整个扦插期间,处理组插穗可溶性糖含量始终高于对照组,两者之间可溶性糖含量差异明显,处理组可溶性糖含量在28 d降到谷值后开始回升,比对照组要早14 d;且处理组在谷值时可溶性糖含量降幅为37.03%,低于对照组的48.56%,这说明ABT处理可以调节插穗内可溶性糖含量的变化而促进生根。插后84 d对照插穗可溶性糖含量出现降低的情况,可能是由于不定根的伸长使得体内呼吸作用增强,增加了可溶性糖的消耗。
2.2.2 可溶性蛋白含量的变化 处理组与对照组插穗内的可溶性蛋白含量在整个扦插生根过程中的变化趋势基本均表现为“下降—上升—下降”的趋势(图2)。在扦插前期,可溶性蛋白含量持续下降,比扦插前分别下降40.9%和30.6%,蛋白质属于生根所必需的营养物质,因而在愈伤组织形成阶段插穗内的可溶性蛋白含量会大幅下降。28 d以后,插穗内可溶性蛋白含量开始上升,在扦插后56 d,ABT处理组和清水对照组均达到峰值,且含量基本相同。56~84 d期间,可溶性蛋白含量又开始下降,处理组下降幅度明显高于对照组,可能是因为插穗的根系和地面部分迅速生长,可溶性蛋白需求量增大,从而使插穗内的可溶性蛋白含量出现下降。值得注意的是,除试验56 d和70 d处理组和对照组插穗可溶性蛋白含量基本持平外,其余时间段经ABT处理的均要小于同期对照,这可能是由于ABT处理活化了插穗体内的某些蛋白酶,促进了可溶性蛋白的分解,为插穗生根提供营养物质和能量,进而促进插穗生根。
2.3 短序润楠扦插生根过程中相关酶活性的变化
2.3.1 SOD活性的变化 由图3可知,0~28 d,处理组插穗内SOD活性持续上升至峰值,在此阶段插穗刚受到切割伤害,脱离母体,未能适应新环境,导致SOD活性升高;扦插 28 d 后,不定根开始形成,插穗逐渐适应逆境条件,SOD活性逐渐降低,后逐渐趋于平稳。对照组SOD活性波动相对较大,0~42 d处于上升状态,42 d后开始下降,后又有小幅回升,70~84 d又开始降低,可能是由于对照处理插穗内部环境不稳定,易受到外界环境的干扰。在0~28 d,处理组内插穗SOD活性均高于同期对照,在扦插后28 d,处理组相对于扦插前增幅达到250.8%,明显高于清水对照的196.8%,说明在生根前期ABT处理较大辐度地提高了插穗内SOD活性,以抵御插穗离开母株初期所受到的逆境伤害。28 d以后,处理组SOD活性迅速下降并趋于稳定,而对照组却继续上升,到达峰值52.71 μ/g,并且之后其SOD活性一直高于处理组,说明此时处理组在ABT的作用下已经适应逆境状态并开始生根,而对照组由于还未适应,从而导致SOD活性一直维持在较高水平。
2.3.2 IAAO活性的变化 如图4所示,2组插穗内IAAO活性在扦插0~14 d均明显上升,增幅分别为58.3%和 69.5%,高活性的IAAO使得IAA含量在扦插初期明显降低,有利于插穗不定根原基的诱导和表达。14~42 d,IAAO活性不断下降, 在42 d均到达谷值, 此阶段正是不定根大量生成的时期,由于IAAO活性较低,插穗中IAA不会被其氧化,高含量的IAA有利于插穗形成不定根。42~56 d,IAAO活性逐渐上升,最后基本上趋于平稳,此时,插穗生根状况已趋于稳定,IAA含量降低到适宜水平。对照组与经ABT处理的插穗内IAAO活性变化趋势基本一致,且整个生根过程中,对照的IAAO活性始终高于处理组,说明经过ABT处理过的插穗可以通过调节IAAO的活性从而间接改变插穗内激素IAA的含量,以促进插穗不定根的生长。
2.4 短序润楠扦插生根过程中MDA、叶绿素含量的变化
2.4.1 MDA含量的变化 本试验结果显示,MDA含量在短序润楠插穗生根时期呈现出规律性的变化(图5)。ABT处理组MDA含量在扦插后28 d到达峰值,对照组在其后14 d出现峰值,且其增幅大于ABT处理组,随后插穗内MDA含量持续下降。在扦插后0~28 d,ABT处理组插穗内的MDA含量一直呈上升趋势,这个阶段由于插穗刚脱离母体进入基质,切口还未愈合,体内的水分和营养消耗远远高于其从外界环境中吸取的,从而导致MDA含量大幅上升。在28~84 d的生根过程中,插穗逐渐适应新环境,并大量形成愈伤组织和不定根,可以从外界获取水分和合成营养物质以达到自身消耗与补给两者之间的平衡,因而插穗内的MDA含量随之下降。在整个过程中,除了在扦插后的28 d,清水对照组的MDA含量一直大于ABT处理组,说明清水对照组受到的逆境胁迫更大,这与其生根率低于ABT处理组的结果相符,说明ABT的使用能较大程度地抑制插穗内MDA的含量,使其组织活力维持在较高水平,加强其对逆境條件的耐胁迫性,促进插穗生根。
2.4.2 叶绿素含量的变化 从图6可以看出,ABT处理组与对照组插穗母叶中叶绿素含量的变化趋势基本一致, 均呈现出“降低—升高—降低”的变化趋势。0~28 d,叶绿素含量比扦插前有所减少,ABT处理组叶绿素的含量下降到扦插初始值的60.4%,清水对照组叶绿素的含量为扦插初始值的 50.6%,在42 d之后,插穗母叶内的叶绿素含量开始上升,在扦插后的56 d,ABT处理组叶绿素的含量上升到峰值,清水处理组则要晚14 d才达到峰值,到达峰值后,2组插穗母叶内的叶绿素含量又开始逐渐下降。除了在扦插后的70 d,整个试验过程中,ABT处理组插穗母叶内的叶绿素含量均高于清水对照组,说明植物生长调节剂处理能够延缓短序润楠叶片中叶绿素的降解,从而保证插穗内有足够的叶绿素来进行光合作用。
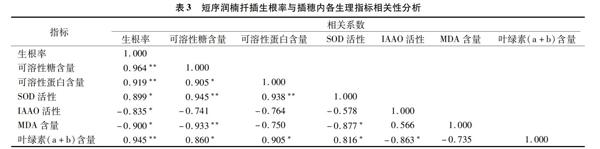
2.5 扦插生根率与插穗内各生理指标相关性分析
植物的扦插生根受插穗内的营养物质、氧化酶和内源激素等生理指标共同影响,研究扦插生根与生理指标的关系不能仅仅以单个指标作为评定标准,因此对生根率与插穗内生理指标之间的相关性进行分析尤为必要。
短序润楠扦插生根过程中生根率与营养物质、氧化酶活性、丙二醛和叶绿素含量之间关系密切(表3)。生根率与可溶性糖、可溶性蛋白和叶绿素(a+b)含量均呈极显著正相关(P<0.01),相关系数分别为0.964、0.919和0.945;生根率与SOD活性呈显著正相关。
各生理指标之间相关性也十分密切,可溶性糖与可溶性蛋白、叶绿素(a+b)含量呈显著正相关(P<0.05),与SOD活性极显著正相关(P<0.01),与MDA含量呈极显著负相关(P<0.01);SOD活性与MDA含量呈显著负相关(P<0.05),与叶绿素(a+b)含量呈显著正相关(P<0.05)。
3 结论与讨论
3.1 植物生长调节剂对扦插生根的影响
使用植物生长调节剂可有效提高难生根树种扦插的生根率[7]。在本试验中,使用植物生长调节剂相较于对照组可以有效缩短插穗不定根形成所需要的时间,提高愈伤率、鲜活率、生根率,且平均根数和平均根长显著优于清水對照组(P<0.05)。
3.2 营养物质含量的变化与扦插生根的关系
可溶性糖和可溶性蛋白都是植物生长必不可少的营养物质,高含量的可溶性蛋白还可以增强植物细胞的渗透调节作用[8-10]。由相关性分析可知,插穗内的可溶性糖和可溶性蛋白含量与生根率均呈极显著正相关,说明营养物质的含量及其在扦插过程中的变化规律与植物的生根效果有着极为密切的关系。经过生长调节剂处理过的插穗可溶性糖含量均比对照要高,说明ABT处理有利于插穗内可溶性糖的积累。特别值得注意得是,处理组插穗可溶性蛋白含量在大部分时间段要小于同期对照,这与杂交鹅掌楸扦插生根过程中可溶性蛋白的变化趋势[11]基本一致,推测这是由于生长调节剂激活了插穗体内的某些蛋白酶,促进了可溶性蛋白的分解,以满足扦插过程中大量的营养消耗[12]。
3.3 相关酶活性的变化与扦插生根的关系
氧化酶广泛存在于绝大部分植物中,对插穗不定根的形成有显著的指示作用[13]。由相关性分析可知,插穗生根率与SOD活性呈显著正相关(P<0.05),并与IAAO活性呈显著负相关。
SOD是保护酶系统的重要组成部分,能有效抑制植物在逆境中体内自由基的形成从而适应逆境存活下来[14]。结果表明,SOD活性在生根过程中先升后降,在扦插初期处理组SOD活性高于对照组,扦插后期则反之,说明在愈伤组织形成阶段ABT较大辐度地提高了插穗内SOD活性以抵御逆境伤害;在不定根表达和伸长阶段处理组已经适应逆境并开始生根,而对照组SOD活性一直高于处理组,还未适应逆境条件,不利于根系的形成。
IAAO是氧化吲哚乙酸(IAA)的专一性酶,而一定浓度的IAA是不定根发生的基础,与不定根的形成有密切关系[15-16]。一般情况下,高活性的IAAO使内源激素IAA水平降低是插穗生根诱导期的特点之一[17],这与在0~14 d,2组插穗内的IAAO活性迅速上升的试验结果具有一致性。在整个过程中处理组中的IAAO活性始终低于对照,这是因为在不定根生长阶段,高水平的IAA可以促进不定根的发生,而IAAO可以氧化IAA,因而对照组相对于处理组而言生根要慢且生根效果较差。
3.4 丙二醛和叶绿素含量的变化与扦插生根的关系
MDA是脂膜过氧化的主要产物,过多的MDA将会加剧细胞膜的损伤和植物的衰老,直至死亡。通过相关性分析可知,生根率与MDA含量呈显著负相关(P
植物叶片能够产生大量生根所需要的营养物质和激素,并且其也是叶绿素的载体[19]。通过相关性分析可知,叶绿素含量与生根率呈极显著正相关(P<0.01),说明植株光合作用的强弱与插穗的生根率密切相关。在扦插前期,叶绿素含量不断下降,但是经过生长调节剂ABT处理,插穗的叶绿素含量下降幅度要小于对照组,说明生长调节剂的使用可以减缓叶绿素的降解,提高光合作用效率,使插穗合成更多形成不定根所需的营养物质。
3.5 插穗内各生理指标之间的关系
本研究发现,短序润楠扦插过程中插穗内各生理指标之间相关性十分密切,大多数指标之间呈极显著相关或显著相关,说明在短序润楠插穗的生根过程中,各生理指标并不是单独地起作用,而是相互影响。
参考文献:
[1]戴 磊,冯志坚,李文峰. 4种润楠属植物精油成分分析[J]. 福建林业科技,2013,40(1):49-51.
[2]杨丽洲,冯志坚,周 兵,等. 不同处理方法对短序润楠种子发芽的影响[J]. 广东林业科技,2010,26(3):55-58.
[3]徐 茵,袁 森,卢艺菲,等. 植物生长调节剂对短序润楠嫩枝扦插生根的影响[J]. 浙江林业科技,2017,37(5):69-73.
[4]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[5]张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 4版.北京:高等教育出版社,2009.
[6]张宪政,陈凤玉,王荣富. 植物生理学实验技术[M]. 沈阳:辽宁科学技术出版社,1994.
[7]Henrique A,Carnpinhos E N,Ono E O,et al. Effect of plant growth regulators in the rooting of Pinus cuttings[J]. Brazilian Archives of Biology and Technology,2006,49(2):189-196.
[8]Claussen W. Proline as a measure of stress in tomato plants[J]. Plant Science,2005,168(1):241-248.
[9]Cordeiro Y E M,Pinheiro H A,dos Santos Filho B G,et al. Physiological and morphological responses of young mahogany (Swietenia macrophylla King) plants to drought[J]. Forest Ecology and Management,2009,258(7):1449-1455.
[10]Johari-Pireivatlou M. Effect of soil water stress on yield and proline content of four wheat lines[J]. African Journal of Biotechnology,2010,9(1):36-40.
[11]郭 鑫. 杂交鹅掌楸硬枝扦插繁殖技术与生根机理研究[D]. 南京:南京林业大学,2011.
[12]崔凯荣,邢更生,周功克,等. 植物激素对体细胞胚胎发生的诱导与调节[J]. 遗传,2000,22(5):349-354.
[13]Li S W,Xue L G,Xu S J,et al. Mediators,genes and signaling in adventitious rooting[J]. Botanical Review,2009,75(2):230-247.
[14]刘文化. 三种园林植物抗寒性及扦插繁殖研究[D]. 哈尔滨:东北林业大学,2010.
[15]曹帮华,扈红军,张大鹏,等. 桑树硬枝扦插生根能力及其生根关联酶活性的研究[J]. 蚕业科学,2008,34(1):96-100.
[16]王新建,何 威,张秋娟,等. 豫楸1号扦插生根过程中营养物质含量及氧化酶类活性的变化[J]. 林业科学,2009,45(4):156-161.
[17]张金浩. 裸花紫珠扦插繁殖技术及生根机理研究[D]. 北京:中国林业科学研究院,2014.
[18]王顺财. 楸树嫩枝扦插繁殖技术及其生根机理研究[D]. 南京:南京林业大学,2007.
[19]徐振华,王学勇,李敬川,等. 试管苗瓶外生根的研究进展[J]. 中国农学通报,2002,18(4):84-86,89.
