乙型肝炎病毒核酸实时荧光PCR超敏检测方法的建立与评价
2019-09-23夏乔廖丽丽董志强杨鸿辉蒋析文
夏乔 廖丽丽 董志强 杨鸿辉 蒋析文
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球发病率最高的传染病之一[1],全球的乙肝患者多达3.5~4 亿。我国是乙肝高发国,约有9 300 万左右的乙肝病毒携带者,约占我国总人口数的8%~10%[2]。目前,临床上主要使用抗体、抗原和核酸联合检测的方法对乙型肝炎患者进行诊断和治疗管理[3]。其中HBV DNA 载量的检测在HBV感染的早期诊治,判断疾病活动性、制定抗病毒治疗方案、疗效检测以及判断治疗终点中均起着至关重要的作用[4]。我国发布的慢性乙型肝炎防治指南推荐使用高敏检测方法检测HBV DNA 载量,亚太肝病研究学会和欧洲肝病研究学会均明确要求检测方法的灵敏度应达到10~15 IU/mL,高灵敏度检测方法能够确诊低病毒载量的乙肝患者和抗病毒治疗过程中的病毒清除速率,也有助于发现隐匿性乙肝感染[5-6]。因此,建立一种灵敏度高、特异性强的HBV DNA 检测方法,对临床上乙型肝炎的预防和控制具有重要的应用价值和社会意义。
1 材料与方法
1.1 试验材料
1.1.1 标准品或参考品
乙肝标准品和国家参考品购自中国食品药品检定研究院;乙肝分型参考品HBV Worldwide AccuSetTMPerformance Panel 购自美国Sera Care Life Science 公司。
1.1.2 临床样本
样本收集自昆明市第三人民医院完成日常检测项目后的剩余样本。使用无菌注射器进行采集后,收集于无菌离心管中,室温放置不超过4 h,待样本自行析出血清,完成检测后的剩余样本保存在-20℃待测。主要为乙型肝炎患者或其核酸检测阳性样本,HBV DNA 浓度在0~1×109IU/mL 范围内均匀分布。
1.1.3 主要试剂和仪器
引物、探针、热启动Taq DNA 聚合酶、病毒核酸提取或纯化试剂盒和Smart32 核酸提取仪均由中山大学达安基因股份有限公司提供;UDG 酶、dNTPs 购自Promega 公司;实时荧光定量PCR 仪(ABI Prism 7500)购自美国ABI 公司。
临床评价对比试剂(以下简称某国产获证试剂)灵敏度10 IU/mL,线性范围30~1×109IU/mL。
1.2 试验方法
1.2.1 引物与探针的设计
应用Bioedit 软件对GenBank 中登录的HBV 乙型肝炎病毒的S 区段和C 区段序列进行比对分析,使用Primer 5.0 软件分别在各自的高度保守序列内进行引物和探针设计。S 区段的上游引物HBV SF:5′-GTCCTGGCTATCGCTGGATGTG-3′,下游引物HBV S-R:5′-CCAACAAGAAGATGAGGCATA GCA-3′,探针HBV S-P:5′-CCTCTTCATCCTGCTGCTATGCCT-3′;C 区段的上游引物HBV CF:5′- TTCGCACTCCTCCTGCTT-3′,下游引物HBV C-R:5′-CACCTTATGAGTCCAAGGGA-3′,探针HBV C-P:5′- ACTCCCTCGCCTCGCAGACGAAGGTC-3′。引物和探针均由中山大学达安基因股份有限公司合成。
1.2.2 核酸提取
标准品、参考品和临床样本的核酸提取,均使用中山大学达安基因股份有限公司生产的核酸提取或纯化试剂盒(粤穗械备20170583 号),提取步骤参照试剂盒说明书。
1.2.3 PCR 反应体系与反应条件的优化
荧光定量PCR 反应体系如下:1×PCR Buffer、热启动Taq 酶5 U、UDG 酶5 U、上下游引物(20~30 μM)、探针(2~5 μM),配制成20 μL 的PCR mix,加入40 μL 提取后的HBV DNA 模板,总体积60 μL。反应程序:50℃2 min;95℃15 min;94℃15 s,退火45 s,45 个循环;40℃20 s。退火延伸时检测荧光信号。以收集到HBV 阳性临床样本所提取的核酸为模板,不同退火温度52℃~60℃下进行实时荧光PCR 反应,同时应用矩阵优势法对荧光RT-PCR 体系中探针浓度和引物浓度进行优化,得到实时荧光PCR 的最佳反应条件和反应参数。
1.2.4 定量参考品的制备
选取临床上收集的乙型肝炎病毒阳性血清或血浆,使用中国食品药品检定研究院的乙型肝炎病毒核酸国家标准品对其进行标定。用阴性血清或血浆根据标定浓度将收集的源浆分别稀释到5.0×106,5.0×105,5.0×104,5.0×103IU/mL,制备成定量参考品,检测其相关系数,要求相关系数r2≥0.98。
1.2.5 最低检出限的确定
使用阴性血清或血浆稀释中国食品药品检定研究院的乙型肝炎病毒核酸国家灵敏度参考品到20、10、5、2.5 IU/mL,然后分别检测各浓度阳性检出率,用Origin 的Sigmoidal Fit 的方法拟合成曲线,根据软件给出的曲线公式计算本试剂盒的最低检出限。
1.2.6 最低定量限的确定
使用阴性血清或血浆稀释中国食品药品检定研究院的乙型肝炎病毒核酸国家灵敏度参考品到20 IU/mL,重复20 次实验,计算检测结果浓度对数值与理论对数值的差异,要求所有样本实测值与理论值的对数值差值在± 0.5 Log10IU/mL以内。
1.2.7 线性范围的确认
选取临床上收集的HBV 高值样本(1×109IU/mL 以上),使用本超敏试剂对其进行标定。用小牛血清将标定的源浆10 倍梯度稀释到1×109,1×108,1×107,1×106,1×105,1×104,1×103,1×102,20 IU/mL,计算检测浓度对数值其与理论浓度对数值的相关系数,以确定本试剂盒的线性范围,相关系数r2≥0.98 则合格。
1.2.8 批内和批间精密度检测
将临床上收集的高值混合样本(1×108IU/mL以上)混匀后制备成精密度参考品Hc1(1×108IU/mL 左右),Mc1(1×103IU/mL 左右),Lc1(使用小牛血清稀释HBV 标准品到200 IU/mL),每个参考品重复20 次测试,计算检测浓度对数值的变异系数(CV 值),CV≤5%则批内精密度合格。
将临床上收集的另一份高值混合样本(1×108IU/mL 以上)混匀后制备成精密度参考品Hc2(1×108IU/mL 左右),Mc2(1×103IU/mL 左右),Lc2(使用小牛血清稀释HBV 标准品到200 IU/mL),每个参考品重复5 次实验,每次实验三个参考品各重复4 次测试,计算检测浓度对数值的变异系数,CV≤5%则批间精密度合格。
1.2.9 检测型别的确认
将购自美国Sera Care Life Science 公司的乙肝分型参考品HBV Worldwide AccuSetTM Performance Panel(包含A、B、C、D、E、F、H,7 种型别)使用小牛血清稀释100 倍后进行检测,确定不同型别的阴阳性。
1.2.10 准确度的确定
使用HBV 国家参考品中的阳性参考品P1-P9,阴性参考品N1-N8,检测其阴阳性,确定本试剂盒的准确度。
1.2.11 临床样本评估试验
收集自昆明市第三人民医院完成日常检测项目后的195 例剩余样本。分别使用本研究的超敏试剂和某国产获证试剂进行平行检测,操作方法参照试剂盒说明书。
1.3 统计分析
使用Microsoft Excel 2010 对数据进行整理,通过SPSS 19.0 软件和Bland-Altman 模型分析两组数据的阴阳性符合率及检测结果的相关性和一致性,统计结果使用Medcalc 软件进行绘制两种方法差值对均值的散点图,并用Medcalc 软件的Passing-Bablok 回归法作两种检测结果的散点线性回归分析,用回归分析验证两种试剂结果的一致性。
2 结果
2.1 PCR 反应体系与反应条件的优化
以收集到HBV 阳性临床样本所提取的核酸为模板进行荧光PCR 扩增,经矩阵法优化筛选,以获得最佳引物和探针浓度。引物探针的最佳浓度为:S 基因上下游引物25 μM,探针3 μM,C 基因上下游引物25 μM、探针2 μM,总体系60 μL。最佳扩增条件确定为:50℃2 min,95℃15 min;94℃15 s,55℃45 s,45 个循环;40℃20 s。退火延伸时收集荧光信号。
2.2 定量参考品的制备
选取临床上收集的乙型肝炎病毒阳性血浆,用HBV 国家标准品对其进行标定后,使用阴性血浆根据标定浓度将其分别稀释到5.0×106,5.0×105,5.0×104,5.0×103IU/mL,制备成定量参考品,检测结果见图1所示,标准曲线相关系数r2=0.999,斜率slope=-3.328。
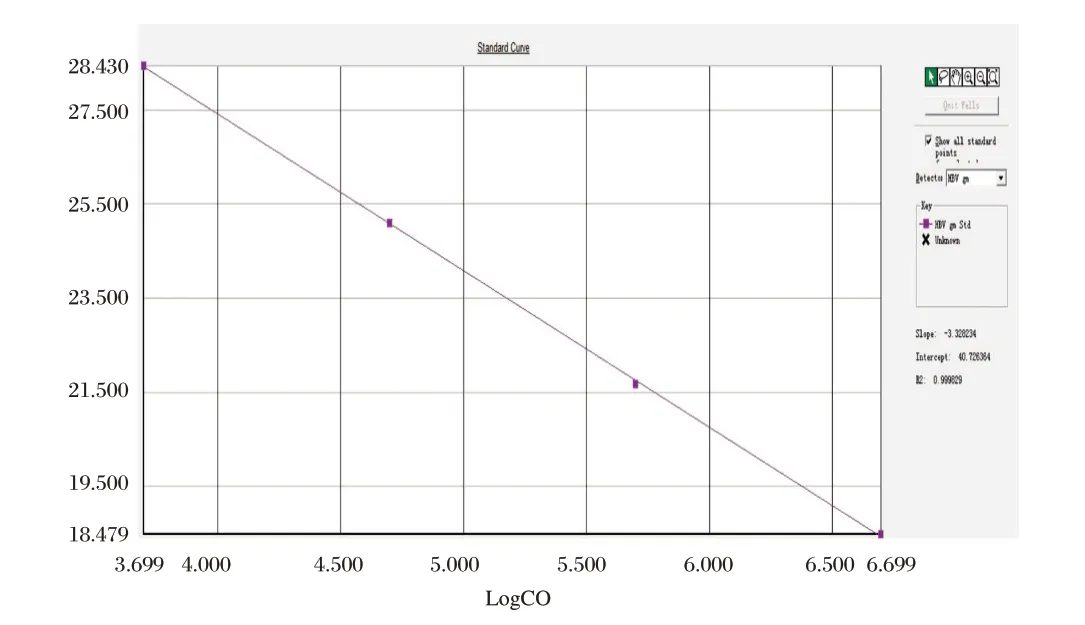
图1 定量标准品扩增结果Figure 1 The results of quantitative standard amplification linear curve
2.3 最低检出限的确定
使用小牛血清稀释中国食品药品检定研究院的乙型肝炎病毒核酸国家灵敏度参考品到20、10、5、2.5 IU/mL,分别检测各浓度阳性检出率,见表1。用Origin 的Sigmoidal Fit 的方法拟合成曲线,根据软件给出的曲线公式计算本试剂盒的最低检出限,见图2。确定本试剂盒的灵敏度为10 IU/mL。
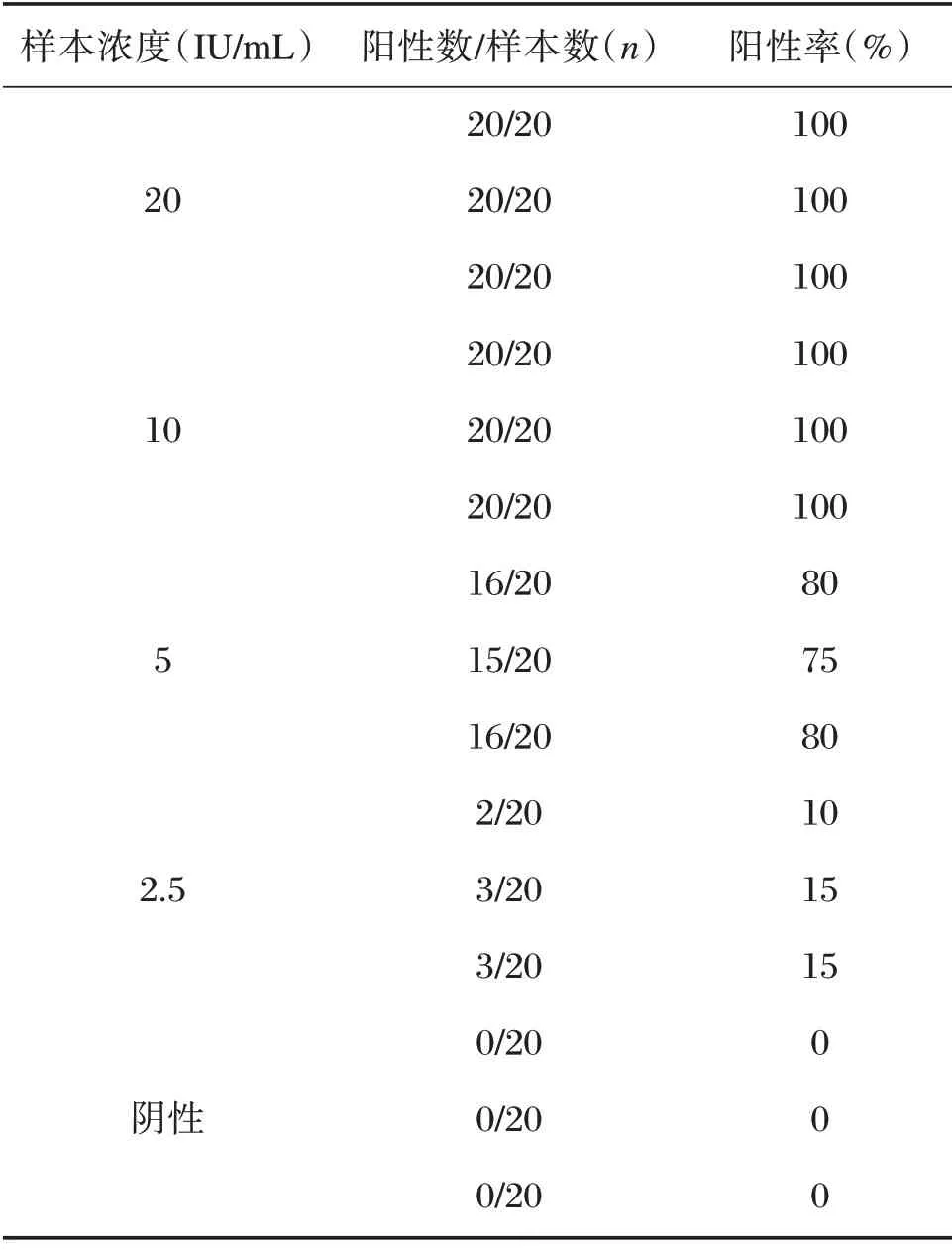
表1 HBV 灵敏度的确定试验检测结果[n(%)]Table 1 The results of sensitivity determination test[n(%)]
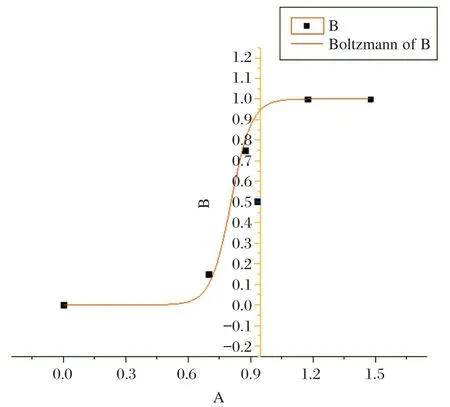
图2 HBV 灵敏度的确定试验曲线拟合结果Figure 2 Sensitivity determination test curve fitting result
2.4 最低定量限的确认
使用小牛血清稀释HBV 国家参考品中的灵敏度参考品到20 IU/mL,重复20 个测试,定量结果对数值在(1.3±0.5)Log10IU/mL 范围内,检测结果平均值为15.41 IU/mL,确定本试剂盒的最低定量限为20 IU/mL,见图3。

图3 最低定量检测限的确定扩增曲线Figure 3 Determination of the minimum quantitative detection limit
2.5 线性范围的确认
选取临床上收集的HBV 高值样本(1×109IU/mL 以上),使用本超敏试剂对其进行标定后,使用小牛血清将其10 倍梯度稀释到1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、20 IU/mL,检测结果的对数值分别为8.817、7.874、6.977、5.812、4.973、3.881、2.597、2.110、1.424 Log10IU/mL。检测浓度对数值其与理论浓度对数值的相关系数r2=0.994,确定本试剂盒的可测定线性范围为20~1×109IU/mL,见图4。
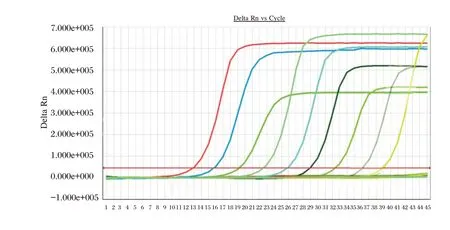
图4 高值临床样本10 倍梯度稀释线性范围扩增曲线Figure 4 Linear range amplification curve of 10-fold gradient dilution for clinical samples
2.6 批内与批间精密度的确定
将三个批内精密度参考品(Hc1,Mc1,Lc1)各重复20 个测试,检测结果对数值的CV 值分别为0.88%,2.53%和3.86%,见图5、图6、图7。批内重复性良好。
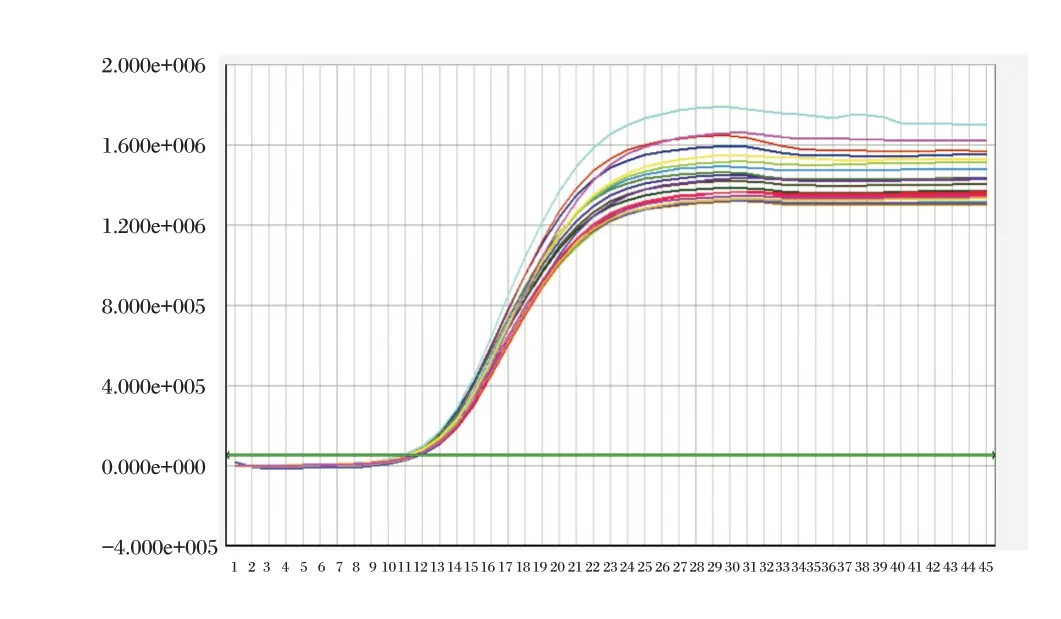
图5 批内精密度样本Hc1 扩增曲线Figure 5 Intra-assay precision amplification curve of Hc1 sample
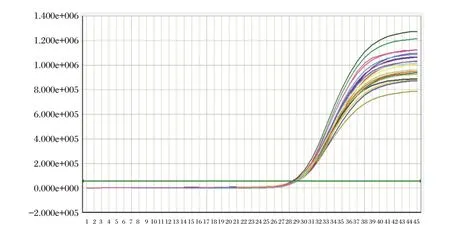
图6 批内精密度样本Mc1 扩增曲线Figure 6 Intra-assay precision amplification curve of Mc1 sample
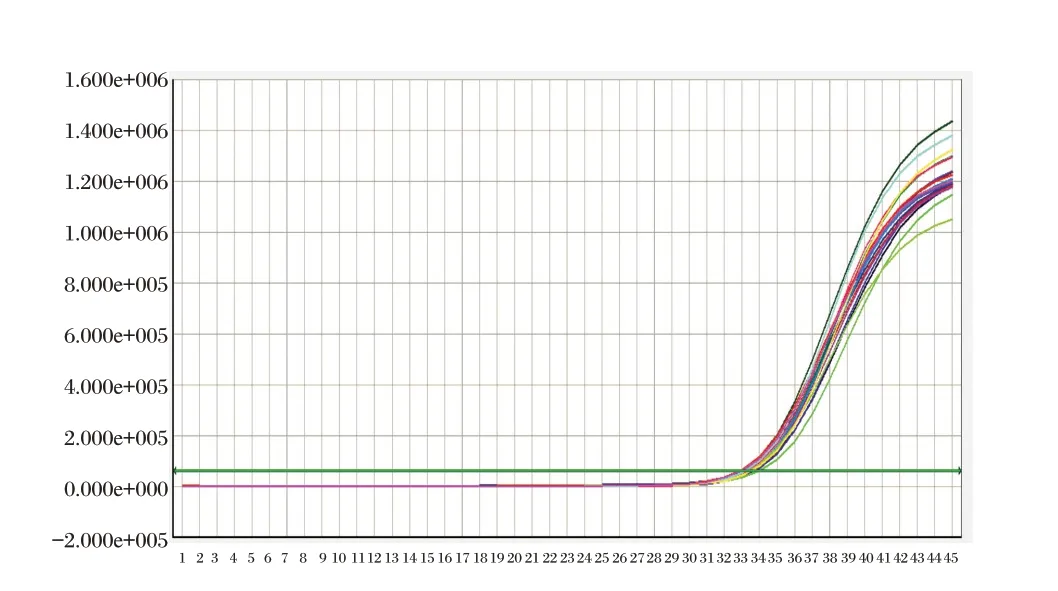
图7 批内精密度样本Lc1 扩增曲线Figure 7 Intra-assay precision amplification curve of Lc1 sample
将3 个批间精密度参考品(Hc2,Mc2,Lc2)重复5 次实验,每次实验3 个参考品各重复4 个测试,每个参考品检测浓度对数值的CV 值分别为2.10%,3.70%和4.22%,批间重复性良好,见表2。
2.7 不同基因型的覆盖
将乙肝分型参考品HBV Worldwide Accu-SetTM Performance Panel 中的7 种基因型参考品用小牛血清稀释100 倍后使用超敏试剂进行检测,A、B、C、D、E、F、H,7 种亚型检测结果全部为阳性。
2.8 准确度的确认
使用超敏试剂检测HBV 国家参考品中的9 份阳性参考品检测结果全为阳性;8 份阴性参考品全部为阴性,见表3。本研究的超敏试剂的准确度为100%。
2.9 临床样本评估试验
使用超敏试剂与某国产获证试剂平行检测临床收集的195 例样本,其中,超敏试剂检测出183 例阳性、12 例阴性;某国产获证试剂检测183例阳性、12 例阴性。两者阴阳性不符合样本数2例。与某国产获证试剂相比,超敏试剂检测结果的阳性符合率为99.45%,阴性符合率为91.67%,总符合率为98.97%。Kappa 检验一致性分析结果显示,Kappa 值为0.911 2(P<0.05),一致性较好,见表4。
对符合2 个检测试剂线性范围内168 例样本的检测结果取对数后进行相关性分析,相关系数r=0.979 1,P<0.000 1,表明两者具有很强的相关性(图9)。定值差异分析结果显示,超敏试剂与某国产获证试剂定量值差值的平均值为0.256 Log10IU/mL,95%界值为(-0.665~1.177)Log10IU/mL。95%(161/168)的样本检测结果在95%可信区间内,表明本研究的超敏试剂与某国产获证试剂具有较高的一致性,见图8。
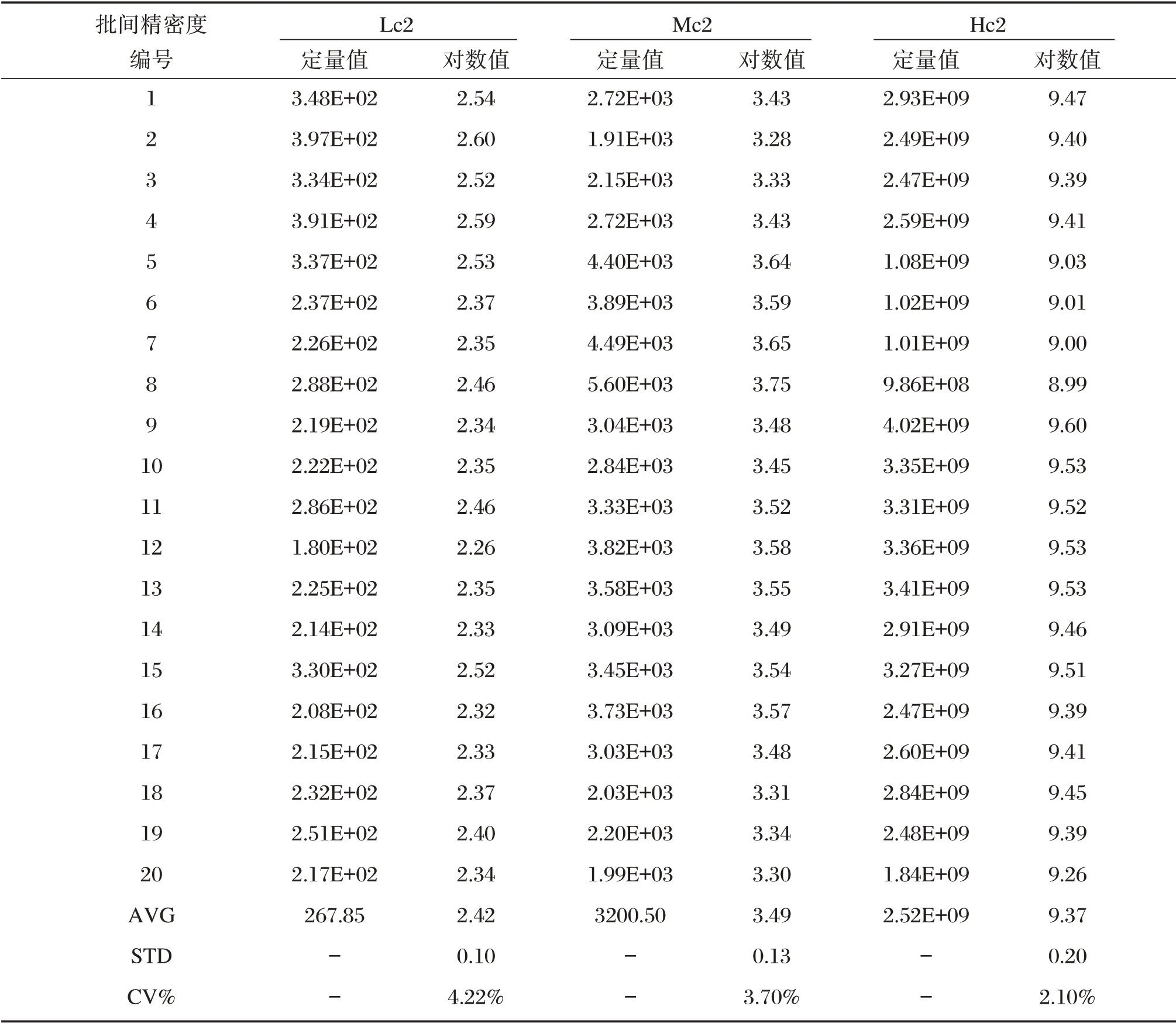
表2 批间精密度检测结果及变异系数Table 2 Inter-assay precision test results and coefficient of variation

表3 HBV 国家参考品检测结果Table 3 HBV national reference test results
3 讨论
本研究在GeneBank 上进行序列对比,在HBV 基因组的S 区和C 区两个高度保守的区域,分别设计一对特异性的引物和探针,应用Taqman 荧光PCR 技术建立了一种HBV DNA 超敏检测的方法,与其他国产试剂的单靶标设计相比,本研究的双靶标设计能有效防止因基因突变导致的漏检,同时加入内标设计,防止假阴性结果的出现。与此同时,本研究还采用了达安独有的Dprobe 探针技术,与普通的Taq-man 探针技术相比,Dprobe 探针的本底信号更低,信噪比更高,能有效提高试剂盒的检测灵敏度。本研究的超敏试剂的灵敏度达到10 IU/mL,线性范围20~2×108IU/mL,批内和批间精密度变异系数在5%以内,检测型别包含A、B、C、D、E、F、H,其检测灵敏度等性能指标已经达到国际同类试剂盒水平。本研究还收集了195 临床样本对其临床应用进行评价,与某国产获证试剂相比,超敏试剂的阳性符合率为99.45%,阴性符合率为91.67%,总符合率为98.97%,Kappa 检验一致性分析表明,超敏试剂与某国产获证试剂检测结果一致性较好(Kappa 值为0.911 2,P<0.05,95%置信区间为0.789 1~1.033 3)。相关性分析结果显示,本方法与某国产获证试剂具有显著相关性(相关系数r=0.979 1,回归方程:Y=0.903 6X+0.226 0)。
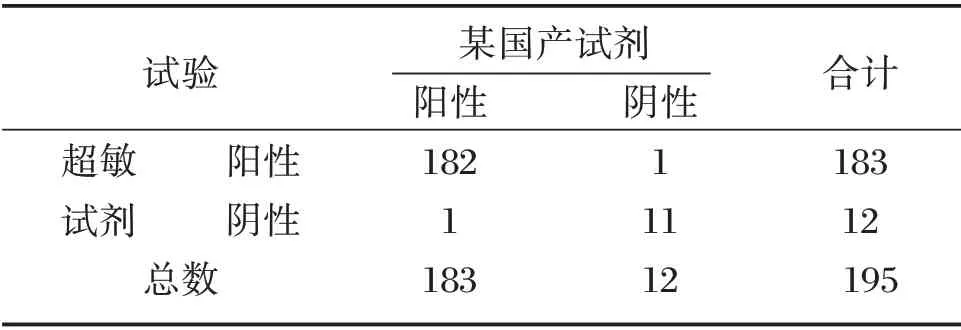
表4 超敏试剂与某国产获证试剂的临床样本评估试验结果Table 4 Evaluation of clinical samples of hypersensitive reagents and a domestic certified reagent
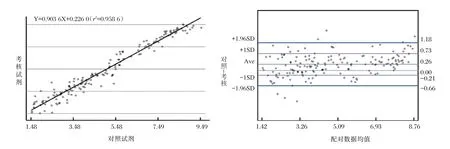
图8 超敏试剂与某国产获证试剂相关性和一致性分析结果Figure 8 Correlation and consistency analysis results of hypersensitive reagents and a domestic certified reagent
以上结果表明,本研究成功建立了一种HBV高敏检测的方法,其性能指标达到国际先进水平,具有很高临床使用价值。
虽然HBV-DNA 和/或HBsAg 是评价病毒复制的金标准,也是乙型肝炎患者安全停药的重要指标[7]。在抗病毒治疗过程中,由于核苷(酸)类药物[nucleot(s)ide analogues,NUCs]不能清除共价闭合环状DNA(cccDNA)[8],因此很难实现慢性乙肝的临床治愈,而且患者停药后往往发生病毒学反弹和疾病复发。北京大学医学部基础医学院病原生物学系鲁凤民团队成功研制出国内首个血清HBV RNA 荧光定量(TaqMan 探针法)检测试 剂[9],将cccDNA 产生的基 因 组RNA 前体(pgRNA)作为新的检测靶点,用于评估肝细胞内HBV cccDNA 的存在和转录活性,作为抗病毒治疗疗效判定及停药复发风险预判的新指标。
未来,以HBV DNA 和HBV RNA 联合检测的方法,将可能成为临床乙型肝炎诊断和治疗的新模式,为我国消灭乙型肝炎病毒及提升我国乙型肝炎的诊断水平做出重大贡献。
