响应面法优化酸酶结合法水解牡蛎肽工艺
2019-09-23杨留明吕春霞张登科雷梦捷冯群力张建芳
杨留明,吕春霞,张登科,雷梦捷,杨 华,*,冯群力,张建芳
(1.浙江万里学院生物与环境学院,浙江宁波 315100; 2.宁波博丰生物科技有限公司,浙江宁波 315600)
牡蛎(Ostrea)又名生蚝,是我国主要的经济贝类之一,也是我国四大养殖贝类之一[1],营养价值高,富含蛋白质,低脂,氨基酸含量丰富均衡,包括人体必需的七种氨基酸,含有一定量的多不饱和脂肪酸、维生素、牛磺酸及锌、硒、铁、钙、锰等矿物质,营养价值极高[2-4]。但当前,牡蛎加工集中在粗加工作为出口产品的阶段,产品附加值不高,因此开发牡蛎加工新工艺极其重要。近年来,水解法制备深海生物活性多功能肽逐渐成为研究热点[5],水解液相对分子量小,活性多肽可以不经消化快速被人体吸收,其中牡蛎肽不仅含有丰富的氨基酸、维生素、比例合适的微量元素和牛磺酸[6],而且还含有海洋生物所特有的多种营养成分,以及低聚肽具有较高的生物活性功能[3],具有极大研究价值。
目前,牡蛎肽的制备多采用酶解法,但单酶水解产物不彻底[7],游离氨基酸含量较少;复合酶水解较彻底,游离氨基酸含量较多,且反应条件温和,但是生产成本较高[8]。酸水解具有水解速度快、成本低廉的特点,但是对蛋白质的水解不具有针对性,仅使用酸水解蛋白的报道鲜少。为适当缩短生产周期,降低生产成本,提高水解度和游离氨基酸含量[9],本文使用酸酶结合法提取牡蛎肽,将酸解时间成本低和酶解的水解彻底等优点结合起来,通过单因素结合响应面试验,优化酸酶法水解牡蛎肽工艺,以期达到水解时间短、水解效率高的目的,为牡蛎水解肽产品的开发及生物活性研究提供理论参数。
1 材料与方法
1.1 材料与仪器
新鲜牡蛎 购于宁波路林市场,用冰盒运回实验室;HCl、NaHCO3、NaOH、甲醛、无水硫酸钾、硫酸铜、浓硫酸、甲基红、乙醇、溴甲酚绿、硼酸 纯度≥99.5%,均为分析纯(AR),国药集团化学试剂有限公司;胰蛋白酶,风味蛋白酶 广西南宁庞博生物工程有限公司;牛血清白蛋白 生工生物工程股份有限公司。
HH-420数显恒温搅拌水浴锅 常州智博瑞仪器制造有限公司;THZ-100型恒温摇床 上海一恒科学仪器有限公司;UV-1800PC型紫外可见分光光度计;XR1台式高速冷冻离心机 上海一恒科学仪器有限公司;雷磁PHS-3G pH计 梅特勒-托利多仪器(上海)有限公司;MK3型酶标仪 上海实维实验仪器有限公司;PL2002电子分析天平 梅特勒-托利多仪器(上海)有限公司;Forma-725超低温冰箱 澳柯玛股份有限公司。
1.2 实验方法
1.2.1 牡蛎酶解液制备的工艺流程 新鲜牡蛎→去壳、去内脏、取其肌肉组织→组织捣碎机捣碎→以酸溶液溶解调整料液比1∶5 (m/m)[10]→选择酸种类→调pH→恒温酸解→调pH→加酶(胰蛋白酶与风味蛋白酶的质量比为2∶1[11])→酶解(置于100 r/min恒温摇床内)→沸水浴灭酶15 min→冷却→抽滤→牡蛎酶解液
1.2.2 酸解单因素实验
1.2.2.1 酸解液种类 控制酸解条件为pH5.0、酸解时间5 h、酸解温度50 ℃,所用酸解液种类分别为HCl、柠檬酸[10]和醋酸。随后进行酶解,控制酶解条件为pH7.5、酶解温度60 ℃、酶解时间2 h、酶添加量为0.1%(以牡蛎的重量计),研究酸解液种类对酶解液水解度的影响。
1.2.2.2 酸解pH 控制酸解条件为酸解时间5 h、酸解温度50 ℃、酸解液种类为醋酸,pH分别为2.5、3.5、4.5、5.5和6.5。随后进行酶解,酶解条件同上,研究酸解pH对酶解液水解度的影响。
1.2.2.3 酸解时间 控制酸解条件为pH4.5、酸解温度50 ℃、酸解液种类为醋酸,酸解时间分别为1、2、3、4、5 h。随后进行酶解,酶解条件同上,研究酸解时间对酶解液水解度的影响。
1.2.2.4 酸解温度 控制酸解条件为pH4.5、酸解时间5 h、酸解液种类为醋酸,酸解温度分别为20、30、40和50 ℃。随后进行酶解,酶解条件同上,研究酸解温度对酶解液水解度的影响。
1.2.3 酶解单因素实验
1.2.3.1 酶添加量 取45 g牡蛎匀浆,按照最优酸解条件进行酸解后,控制酶解条件为酶解pH7.5、酶解温度60 ℃、酶解时间2 h,酶添加量分别为0.15、0.30、0.45、0.60、0.75 g/kg,研究酶添加量对酶解液水解度的影响。
1.2.3.2 酶解温度 取45 g牡蛎匀浆,按照最优酸解条件进行酸解后,控制酶解条件为酶解pH7.5、酶解时间2 h、酶添加量为0.45 g/kg,酶解温度分别为30、40、50、60、70 ℃,研究酶解温度对酶解液水解度的影响。
1.2.3.3 酶解时间 取45 g牡蛎匀浆,按照最优酸解条件进行酸解后,控制酶解条件为酶解pH7.5、酶解温度60 ℃、酶添加量为0.45 g/kg,酶解时间分别为1、2、3、4、5 h,研究酶解时间对酶解液水解度的影响。
1.2.3.4 酶解pH 取45 g牡蛎匀浆,按照最优酸解条件进行酸解后,控制酶解条件为酶解温度60 ℃、酶添加量为0.45 g/kg、酶解时间5 h,酶解pH分别为7、8、9、10、11,研究酶解pH对酶解液的水解度的影响。
1.2.4 Box-Behnken实验设计 在酸解液为醋酸、酸解pH4.5、酸解温度50 ℃、酸解5 h条件下进行酸解,后在酶添加量为0.75 g/kg的条件下,优化酸酶水解牡蛎肽的最佳工艺条件。在单因素实验基础上,以酶解pH、酶解时间、酶解温度为因素,水解度为响应值,进行3因素3水平的Box-Behnken中心组合试验设计,优化试验条件与水平表见表1。
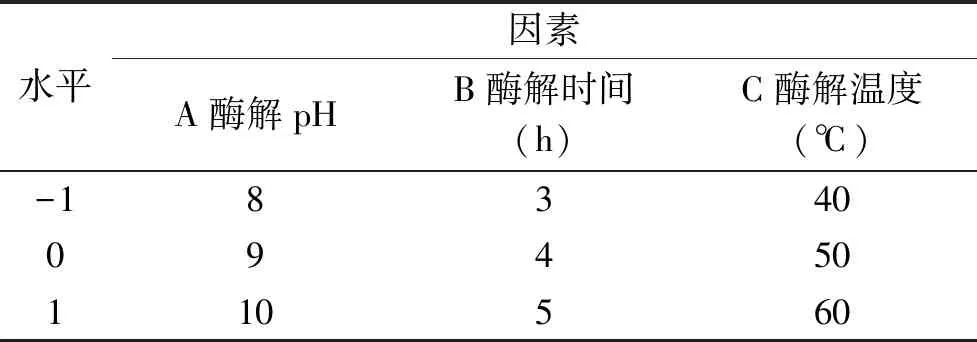
表1 响应面试验因素与水平表Table 1 Factors and levelsTable of response surface experiment
1.2.5 水解度测定 用中性甲醛滴定法[12]和凯氏定氮法[13]分别测定水解液中游离氨态氮含量和原料的总氮含量,并按照下式计算水解度:

1.2.5.1 中性甲醛滴定法 准确移取酸酶解液5.0 mL,置于100 mL容量瓶中,定容。混匀后吸取20.00 mL置于200 mL烧杯中,加水60 mL,插入酸度计的指示电极和参比电极,开动磁力搅拌器,用0.05 mol/L NaOH标准溶液滴定至酸度计指示pH8.2,此时,向溶液中加入甲醛溶液10 mL,混匀。继续用0.05 mol/L NaOH标准溶液滴定至pH9.2,记录用去NaOH标准溶液的毫升数V1。
试剂空白试验:取蒸馏水80 mL,插入酸度计的指示电极和参比电极,开动磁力搅拌器,用0.05 mol/L标准溶液滴定至酸度计指示pH8.2,此时,向溶液中加入甲醛溶液10 mL,混匀。继续用0.05 mol/L NaOH标准溶液滴定至pH9.2,记录用去NaOH标准溶液的毫升数V2。根据以下公式计算样品中氨基酸态氮的含量。
式中,ρ:样品中氨基酸态氮的含量(g/100 mL);V1:牡蛎液加入甲醛后消耗NaOH标准溶液的体积(mL);V2:试剂空白实验加入甲醛后消耗NaOH标准溶液的体积(mL);V3:样品稀释液取用(mL);c:NaOH标准溶液的浓度(mol/L);0.014:1 mL 1.000 mol/L NaOH标准溶液相当氮的克数。
1.2.5.2 凯氏定氮法 精确量取酸酶解液15 mL(精确至0.1 mL),小心移入干净的消解管中,加入3.5 g无水硫酸钾和0.5 g硫酸铜,加入20 mL浓硫酸,放入消化管中消化。消化温度一般控制要求以温度梯度设置,以不剧烈爆沸反应为宜,消化时间设置低温端适当短,高温段适当长。将冷凝管下端浸入接收瓶内的液面下(瓶内预先放30 mL 4%硼酸吸收液),将消解管放入蒸馏管位置,按蒸馏仪操作进行蒸馏,加水约50 mL,加80 mL NaOH溶液(必须足量),蒸馏后的接收瓶内再放2滴混合指示剂,蒸馏接收液用0.1 mol/L HCl标准溶液滴定。根据以下公式计算样品含氮量。
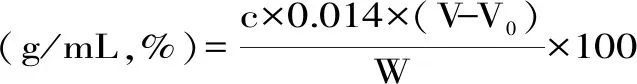
式中,V:滴定消耗盐酸标准溶液的体积(mL);V0:试剂空白试验消耗盐酸标准溶液的体积(ml);c:标准盐酸溶液的物质的量浓度;0.014:氮的毫摩尔质量(g/mmol);W:样品体积。
1.3 数据分析
利用SAS数据处理软件进行差异性显著分析[14],其中P<0.05表示差异显著,P<0.01表示差异极显著;Office Excel 2003软件进行数据处理及绘图,每次试验设计3~5个平行,结果用平均值±标准差来表示。采用Design-Expert 8.0 软件进行响应面试验设计与分析。
2 结果与分析
2.1 酸解条件的单因素实验结果
2.1.1 不同种类酸溶液对水解度的影响 现有研究[15]一般选用盐酸溶液进行酸解,但原料中的脂肪在高温长时间反应下会与HCl反应生成氯丙酸这种致癌物质,且氯丙酸生成后很难去除。而柠檬酸和醋酸较为温和,在食品生产过程中较常用到。并且由于这三种酸的解离度不同,在相同的pH下,每种酸的浓度不同,所以水解效果不同。使用这三种种类的酸溶液对牡蛎进行酸解,不同种类酸解后酶解牡蛎的水解度如图1所示。由图1可知,三种酸溶液最终得到的水解液的水解度皆高于空白对照组(6.6%±0.23%),其中使用醋酸酸解水解度最高,为16.32%±0.56%,其次为盐酸14.24%±0.52%,柠檬酸酸解水解度最低为8.87%±0.34%,说明酸解作为酶解的前处理能有效地提高其水解度,从酸解效果及经济方面考虑,故选择醋酸作为工艺酸解用酸。
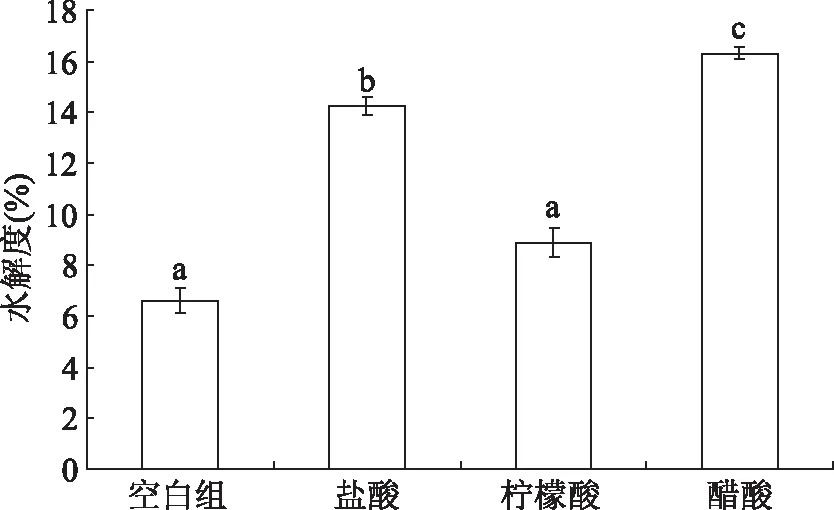
图1 不同种类酸溶液对水解度的影响Fig.1 Effect of different kinds of acid solutions on degree of hydrolysis注:不同字母表示差异显著(P<0.05);图2~图8同。
2.1.2 不同酸解pH对水解度的影响 不同酸解pH酶解牡蛎的水解度如图2所示。由图2可知,随着pH的增加,水解液水解度先上升后下降,在pH为4.5时水解度达到最高值为16.86%±0.34%,且显著(P<0.05)高于其它样品,可能是因为pH过低时,酸解液氢离子含量高,对蛋白质及氨基酸成分破坏比较严重,部分游离氨基氮被破坏,含量降低,影响水解度,pH过高时,酸解效果差[16],导致其水解度不高,故选择pH4.5作为酸解条件。
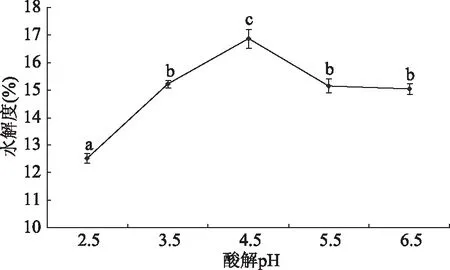
图2 不同酸解pH对水解度的影响Fig.2 Effect of different acidolysis pH on degree of hydrolysis
2.1.3 不同酸解时间对水解度的影响 不同酸解时间酶解牡蛎的水解度如图3所示。由图3可知,随着酸解时间的增加,水解液的水解度呈先上升后下降再上升的趋势,酸解过程中蛋白质先水解成小部分游离氨基酸和部分多肽,致使水解度上升,到达一定程度后,蛋白质主要水解成多肽,多肽的生成量远远大于游离氨基酸的生成,使得水解度下降,但是随着时间的增加,酸解过程可能会破坏部分游离的多肽[17],随着酸解时间增加,又能促进水解度的增加,因此从提高水解度为目的,在酸解时间为5 h时水解度为15.42%±0.21%,已显著(P<0.05)高于其它样品,并从实际生产的时间成本和效率上考虑,选择酸解时间为5 h。
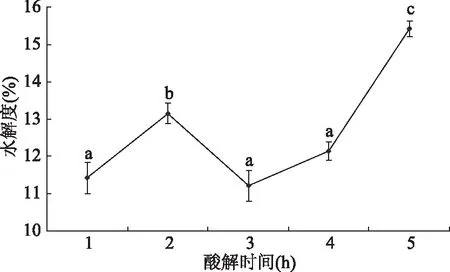
图3 不同酸解时间对水解度的影响Fig.3 Effect of different acid hydrolysis time on hydrolysis degree
2.1.4 不同酸解温度对水解度的影响 不同酸解温度对水解度的影响如图4所示。由图4可知,20~40 ℃之间温度每上升10 ℃,水解度增大约4%,水解度在20、30、40 ℃时分别为6.13%±0.19%、10.22%±0.25%、14.18±0.35;40~50 ℃,水解度上升约2%,50 ℃时水解度达到16.32%±0.24%。可见酶解温度越高,酸解效果越好,酶解液水解度越高,可能是酸解温度越高,酸解液内氢离子运动越激烈,所以水解效果越好,但温度对水解度的影响随着温度的上升趋于平缓,温度为50 ℃时,水解度上升已不显著(P>0.05),考虑到酸解效果及生产成本,选择酸解温度为50 ℃。
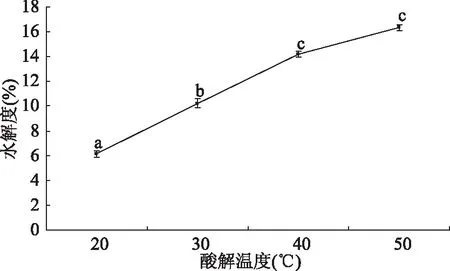
图4 不同酸解温度对水解度的影响Fig.4 Effect of different acidolysis temperatures on degree of hydrolysis
2.2 酶解条件单因素实验结果
2.2.1 不同酶添加量对水解度的影响 蛋白酶用量对牡蛎的水解有着重要影响[5]。由图5可知,随着酶添加量的增加,水解液的水解度越高,添加量由0.15~0.3 g/kg时,酶解液水解度显著增加(P<0.05),但随着酶添加量的进一步增加,酶解液水解度趋于平缓(P>0.05),在酶添加量为0.75 g/kg时达到最高值。这是因为,当水解液中的牡蛎蛋白充足时,酶能快速水解蛋白,使得水解度呈显著上升;由于底物浓度有限,水解到一定程度,即使增大酶用量对于水解度的变化影响较小。故选择酶添加量为0.75 g/kg。
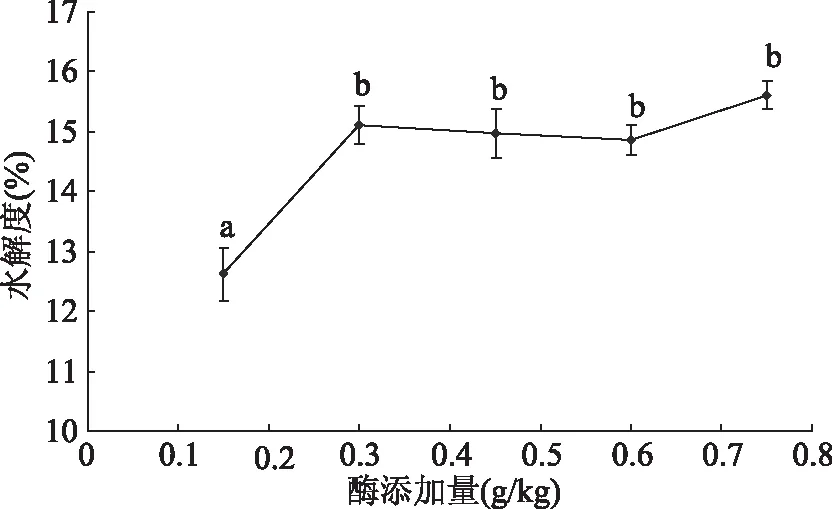
图5 不同酶添加量对水解度的影响Fig.5 Effect of different enzyme additions on hydrolysis degree
2.2.2 不同酶解温度对水解度的影响 结果如图6所示,随着酶解温度的增加,水解液的水解度呈先增加后下降的趋向,但当酶解温度达到60 ℃时,水解度为最高,酶解温度过低酶的活性较低,而温度过高可能会导致酶失活影响其水解度[16]。酶解温度为50、60 ℃时,酶解液水解度显著高于其它温度(P<0.05),酶解温度为70 ℃时,蛋白酶可能已经失活,故选择40、50、60 ℃作为响应面优化水平。
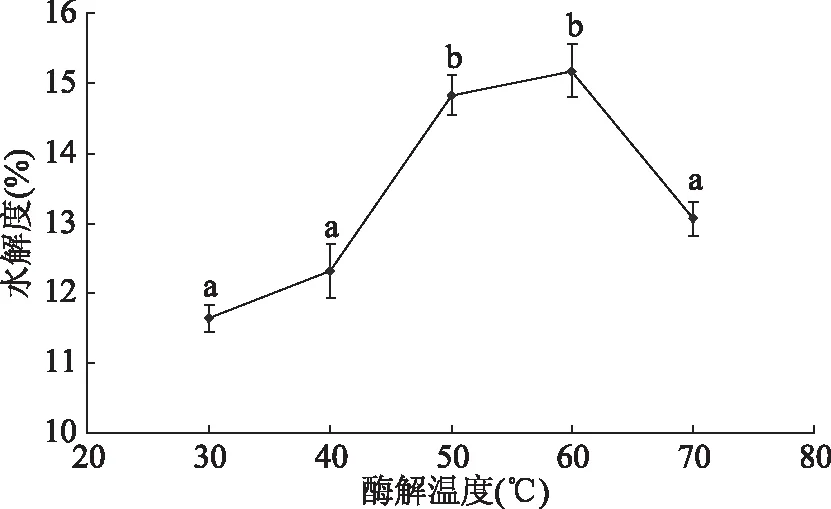
图6 不同酶解温度对水解度的影响Fig.6 Effect of different enzymatic temperatures on degree of hydrolysis
2.2.3 不同酶解时间对水解度的影响 如图7所示,随着酶解时间的增加,水解液的水解度先增加后趋于平缓[17],酶解时间为5 h最高,为15.61%±0.24%。随着酶解时间的延长,在1~3 h内水解液中的蛋白质被快速水解,水解度显著(P<0.05)上升,在3~4 h内水解液中的蛋白质基本上都已被水解,水解度变化不显著(P>0.05),而4 h后水解度基本保持不变,表明蛋白质已充分水解为游离氨基酸和多肽,故选择3、4、5 h作为响应面优化水平。
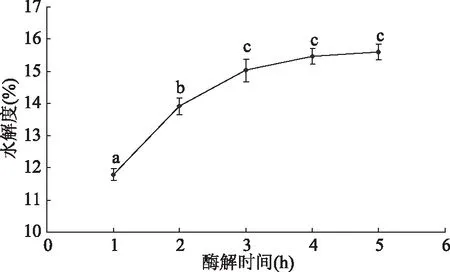
图7 不同酶解时间对水解度的影响Fig.7 Effect of different enzymatic time on degree of hydrolysis
2.2.4 不同酶解pH对水解度的影响 结果如图7所示,随着酶解时间的增加,水解液的水解度先增加后降低,pH为9时,水解度最高为16.32%±0.34%,酶解pH对水解液水解度有显著的影响(P<0.05),pH过高或过低都会影响其酶的活性,选择pH为8、9、10作为响应面优化水平。
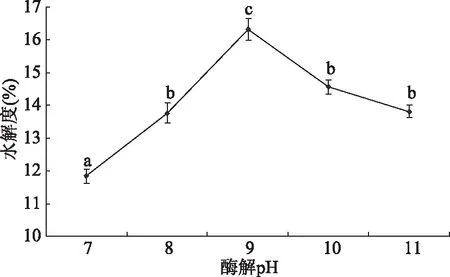
图8 不同酶解pH对水解度的影响Fig.8 Effect of different enzymatic pH on degree of hydrolysis
2.3 响应面试验结果
2.3.1 Box-Benhnken试验设计及结果 为获得最佳酶解工艺,根据Box-Benhnken模型的中心组合试验设计原理,在单因素的实验基础上,进行3因素3水平的响应面试验[18],响应面试验结果见表2。
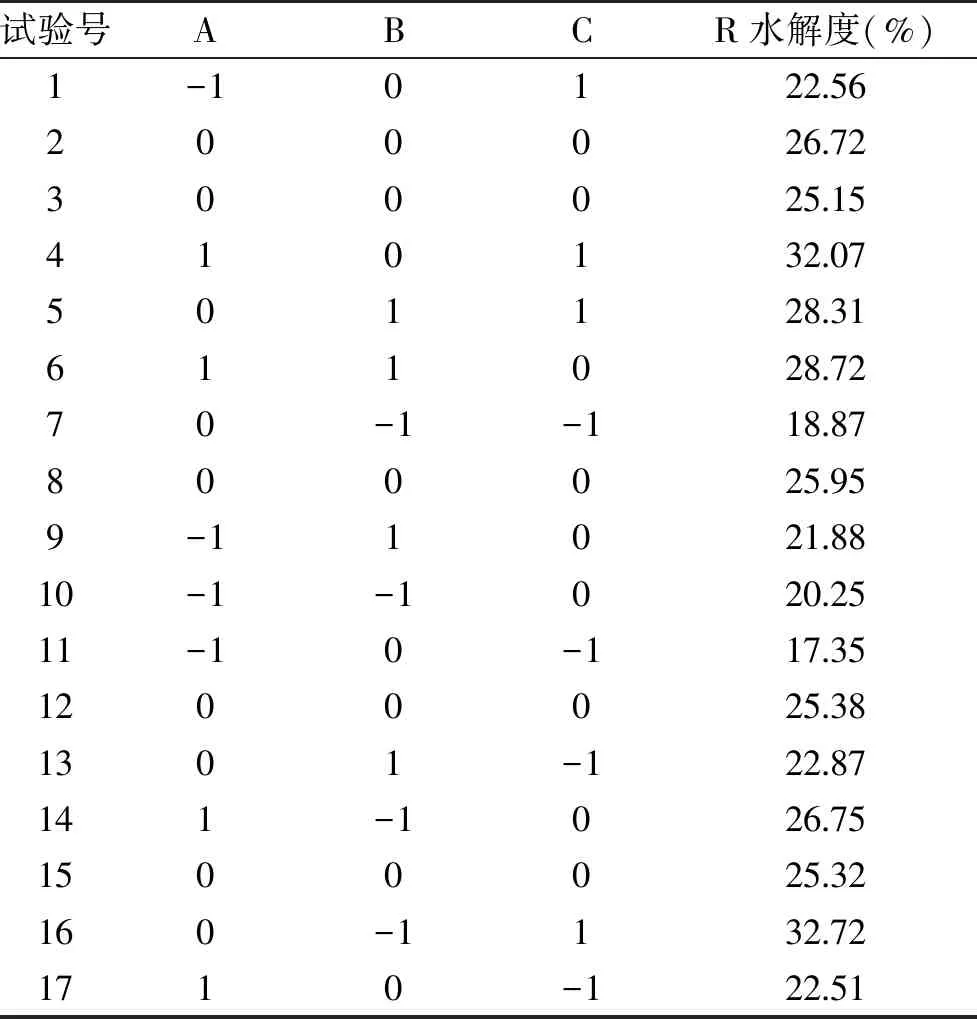
表2 Box-Benhnken试验设计及结果Table 2 Box-Benhnken test design and results
响应面试验设计及结果见表2。运用Design-Expert 8.0软件对各个试验点的响应值进行最小二乘法拟合回归,得到的二次多元回归模型方程为:
R=25.70+3.50A+0.40B+4.26C+0.085A B+1.09AC-2.10BC-1.69A2+0.39B2-0.39C2。
2.3.2 模型方差分析 模型分析结果见表3。由表3可知,回归模型达到极显著(P<0.01),失拟项中P>0.05不显著,说明该模型拟合度较好。一次项(A、C)达到极显著水平(P<0.01),交互项(BC)、二次项(A2)达到极显著水平(P<0.01)。由表3中的结果得出,3种因素A、B、C对酶解液水解度的影响由大到小依次为:酶解温度>酶解pH>酶解时间。
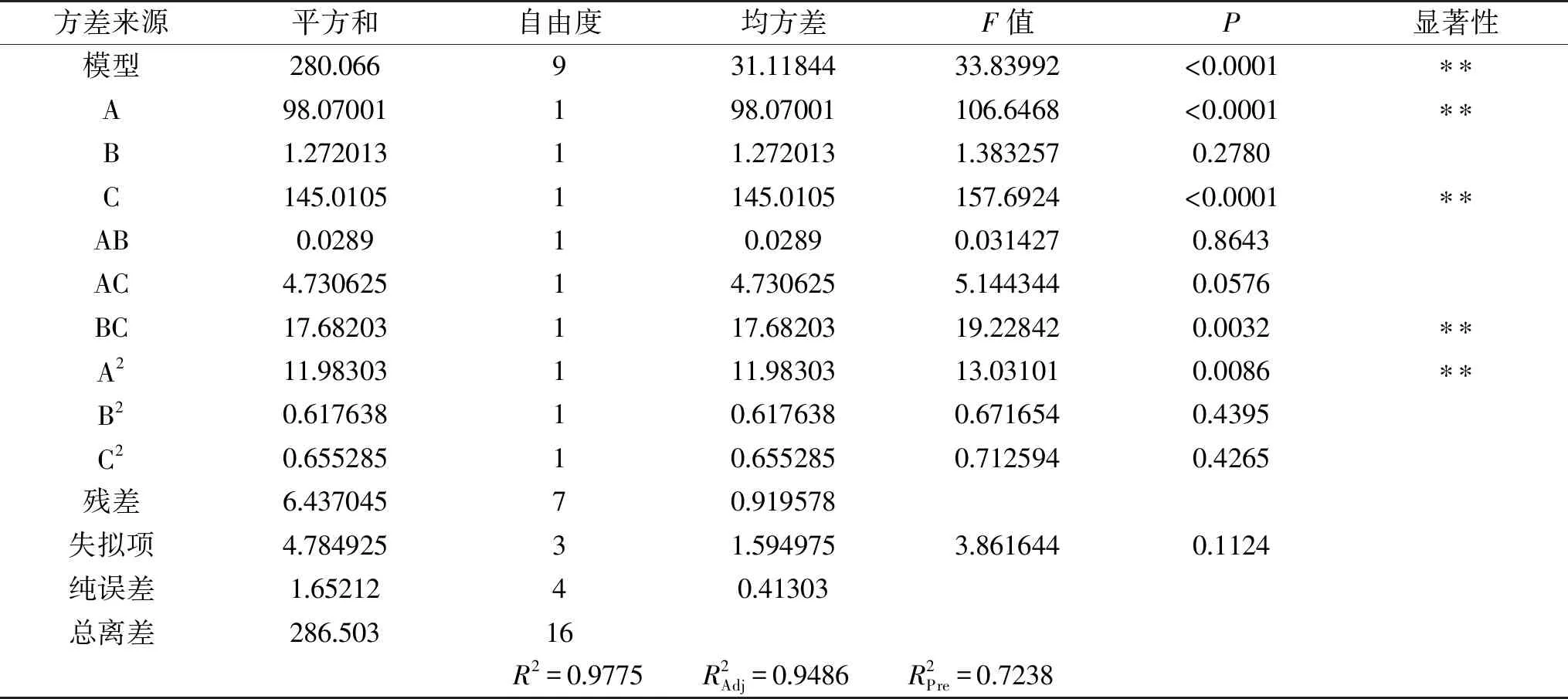
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.3.3 交互作用 图9直接反映了两因素间有相互影响的三维水解度效果图,可以看出两因素对因变量的影响情况,曲面倾斜度越高说明两因素交互作用越显著。其中,因素BC对水解度的影响显著,曲面较弯曲,等高线宽度较大;酶解pH和酶解时间的交互作用、酶解pH和酶解温度的交互作用对水解度的影响不显著(P>0.05),曲面弯曲不明显,等高线宽度较小[18-19]。
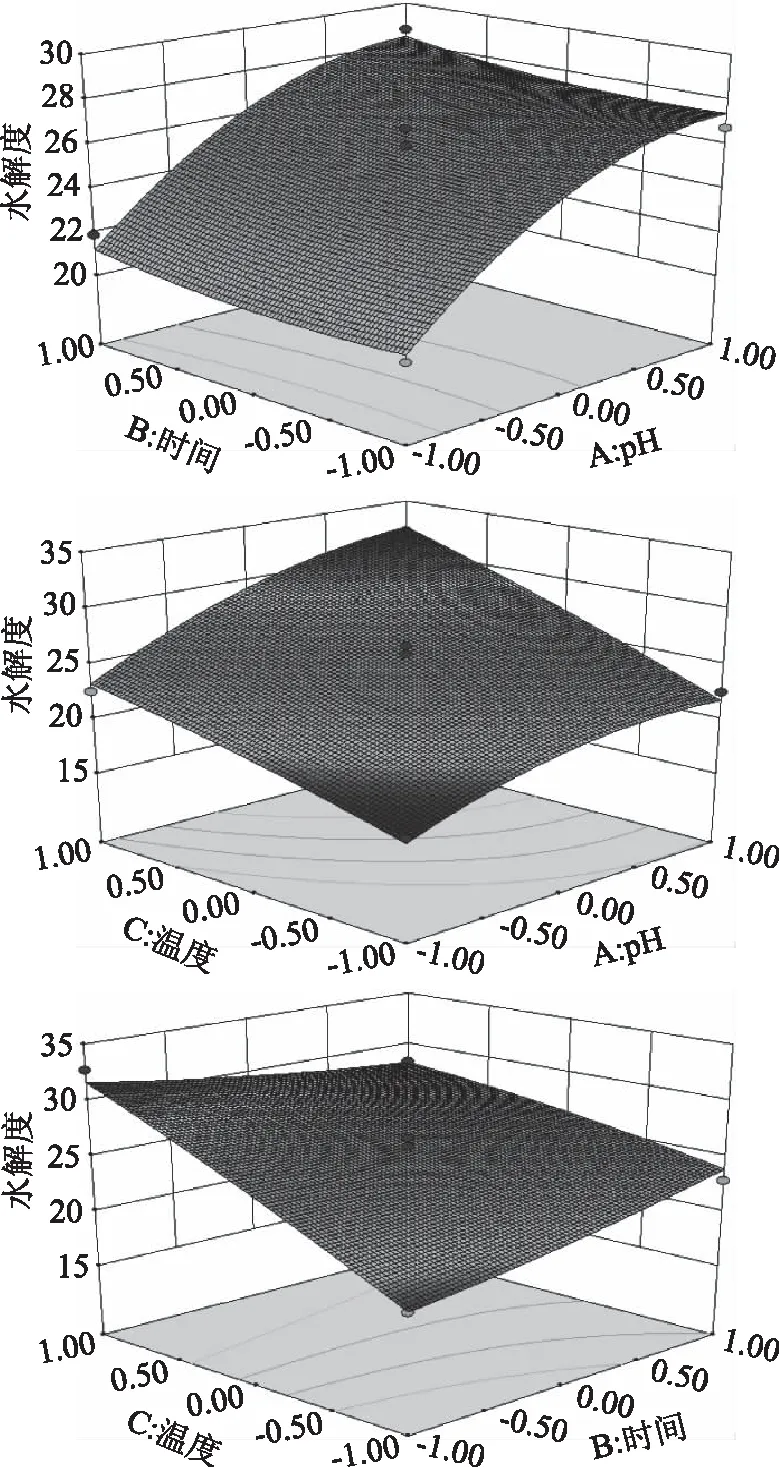
图9 各因素交互作用响应面图Fig.9 Response surface map of interaction of various factors
2.3.4 验证试验 经响应面分析,模型计算得到最佳酶解理论条件为:酶解pH为10、酶解时间为3 h,温度60 ℃,其水解度理论值为34.47%,按最佳酶解理论条件进行试验,测得水解度实际值为36.25%±0.63%,相对误差为1.78±0.63%,相对误差较小,说明模型较为准确,实际值略大于理论值,可能是水解度测得的游离氨基氮包括了蛋白质以外的氮,导致氮含量偏高,最终导致水解度偏高。
3 结论
实验结果表明,以牡蛎为原料,通过酸酶结合水解法生产牡蛎肽的最佳工艺条件为:醋酸酸解、pH4.5、酸解温度50 ℃、酸解5 h后,选择胰蛋白酶与风味蛋白酶(质量比为2∶1)酶解、添加量0.75 g/kg、酶解pH10、酶解时间3 h、酶解温度60 ℃。在此条件下可以有效水解牡蛎,得到水解度为36.25%±0.63%的牡蛎肽,可以有效地提高牡蛎肽产量,降低其生产成本,为开发牡蛎多功能肽提高一定的参考价值,进一步的研究可加强在酶解得到的牡蛎肽的分子量分布及氨基酸组成分析,为其研究牡蛎肽功能性质提供参考。牡蛎酶解液中氨基酸种类齐全,其产品开发前景较好[20],所以在提高牡蛎肽得率的基础上,需在牡蛎肽的功能性探究及相关产品开发上进一步加强研究[21]。
