木薯水解液为原料静置发酵制备细菌纤维素的研究
2019-09-23张沙沙吴冬阳沙如意毛建卫
张沙沙,蔡 威,吴冬阳,崔 斌,沙如意,毛建卫
(浙江科技学院生物与化学工程学院,浙江省农产品化学与生物 加工技术重点实验室,浙江省农业生物资源生化制造协同中心,浙江杭州 310023)
细菌纤维素(Bacteriacellulose,BC)是由醋酸菌属(Acetobacter)、根瘤菌属(Rhizobium)、土壤杆菌属(Agrobacterium)和八叠球菌属(Sarcina)中的一些特殊微生物所产生的纤维素。目前,已有大量利用葡萄糖酸醋杆菌属菌种生产细菌纤维素的研究报道,目前极少有从葡萄糖酸醋杆菌属中分离出来并被命名为Komagataeibacter属菌种生产细菌纤维素的研究报道。研究利用Komagataeibacter属菌种(如Komagataeibacterxylinus)生产细菌纤维素,可以为细菌纤维素的发酵生产提供更广泛的菌种资源。
相比于其他纤维素,细菌纤维素是一种“纯”纤维素,具有优良的特性,例如高结晶度、高纯度、高持水性等[2]。BC具有广泛应用,在食品行业中,BC被称为椰果(Nata),常用于乳制品和饮料中,具有热量低、口感好、不易被人体消化等特征,可以促进肠道蠕动达到减肥的效果,预防肥胖并发症[3],同时可在肉肠中代替肉类以减少产品的热量[4]。在医药行业中BC具有改善人体消化环境、减少便秘、降低胆固醇、预防癌症等作用,还可以用作医药辅料、人工角膜和人工血管等[5]。在纺织行业中,由于细菌纤维素结构与植物纤维素结构相似,因此细菌纤维素可作为人造纤维材料用于制作衣物等[6]。细菌纤维素在其它领域上的应用也正在研究开发中。
目前BC的发酵碳源大多为葡萄糖,生产成本高,极大限制了细菌纤维素的生产规模。以水果、废弃纤维素、低值淀粉等农副加工副产物为主,通过发酵生产BC为突破口,可以为细菌纤维素的发酵寻找新的研究方向[7]。木薯是一种来源广泛且价格低廉的原料,其主要成分为淀粉,在鲜木薯中淀粉含量大概为25%~30%。因而,木薯是一种较实惠的农作物,相比于葡萄糖而言,更适合用于生产大量细菌纤维素所需要的能源物质。但是,木薯中含有一些其他的营养物质,例如蛋白质、微量元素等,这些物质可能会促进或者抑制细菌产纤维素能力,具体情况还需要进一步的实验验证。本研究主要以木薯全粉为原料,经过预处理、酶解、发酵等制备BC,对影响细菌纤维素产量的影响因素进行研究,同时研究发酵过程中BC的产量与还原糖消耗以及pH的关系,并对BC的结构性质进行分析,旨在为BC的生产提供新的数据支撑[8]。
1 材料与方法
1.1 材料与仪器
Komagataeibacterxylinus实验室红茶菌中分离,并保藏于Genebank数据库(GenBank accession number MK386709);氢氧化钠、冰醋酸 上海阿拉丁生化科技股份有限公司;酵母浸粉 北京奥博星生物技术有限责任公司;葡萄糖 江苏强盛功能化学股份有限公司;无水乙醇 上海凌峰化学试剂有限公司;干燥木薯粉 广西玉林市木薯基地;液化酶、糖化酶(酶活力(U/g)≥100000.0) 杰能科(中国)生物工程有限公司;硫酸镁、磷酸氢二钾、纤维素酶(酶活力(U/g)≥15000.0) 国药集团化学试剂有限公司。
GZX-9140MBE电热鼓风干燥箱 上海博迅实业有限公司;HH-2数显恒温水浴锅 国华电器有限公司;SPX-250B-Z恒温培养箱 上海博迅实业有限公司;JEM-1011透射电镜 日本电子公司;PHS-3CPH计 杭州齐威仪器有限公司;FA2004电子天平 上海舜宇横平科学仪器有限公司;傅立叶变换红外光谱仪 德国布鲁克仪器公司;KQ-500E超声波清洗器 昆山市超声仪器有限公司;Q500-V20.6热重分析仪 美国TA仪器;D8ADVANCE型X射线衍射仪 日本岛津公司;VARIO MICRO元素分析仪 瑞士大昌华嘉集团公司。
1.2 实验方法
1.2.1 木薯水解液制备 称取一定量的木薯粉,烘至恒重,放入烧杯中,木薯粉∶水为1∶30,调pH为6,常温超声30 min;加入1%液化酶95 ℃水浴3 h。反应结束后用HCl调pH为4.0;向液化水解液中加入1%糖化酶和1%纤维素酶,将反应器放入65 ℃恒温水浴锅中,反应72 h。反应完毕后利用NaOH溶液中和水解液至pH=7,抽滤得到滤液后减压蒸馏,用DNS法测定浓缩液的还原糖含量[9]。处理后放入4 ℃冰箱中备用。
1.2.2 培养基配制 种子培养基:葡萄糖1 g,酵母膏1 g,乙醇3.5 mL,pH6,水100 mL。
菌种活化培养基:酵母粉1 g,水100 mL,葡萄糖2 g,蛋白胨1 g。
发酵培养基:酵母粉1 g,乙醇3.5 mL,水100 mL,pH6,木薯水解液若干,MgSO41 g,K2HPO40.1 g。
1.2.3 BC的发酵Komagataeibacterxylinus菌种活化:从-80 ℃冰箱中取出一支菌种置于已灭菌的Komagataeibacterxylinus菌种活化培养基中,30 ℃,160 r/min,摇床培养48 h。将已活化好的菌种按一定的接种量加入已灭菌的发酵培养基中。30 ℃培养箱静置培养,测定发酵过程中BC产量、还原糖含量和pH。
1.2.4 木薯水解液发酵生产BC单因素实验 控制不同的初始pH、木薯水解液添加量、装液量、接种量、温度5个因素,研究其对BC产量的影响。
1.2.4.1 温度对BC产量的影响 将菌种接入到已灭菌好的100 mL含有5%木薯水解液的发酵培养基(初始pH6.0)中,分别放入20、25、30、35、40、45 ℃培养箱培养7 d,测定BC产量。
1.2.4.2 装液量对BC产量的影响 选择50、75、100、125、150 mL已配制好且灭菌过的5%木薯水解液发酵培养基加入到250 mL锥形瓶中,接入5%菌种,初始pH6.0,温度30 ℃,培养7 d,测定BC产量。
1.2.4.3 初始pH对BC产量的影响 调节含有5%木薯水解液发酵培养基(装液量75 mL)的初始pH分别为4、5、6、7、8这5个梯度,接入5%菌种,温度30 ℃,培养7 d,测定BC产量。
1.2.4.4 木薯水解液添加量对BC产量的影响 选择1%、2%、3%、4%、5%、6%添加量的木薯水解液于75 mL发酵培养基中,接入5%菌种,初始pH6,温度30 ℃,培养7 d,测定BC产量。
1.2.4.5 接种量对BC产量的影响 选择3%、6%、9%、12%、15%已活化好的菌种接入已配制好且灭菌过的75 mL含有5%木薯水解液发酵培养基中,初始pH6,温度30 ℃,培养7 d,测定BC产量。
1.2.5 分析方法
1.2.5.1 还原糖含量的测定 分别取葡萄糖标准液(1 mg/mL)0、0.1、0.2、0.3、0.4、0.5、0.6 mL于15 mL试管中,用蒸馏水补足至1.0 mL,分别准确加入DNS试剂1.5 mL,沸水浴加热5 min,冰水浴冷却,用水补足到10 mL,在540 nm波长下测定吸光度,制作还原糖标准曲线。以还原糖含量x(mg/mL)为横坐标,以吸光度y为纵坐标,得到葡萄糖标准曲线,y=1.623x-0.1333,相关系数R2=0.9993。利用DNS试剂测定发酵液中的还原糖含量(g/L)。
1.2.5.2 BC产量的测定 对发酵培养基利用滤纸过滤,将得到的白色凝胶状薄膜产物浸入0.1%的NaOH溶液中煮沸30 min,以洗去其表面残留的菌种,再用去离子水洗去产物表面残留的NaOH溶液,最后再用稀醋酸溶液调pH为中性,65 ℃烘干至恒重,称量得到干重(g),将干重除以相应的装液量得到BC产量(g/L)。
1.2.5.3 pH测定 取5 mL体积的发酵液,利用pH计测定pH。
1.2.6 细菌纤维素的理化表征
1.2.6.1 细菌纤维素含水率的测定 将处理好的细菌纤维膜,拭干膜表面水分后,称重记录为M湿1(g)。然后再将膜放入65 ℃的鼓风干燥箱中至恒重[10],记录重量为M干。
含水率(W1,%)的计算公式如下:
1.2.6.2 细菌纤维素复水率的测定 将已经干燥好的细菌纤维素放入水中24 h,使其充分吸收水分,拭干膜表面的水分后,电子天平称重[10],记录为M湿2。
复水率(W2,%)计算公式如下:
1.2.6.3 元素分析 取细菌纤维素样品研磨成粉末状,并准确称量18~22 mg于锡箔纸中,抽真空干燥后进行C、H、O、N、S的元素分析,计算各元素的含量。
1.2.6.4 红外光谱分析 采用傅里叶变换红外光谱仪(FTIR),将细菌纤维素充分干燥后粉碎,与干燥的KBr粉末充分研磨混合、压片;利用分辨率为4 cm-1,扫描波长范围为400~4000 cm-1进行分析[10]。
1.2.6.5 热重(TGA)分析 将细菌纤维素在鼓风干燥箱中充分干燥至恒重后,磨碎,称量10 mg左右于Al2O3小坩埚中,放入热重分析仪中在空气气氛下检测[3]。升温速度:10 ℃/min;温度范围:50~900 ℃;保护气(空气):150 mL/min。
1.2.6.6 扫描电镜观察 将干燥好的细菌纤维素样品剪成直径为0.1 cm左右的小碎片,再将小碎片置于真空镀膜机中对其表面喷金15 s,喷金后的样品于扫描电镜中5 kV电压下观察其结构[3]。
1.2.6.7 X-射线衍射分析 将细菌纤维素充分干燥后,磨碎,取适量的粉末于样品板上。Cu靶,10 kV高压,管流为50 mA,2θ=5~50 °扫描,得到XRD光谱[11]。
1.3 数据处理
实验组重复数n=3,采用Origin 8.5绘制图表。
2 结果与分析
2.1 木薯水解液生产细菌纤维素单因素探究
木薯水解液经过预处理、酶解等一系列过程,可以作为培养生产细菌纤维素的优质碳源。细菌纤维素在生产期间受到很多环境因素的影响,首先考察培养基的初始pH、温度、接种量、装液量、木薯水解液添加量等对细菌纤维素生产的影响。
2.1.1 温度对BC产量的影响 如图1所示,随着温度的上升,细菌纤维素呈先增加后下降的趋势,在30 ℃时产量达最高值,40 ℃后将不再生产细菌纤维素,因此,细菌纤维素的最适生产温度为30 ℃,这与陈慧慧等[20]的研究结果相一致。
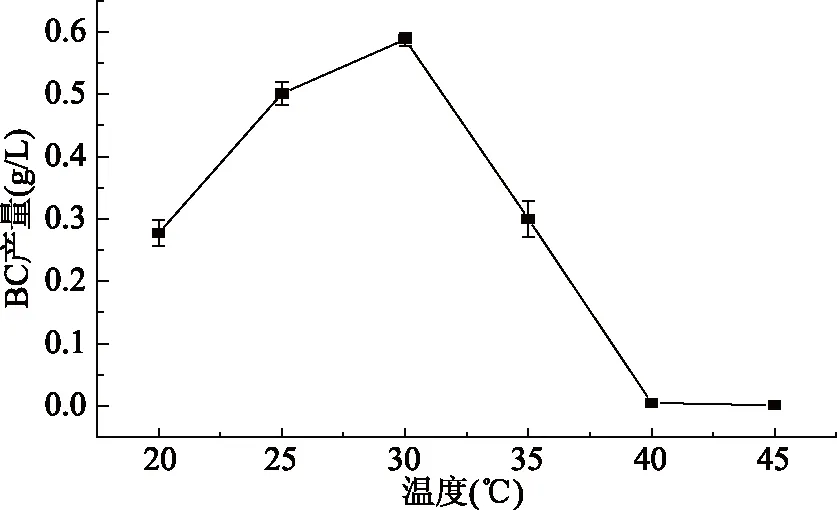
图1 温度对细菌纤维素产量的影响Fig.1 Effect of temperature on bacterial cellulose production
2.1.2 装液量对BC产量的影响 由图2可知,装液量在75 mL时,细菌纤维素的产量最高,综合考虑,其原因是50 mL装液量的总营养物质在发酵过程中被快速消耗完毕导致后期的生产基本停止,75 mL之后随着装液量的增加细菌纤维素的产量下降主要是由于细菌纤维素的生长需要耗氧,培养液体表面积比越大其本身的溶氧量越小,不利于醋酸菌生产细菌纤维素。最优装液量在75 mL,这与周艳等[19]的研究相同。
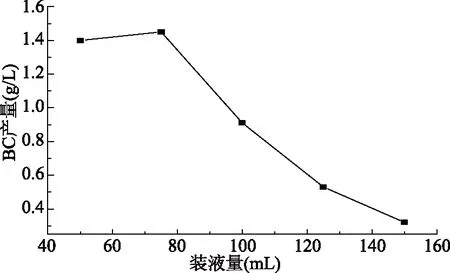
图2 装液量对细菌纤维素产量的影响Fig.2 Effect of fermentationbroth volume on bacterial cellulose production
2.1.3 初始pH对BC产量的影响 从图3中明显得出,在初始pH为6时所得的BC产量最高,BC产量从初始pH为4时随着pH上升而上升,初始pH6以后随着pH的增大而减小,可能是醋酸菌的生长需要微酸性环境且由于自身的生长产生大量的醋酸迫使环境pH下降,过低的pH又会抑制醋酸菌的生命活动,因此在低的初始pH反而不利于细菌纤维素的生长,反之,过高的初始pH也不利于醋酸菌的生长。产细菌纤维素菌种,如木醋杆菌适应于酸性环境生长,但过酸的环境不利于其生长发育从而抑制了细菌纤维素的产生,故最适初始pH在6,这与仲华维等的研究相同[17]。
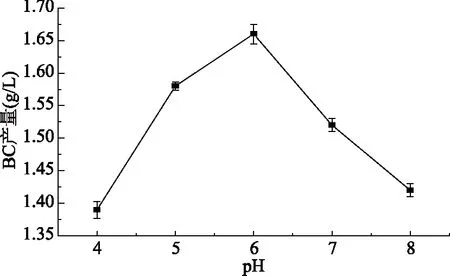
图3 初始pH对细菌纤维素产量的影响Fig.3 Effect of initial pH value on bacterial cellulose production
2.1.4 木薯水解液添加量对BC产量的影响 如图4所示,在5%的木薯水解液添加量下得到的细菌纤维素产量是最高的,随着木薯水解液的添加量的继续上升,细菌纤维素的产量反而下降,主要是因为醋酸菌能够代谢碳源产生乙酸,使发酵培养基的pH下降,抑制了BC的合成,由图可得此种醋酸菌适合在5%的木薯水解液下生产细菌纤维素,较高的水解液不利于BC的生产。细菌纤维素产量随着还原糖浓度的增加呈现先增加后减少的趋势,这是因为还原糖作为细菌生命活动中不可或缺的能源和营养物质,被微生物快速的用于菌体生长进而促进纤维素的生产,但还原糖浓度的增加也会促进酸的生产,过量酸反而抑制了菌体的生长从而限制了细菌纤维素的合成,本实验最适木薯水解糖液浓度为5%,相当于3%葡萄糖量。
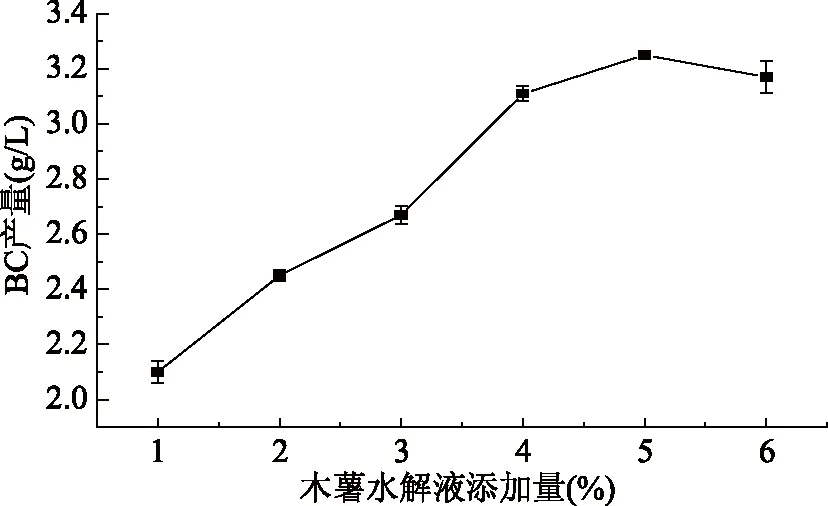
图4 木薯水解液添加量对细菌纤维素产量的影响Fig.4 Effect of cassava hydrolysate addition on bacterial cellulose production
2.1.5 接种量对BC产量的影响 如图5所示,随着接种量的增加,BC产量也在随之增加,但在6%以后的上升较平稳。接种量的大小会影响木醋杆菌的生长、繁殖、代谢的速度,接种量过大,会使得底物在前期过快消耗,不利于后期代谢产物积累;接种量过小,会延长发酵时间,对细菌纤维素的产生带来不利影响,最优菌种添加量为6%,这与杜倩雯等[18]的研究结果相一致。
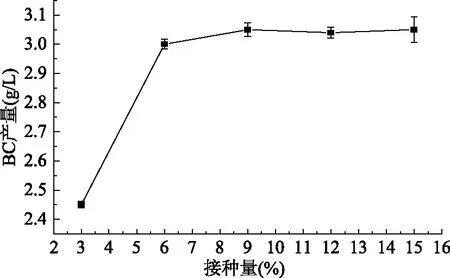
图5 接种量对细菌纤维素产量的影响Fig.5 Effect of inoculum size on bacterial cellulose production
2.2 细菌纤维素发酵动力学研究
如图6所示,发酵过程中随着发酵天数的增加培养液中还原糖含量和pH呈现降低的趋势。相反随着发酵天数的增加BC的产量呈现上升的趋势,在第4~8 d的生长速率最快。在第1~3 d的时候pH下降最快,主要是由于前三天菌种处于增值阶段,在其生长分裂过程中消耗还原糖产生酸导致pH快速下降;在第1、2、3 d主要是细菌的增殖阶段,4、5、6、7、8 d有一个较高的转化率,发酵生产过程中可以利用增加这一阶段的时间从而达到增加产量的目的,在第8 d以后转化率渐渐下降,主要是因为培养液中还原糖的大量消耗,在发酵过程中,可以在第8 d通过加糖液可以维持生产BC。
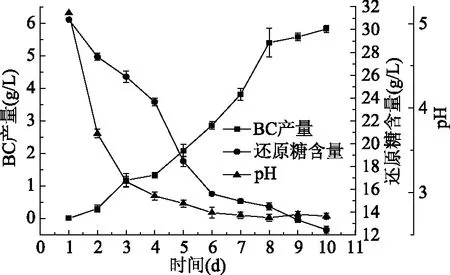
图6 细菌纤维素发酵培养动力学Fig.6 Dynamics of bacterial cellulose production
2.3 木薯水解液生产细菌纤维素发酵过程中含水率与复水率变化
如图7所示,木薯水解液生产细菌纤维素含水率96%~98%,复水率50%~58%。利用以上单因素实验优化后的发酵培养基培养细菌纤维素,在第9 d时的BC产量为5.75 g/L。随着BC产量的上升含水率和复水率也在逐渐增大,主要是由于其内部的网状结构对水分子的锁水能力的加强。
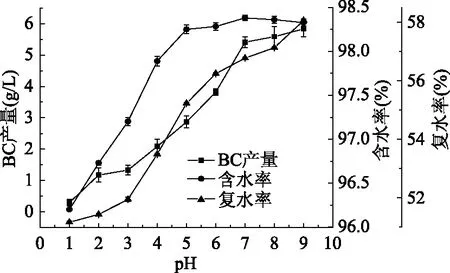
图7 细菌纤维素的含水率与复水率Fig.7 Moisture content and rehydration rate of bacterial cellulose
2.4 细菌纤维素的理化表征
2.4.1 元素分析结果 如表1,木薯水解液原料发酵生产所得的细菌纤维素主要由C、H、O三种元素构成,这三种元素占总质量的98%以上。且C、H、O元素基本符合分子式(C6H10O5)n。

表1 元素分析结果Table 1 Elemental analysis results
2.4.2 红外分析 如图8,木薯水解液为碳源发酵生产的细菌纤维素,在1070 cm-1处为C-O键的伸缩振动,是纤维素的特征峰;在1566 cm-1为C-H键的伸缩振动;在2929 cm-1为CH2-CH伸缩振动;在3358 cm-1处为分子间氢键引起的O-H基的伸缩振动;这与陈慧慧等[12]的结果一致。通过红外分析得到了具有纤维素所特有的特征峰,说明其含有与纤维素相同的基团,这与Chandrasekaran等[21]所得细菌纤维素图谱基本相同。
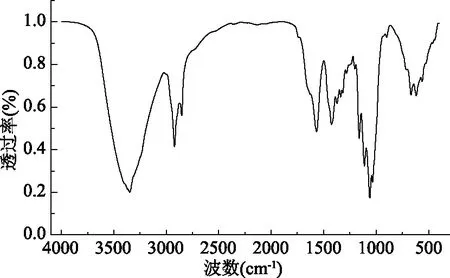
图8 红外光谱分析Fig.8 Infrared spectrum analysis
2.4.3 热重分析 如图9,以木薯水解液发酵得到的细菌纤维素的Mass曲线和DTG曲线可以明显的看出,在0~170 ℃范围内质量有一个缓慢下降的趋势,这主要是因为细菌纤维素含有一定的水分引起的;在170~320 ℃内细菌纤维素在分解过程中进行了各种物理化学反应,在分解过程中放了大量的热,所以质量出现了急剧下降,失重32.33%;最快分解温度在290 ℃左右;在320~500 ℃也出现了较大的失重,质量减少了19.58%,是由于细菌纤维素到达了煅烧阶段;最快分解温度在470 ℃左右。在500~900 ℃后曲线缓慢失重,剩余20%左右是灰烬。这与杜倩雯等[13]的研究结果相一致。从细菌纤维素的DTC曲线可以看出在处理阶段温度不能超过170 ℃,这与Costa等[22]的研究结果相一致。
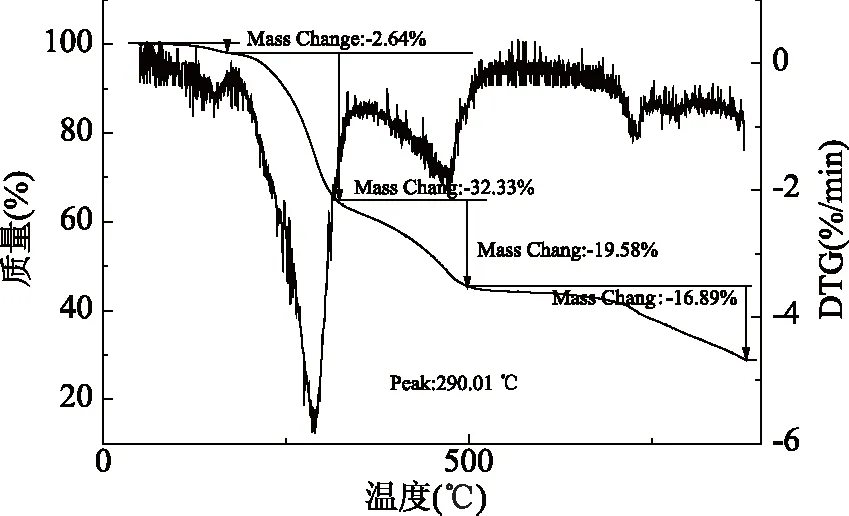
图9 Mass-DTG图谱曲线Fig.9 Spectrum curve
2.4.4 扫描电镜结果 如图10,由扫描显微镜可以看出,利用木薯水解液所培养得出的细菌纤维素微管束直径不到200 nm,属于纳米级的纤维素,而棉花的纤维素的直径在10~100 μm,人造纤维的最小直径在1 μm左右,通过扫描电镜可以看出细菌纤维素表面有很多小孔,这是细菌纤维素膜有较高的持水性与复水性的原因。这与任泽祺等[14]的研究结果基本一致。
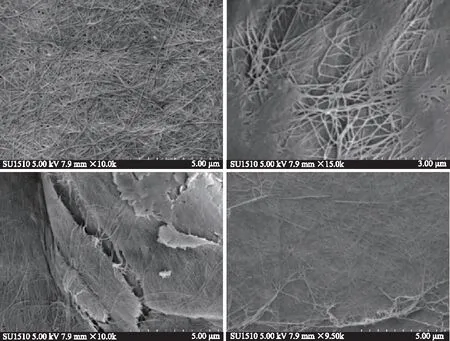
图10 扫描电镜图谱分析Fig.10 Scanning electron microscope analysis
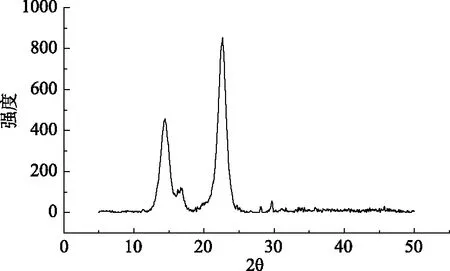
图11 XRD晶体衍射Fig.11 XRD crystal diffraction
3 结论
利用单因素实验确定以木薯水解液发酵生产细菌纤维素的最优条件为:温度30 ℃、装液量75 mL、初始pH6.0、木薯水解液添加量3%、接种量6%;在细菌纤维素发酵过程中,所得的细菌纤维素含水率为96%~98%,复水率为50%~58%,具有高的络合水能力。元素分析表明细菌纤维素主要有C、H、O三种元素组成,红外光谱分析验证了细菌纤维素的特征吸收峰。差热分析表明细菌纤维素的最大失重温度为290 ℃,热稳定性较好,表明这种细菌纤维素在一些耐高温材料中有很重要的应用价值。扫描电镜结果表明细菌纤维素是一种网状纳米结构,是由高密度的纤维丝相互缠绕而成,并具有较大的网格,可以通过技术手段将药品络合在细菌纤维素网状结构中,将其应用在医用辅料中。XRD晶体衍射进一步表明制备的细菌纤维素有高的结晶度,可用作稳定的高分子材料。
