PPAR-α激动剂WY14643对肝癌TAE术后癌旁肝组织氧化应激的作用
2019-09-23吴春华王贝然余义俊
吴春华,王贝然,余义俊,周 舟,杜 伟
(大理大学第一附属医院/大理大学临床医学院放射科,云南大理 671000)
原发性肝癌(primary hepatic carcinoma,PHC)是世界最常见的恶性肿瘤之一,致死率仅次于肺癌[1]。经导管肝动脉栓塞术(transcatheter arterial embolization,TAE)是治疗PHC的主要方法[2-4],可抑制局部肿瘤的生长,但TAE术后患者出现不同程度肝功能下降,是其不可避免的并发症[5-6]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPARs)是一类由配体激活的转录因子,属于核激素受体超家族成员[7]。PPAR-α激动剂WY14643对包括肝脏在内的重要脏器的保护作用可能与PPARα激动剂具有抗氧化作用相关。本研究建立兔VX2肝癌TAE模型,通过观察PPAR-α激动剂WY14643对肝癌TAE术后癌旁肝组织氧化应激损伤的作用情况,旨在分析WY14643在肝癌 TAE术后对肝功能的保护机制。
1 材料与方法
1.1材料
1.1.1实验动物 荷瘤兔2只(由东南大学附属中大医院惠赠),健康新西兰大白兔30只[由昆明楚商科技有限公司提供,许可证号SCXK(滇)K2018-0001],体质量2.5~3.5 kg,雌雄不限,普通饲料喂养。
1.1.2主要使用设备、实验器材及药品 PHILIPS 16排螺旋CT机,TOSHIBA TAITAN 3.0T磁共振机,GE INNOVA-3100IQ DSA,自制实验兔手术台,自制小洞巾,各型号注射器,3%戊巴比妥钠,硫酸庆大霉素注射液,0.9%NaCl,超液态碘化油,明胶海绵颗粒350~560 μm(杭州艾力康医药科技有限公司提供),碘海醇,眼科剪,眼科镊,培养皿,超净台,动脉夹,18G穿刺针,4F导管鞘,3FSP微导管。超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、过氧化氢酶 (catalase,CAT)、髓过氧化物酶(myeloperoxidase,MPO)试剂盒均购自南京建成生物试剂有限公司;WY14643(批号MKCF1249)购自美国Sigma公司。
1.2方法
1.2.1荷瘤兔传代及VX2肝癌模型建立 随机选取荷瘤种兔1只,2%戊巴比妥钠(3 mg/kg)静脉麻醉并固定,于后肢肿瘤处常规备皮、消毒,切入表皮,剥离肿块,并将其周围坏死组织剔除干净,将瘤块边缘生长旺盛的鱼肉样肿瘤组织置于50 mL 0.9%NaCl和2万U庆大霉素混合液的培养皿中,用眼科剪将瘤块剪成1~3 mm的碎块。用1 mL注射器抽吸瘤粒混合液(15~20个瘤粒/mL)后套用18G穿刺针送至健康兔后腿皮下,以保种传代。将兔麻醉固定后,备皮、消毒并铺巾,剑突下正中偏左侧纵向切开腹部,暴露肝左叶,用眼科镊将肝左叶完整拉出,1 mL注射器换用18 G穿刺针呈30°斜穿刺入肝左叶1.5~2.0 cm,回抽未见血液及胆汁回流后注入瘤粒混合液1 mL并迅速用明胶海绵填塞穿刺通道,防止瘤粒脱出,确保种植成功,腹腔内洒入庆大霉素40万U,局部纱布压迫止血3 min,检查无渗血后回纳肝脏,逐层缝合腹部切口,术后连续3 d肌内注射庆大霉素8万U预防感染。
1.2.2实验模型分组及处理 于接种后2周分别行CT及MRI扫描,确定肝癌瘤体在肝内的生长情况(图1~2),将建模成功的24只VX2肝癌兔进行随机分组,其中对照组8只,TAE组8只,联合治疗组8只,TAE组只行TAE手术;联合治疗组注射WY14643 3 mg·kg-1·d-1,连续给药3 d后行TAE术,对照组不做任何处理。
1.2.3TAE VX2肝癌模型兔全麻后固定于操作台上,右腹股沟附近10 cm范围内备皮、消毒后皮肤切一小口,用18G穿刺针穿刺进入股动脉后引入导丝,拔去穿刺针后引入4F导管鞘,经导管鞘放入4F导管,通过导丝选入腹腔干,然后将3F微导管通过4F导管超选入肝总动脉,造影明确肿瘤供血动脉,然后行超选择性肝动脉造影,经3F微导管推入碘化油,剂量为每只荷瘤兔肿瘤直径厘米数×0.2 mL,并依据肿瘤供血情况适当增减[8],最后用明胶海绵颗粒栓塞,直至供血动脉血流缓慢停止(图3),术毕拔管并结扎肝动脉近端,处理切口。
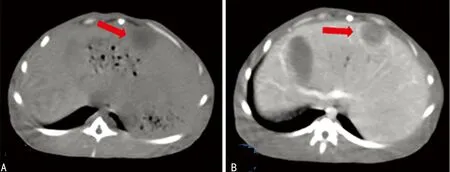
A:平扫显示肝实质内不均匀低密度病灶,肿瘤中心密度较低(红箭);B:增强显示肿瘤实质及边缘呈不均匀明显强化,中心坏死区不强化(红箭)
图1肝脏CT扫描的影像表现
A:MRI T1WI轴位扫描显示肝内不规则低信号改变(红箭);B:MRI T2WI轴位扫描显示肝内不规则稍高信号改变(红箭);C:MRI T2WI失状位扫描
图2肝脏MRI扫描的影像表现
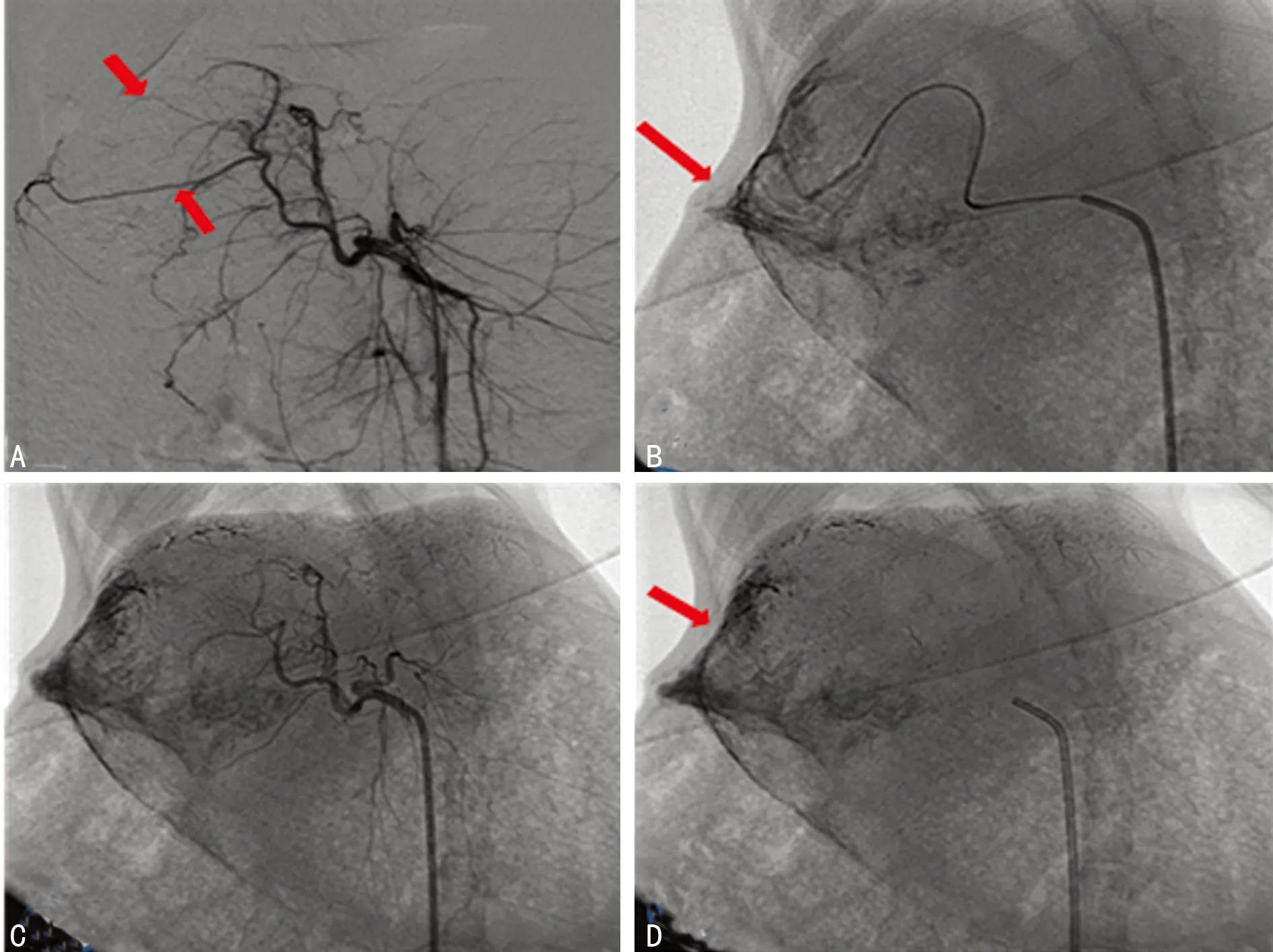
A:腹腔干造影肿瘤血管推移呈“抱球征”;B:超选择性插管推注碘油;C:TAE术后复查造影显示肿瘤供血动脉血流中断,血管闭塞;D:TAE术后平片见肿瘤区有碘油沉积
图3腹腔干及肝动脉血管造影的影像表现
1.2.4实验室检查指标对肝功能的评价 分组处理后3 d,对3组实验兔分别抽血检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBI)、血清清蛋白(ALB)、凝血酶原时间(PT),具体操作步骤按照说明书进行。
1.2.5肝组织SOD、GSH-PX、CAT和MPO的水平测定 3 d后将实验动物处死,位于左上腹剑突下腹正中切口切取完整肝脏,分离瘤组织与周围正常肝组织,距肿瘤大于2 cm处选取癌旁正常肝组织[8],用生物酶学方法进行检测,具体操作步骤按照说明书进行。
2 结 果
2.1肝癌模型建立成功率 成功建立兔肝癌模型24只,造模成功率为80.00%(24/30)。
2.2实验室检查肝功能各指标水平 术后3 d各组复查肝功能,TAE组肝功能明显下降,与对照组差异有统计学意义比较(P<0.05),联合治疗组与TAE组比较,ALT、AST、TBI降低,ALB升高,PT缩短,肝功能好转差异均有统计学意义(P<0.05);联合治疗组与对照组相关指标比较,差异无统计学意义(P>0.05),见表1。
2.3各组动物癌旁肝组织中SOD、GSH-PX、CAT和MPO水平比较 3组各指标用方差分析进行比较:与对照组比较,TAE组SOD、GSH-PX、CAT和MPO水平明显降低,差异均有统计学意义(P<0.05);与TAE组比较,联合治疗组SOD、GSH-PX、CAT和MPO活力明显升高,差异均有统计学意义(P<0.05);联合治疗组与对照组相关指标比较,差异无统计学意义(P>0.05),见表2。
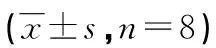
表1 各组动物肝功能相关指标比较
a:P<0.05,与对照组比较;b:P<0.05,与TAE组比较
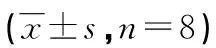
表2 各组动物癌旁肝组织SOD、GSH-PX、CAT和MPO水平比较
a:P<0.05,与对照组比较;b:P<0.05,与TAE组比较
3 讨 论
近些年,PHC发病率逐年上升,大多数患者在确诊时已经失去手术切除或肝移植的时机,仅有10%~20%有手术切除或肝移植的机会[9]。TAE可提供较好的局部区域肿瘤治疗并延长患者的生存率,但即便用超选进行栓塞治疗,栓塞剂不可避免地进入癌旁正常肝组织并沉积于微小动脉和毛细血管,导致组织缺血缺氧,最终不可避免地造成TAE术后肝功能下降[10-11],影响患者的预后。
自由基过多会在机体内产生氧化应激反应,引起组织损伤,SOD、GSH-PX、CAT是生物体细胞内产生的天然自由基清除系统[12],均属于酶促抗氧化系统,其中SOD是最为关键的酶之一[13],当肝脏缺血被阻断再重新恢复血流供应后,会有大量活性氧(reactive oxygen species,ROS)产生,它具有较活跃的化学性质,极易与肝细胞膜上的重要功能与结构蛋白发生过氧化反应,引发一系列复杂的内源性反应,导致肝细胞损伤[14]。另外,MPO是血红素辅基的血红素蛋白酶,是血红素过氧化物酶超家族成员之一,其水平及活性变化代表着嗜中性多形核白细胞的功能和活性状态,主要存在于中性粒细胞嗜天青颗粒中,因此MPO活性可作为中性粒细胞的标记物,定量反应白细胞浸润的数量,也是作为炎症调节的基本成分,其活性的变化可对早期组织损伤做出较敏感的反应。PPAR-α主要在人体重要脏器特别是肝细胞中表达,通过调控相关基因,调节肝脏脂质代谢,减轻氧化应激反应,抑制炎症因子产生和释放,减轻或阻止肝组织损伤[15-19]。本课题组前期研究表明,TAE后癌旁肝组织的炎症因子如TNF-α、IL-10水平升高,同时,抗氧化酶活力明显下降,MPO水平下降,引起氧自由基释放增多,在肝组织中炎性细胞聚集、浸润,凋亡细胞增多,导致肝组织损伤,肝功能下降[20-22]。
本研究结果显示,肝癌TAE术后肝功能下降,经过PPAR-α激动剂WY14643预处理之后,肝功能损伤减轻,与对照组比较,TAE组癌旁肝组织中SOD、GSH-PX、CAT和MPO水平降低,而给予WY14643 处理治疗后癌旁肝组织中上述指标水平明显升高,说明WY14643可通过降低癌旁肝组织的氧化应激作用而减轻肝组织损伤。
综上所述,WY14643可减轻肝癌TAE术后,肝细胞缺血缺氧,癌旁组织发生氧化应激导致的肝细胞损伤,机制可能是WY14643促进SOD、CAT、GSH-PX、MPO等抗氧化酶活性的表达,抑制癌旁肝组织氧化应激的发生。本实验从动物水平研究PPAR-α激动剂WY14643在肝组织损伤中的治疗作用,有利于寻找新的、安全有效的保护肝功能、减轻肝损伤的方法,对于改善肝脏 TAE 术后患者的生存率,具有非常重要的理论与临床实践的指导意义。
