血管内皮祖细胞鉴定及其促血管新生机制的研究进展
2019-09-23潘天岳符伟国董智慧
潘天岳,刘 浩,符伟国,董智慧
复旦大学附属中山医院血管外科,上海 200032
母体怀孕3周内,卵黄囊和母体循环系统通过弥散的方式为胚胎提供营养和氧气。3周后,中胚层的血岛结构开始形成原始脉管系统[1]。血岛中央为造血干细胞群,周围少量细胞为血管母细胞或更早期的干细胞群,两者可能有共同的前体,即血液母细胞。通常认为,血岛周围的内皮母细胞转化为内皮祖细胞后最终分化为内皮细胞(endothelial cells, ECs),组建毛细血管网,在所处的内环境作用下塑形为动脉、静脉和毛细血管系统。
出生后,血管新生的主要参与者为机体局部原有的ECs。ECs在一定诱因(如组织损伤、缺氧、缺血、炎症)作用下发生增殖和迁移,形成新的微血管结构[2]。1997年,Asahara等[3]从人外周血中分离出表达CD34的单个核细胞,其在体外培养后可增殖并传代,同时CD31、TIE-2等内皮特异性标志物增加,形态与ECs相似;在小鼠缺血模型上进行尾静脉注射后,该细胞群定植于肌纤维间的新生微血管周围,其中部分参与微血管的形成。该研究团队将该细胞群称为 “EC progenitors”,为从成人体内分离和鉴定内皮祖细胞(endothelial progenitor cells, EPCs)的最早研究成果。
1 EPCs的鉴定方法
1.1 纤维连接蛋白(FN)培养分离 使用包被FN的培养板接种外周血单个核细胞,48 h后去除不贴壁的细胞,贴壁细胞中能吞噬低密度脂蛋白并与植物凝集素结合者可鉴定为EPCs。这种方法简单易行、成本低,但是存在细胞群混杂,其中大多数细胞为外周血单核-巨噬细胞[4]的缺点。而外周血单核-巨噬细胞既表达低密度脂蛋白受体和清道夫受体,也能吞噬低密度脂蛋白。因此,这种方法分离的EPCs纯度较低,不利于在后续实验中精确地分析EPCs的功能。
1.2 荧光激活或免疫磁珠分选 使用荧光激活分选系统(FACS)或免疫磁珠分选法分离EPCs。其原理为使用偶联荧光素或磁珠的单克隆抗体,将其与表达相关抗原的细胞结合,再通过分选系统识别被标记的细胞并从外周血中分离出来[5]。因此,这种方法的准确性依赖于对抗体的选择。其中,最经典的抗体组合是由Peichev等[5]及Timmermans等[6]提出的CD34+CD133+VEGRF2+,该组合引起了广泛关注。然而,Case等[7]指出,通过这个组合分离出的细胞群最终形成表达特异性抗原CD45的造血干细胞群落,而非EPCs群落。Duda等[8]提出了CD34+CD31+CD45-CD133+组合,并通过流式细胞术在外周血单个核细胞中分离出了该细胞群落,其占单个核细胞总数的0.01%~0.20%。总之,通过抗体介导的分选方法简单、快速,分选结果在不同个体的标本中具有较高的一致性。但是,目前研究者们仍未找到EPCs特异性的表面抗体,使该分选方法精确性降低。
1.3 内皮集落形成细胞(endothelial colony forming cells,ECFCs)鉴定法 该方法由Yodar等提出,相较于前2种方法,该方法更侧重于ECs功能学检测[9-10]。具体方法为从外周血、骨髓或脐带血中分离单个核细胞后,将其接种于包被了FN的培养皿上,用含5%~10%胎牛血清的促血管内皮生长培养基(如EGM-2)培养24~48 h后,去除未贴壁细胞,贴壁细胞继续生长,14~21 d内出现的典型“铺路石”样细胞集落即ECFCs。
ECFCs除具有已知的全部EPCs特性外,还表达ECs的标志性表面抗原,且不表达任何白细胞和髓系标志物[11]。ECFCs具有较强的增殖能力,在体外成小管实验中能形成内皮样管样结构,且在动物模型中参与微血管的形成[12-13]。因此,ECFCs常被认为是EPCs家族中的主要成员,甚至能代表EPCs。另有研究[14]将ECFCs称为晚期内皮祖细胞(LEPCs)或OECs(outgrowth endothelial cells)。最近一项研究[15]显示,在ECFCs群落中,可分离出CD34+和CD34-细胞。大部分CD34+ECFCs有较强的自我更新能力,以及高水平的Notch信号通路蛋白,使细胞周期处于G0/G1期;而CD34-ECFCs大多处于S/G2M期,更接近于分化成熟的ECs,自我更新能力和集落形成能力弱,但增殖能力强[11]。这提示可以从基因及细胞周期水平鉴定EPCs。
2 EPCs的来源
自从1997年Asahara等提出出生后EPCs的概念后,有关成人体内EPCs的来源一直存在争议。目前,一般认为外周血EPCs可能同时来源于骨髓造血系干细胞和外周或骨髓组织的的非造血系干细胞[16]。
来源于骨髓造血系的EPCs与造血干细胞可能有相同的前体细胞,如血液母细胞。这些细胞表达与造血干细胞相同的抗原CD34、CD133等。在使用ECFCs法培养48 h后分离出的不贴壁细胞继续生长5~7 d可形成集落形成单位(colony-forming units, CFU),这些细胞被称为CFU-ECs,或早期EPCs。这些细胞表达CD14、CD45等髓系细胞表面抗原,形态呈纺锤样或多边形,能够分泌大量的促血管新生细胞因子,但很少融合入ECs形成的血管网[12]。此外,有研究[17-18]发现有些造血系来源的EPCs并不形成CFU,但有潜力在体外或体内形成血管样结构。一些研究[19-20]甚至发现,来自髓系的单核-巨噬系统的干细胞或祖细胞可在特定微环境下形成血管内皮。目前已报道的来自骨髓造血系的EPCs种类丰富,这些EPCs可能均由髓系干细胞分化而成。
非造血系来源的EPCs不表达或极少表达CD14和CD45,且经体外培养后,其形态和功能学与造血系来源的EPCs也不同。Yodar等[21]分离出的ECFCs是非造血系来源的EPCs,而可能直接来源于外周器官的血管壁。Fang等[22]发现,这些存在于血管壁的EPCs表达CD117。Schniedermann等[23]从小鼠肺组织微血管分离ECFCs,发现其具有较强的形成血管和淋巴管的潜能。Rapp等[24]从胎盘上分离出ECFCs,其不表达CD34和CD45表面抗原,并且显示出比脐血ECFCs更强的血管生成能力。
上述研究表明,CFU-ECs和其他大量表达CD14或CD45的EPCs来源于骨髓造血系干细胞,而ECFCs来源于外周器官的血管壁和骨髓非造血系干细胞。
3 EPCs参与出生后血管新生的机制
Asahara等[3]发现,静脉注射的外周血CD34+单个核细胞可以在小鼠缺血肢体中直接融合入新生微血管管壁,有些直接形成微血管;而CD34-单个核细胞聚集在肌纤维周围,不参与微血管形成。Schatteman等[25]在糖尿病免疫缺陷小鼠的肢体缺血模型中,经肌肉注射植入人CD34+细胞,结果发现缺血肢体血流灌注加速恢复。上述研究提示部分EPCs通过融合入新生微血管壁来促进其生成,增加血流灌注。这些直接参与新生血管形成的EPCs的来源一直是研究重点[25]。HU等[26]将BALB/c小鼠的动脉移植入C57BL/6/TIE2-LacZ小鼠后,观察到宿主骨髓来源的表达β-Gal+的细胞参与供体血管壁的内皮增生。有研究[27-28]在下肢缺血和心肌缺血造成的损伤组织中也观察到骨髓来源的EPCs直接参与血管新生。Perry等[29]用来自C57BL/6J小鼠的骨髓细胞移植入eNOS-/-小鼠,4周后仅在血液中和血管周围发现供体细胞,而未在血管内皮中发现供体细胞嵌合,提示骨髓EPCs不直接参与正常衰老的ECs自我更新。而Aicher等[30]在异种共生态模型和Lacz+供体/Lacz-受体模型中发现,供体动物非骨髓来源的EPCs直接参与受体动物肢体缺血后的血管内皮再生,比例高于骨髓来源的EPCs。由此可见,骨髓和非骨髓来源的EPCs都能直接参与组织损伤后新生血管内皮的形成,而非骨髓来源的EPCs可能直接参与衰老血管内皮的更新。
除直接参与血管内皮形成外,EPCs旁分泌细胞因子也可促进血管新生。Urbich等[31]用基因微阵列技术对比了人外周血EPCs、脐静脉ECs和微血管ECs的促血管新生相关基因的表达情况,发现血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)、VEGF-B、基质细胞衍生因子 1(stromal cell derived factor-1,SDF-1)和类胰岛素生长因子(insulin-like growth factor-1, IGF-1)的mRNA在EPCs中的表达量明显高于ECs;在EPCs培养液中,这些细胞因子含量也较高。Miyamoto等[32]从骨髓中分离出高表达VEGF-A、成纤维细胞生长因子2(fibroblast growth factor-2, FGF-2)和肝细胞生长因子(hepatocyte growth factor,HGF)的细胞亚群,说明这些起旁分泌作用的EPCs部分来源于骨髓。研究[33-34]在动物缺血模型中发现,植入的EPCs停留于微血管壁外,周围有大量VEGF,提示EPCs在损伤组织内通过旁分泌细胞因子促进血管新生。Sahoo等[35]发现,人外周血CD34+细胞能分泌促血管新生的外泌体;体外和体内实验显示,新生血管形成与外泌体含量呈剂量依赖关系。外泌体中除包含生长因子和促血管新生因子外,还包含微小RNAs(miRNAs)。研究[36]证实,miRNAs可以通过表观遗传学方式调控EPCs的旁分泌作用,促进血管新生。总之,部分EPCs可能通过旁分泌生长因子、细胞因子和外泌体诱导周围ECs迁移和增殖,促进新生血管形成;EPCs可能来源于骨髓造血系统。EPCs参与新生血管形成的机制见图1。
近期,Yodar等[37-38]将上述2种机制进行了统一:造血系来源的EPCs首先归巢至缺血或损伤的组织,然后通过旁分泌促血管新生因子招募血液中及周围组织中的ECFCs至损伤处,直接介入血管内皮形成,并进一步通过分泌细胞因子促进已有ECs增殖和自我更新。基于这种理论,组织损伤的修复能力可能取决于局部ECFCs的含量。肾脏微血管ECs增殖能力较弱,表现为急性肾损伤后组织内血管新生极少,而有的器官ECs体外培养时则表现出较强的增殖能力[39],可能提示不同器官内ECFCs数量差别较大。
如前所述,造血系来源的EPCs需要归巢至损伤组织才能进一步发挥作用。而在归巢前,这些细胞须经历动员、迁移、黏附等步骤。Dawei等[40]总结了这些过程所涉及的细胞及相关分子机制:组织损伤后向血液中释放VEGF、SDF-1等细胞因子,通过SDF-1/CXCR4轴或eNOS/NO/MMP-9/kitL轴使骨髓造血系EPCs与骨髓间质细胞脱离,并向外周血迁移;EPCs顺SDF-1浓度梯度向损伤组织处迁移,通过整联素和P选择素黏附和定植于损伤的血管内皮,进一步通过旁分泌作用促进血管生成。阿卡波糖、维生素D等药物可通过直接或间接增强以上途径来增强EPCs的促血管新生作用[41]。总之,骨髓来源的EPCs是修复组织损伤的先驱,为ECFCs和其他EPCs提供了增殖和分化的有利环境,且同时促进原有ECs的迁移和增殖。
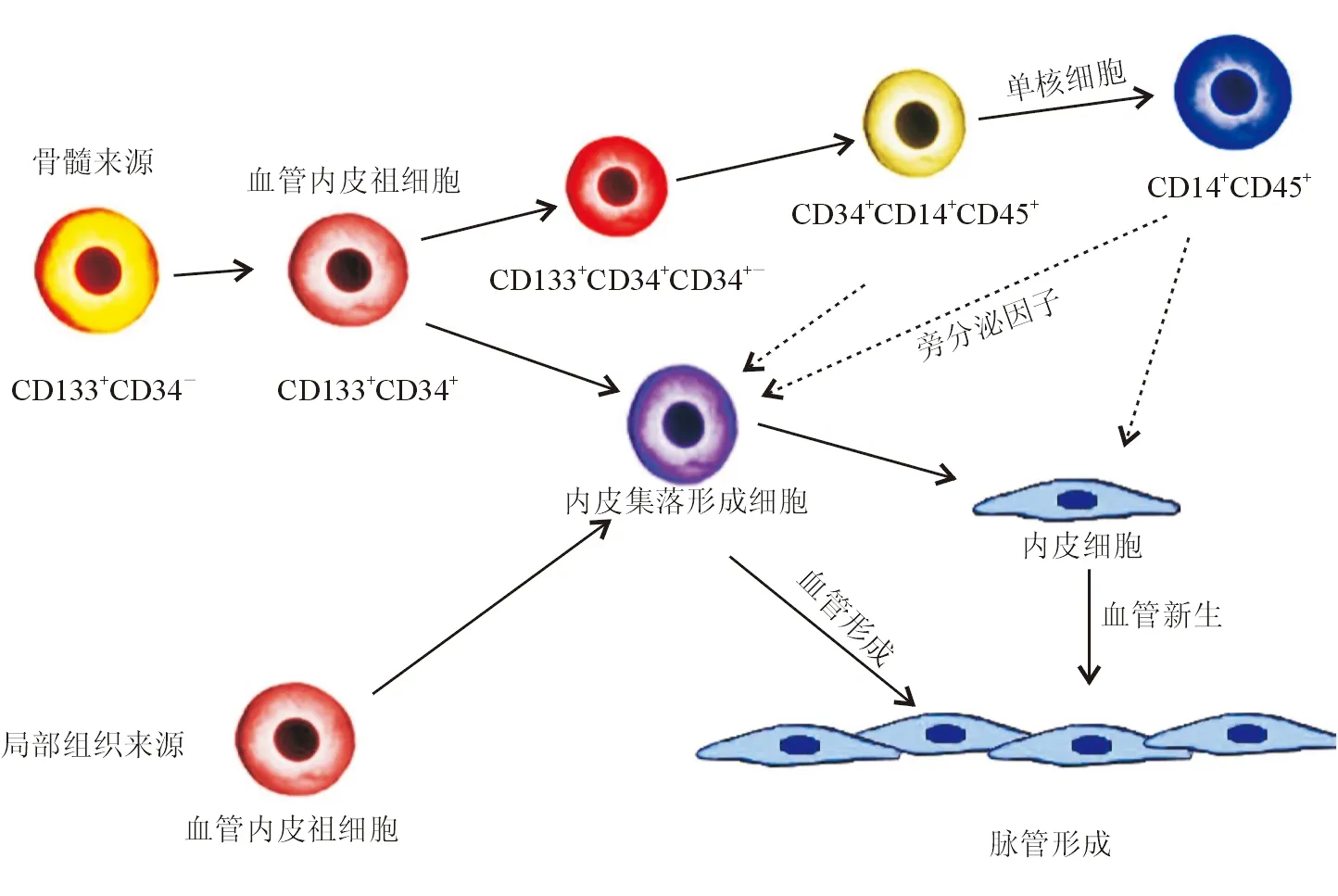
图1 血管内皮祖细胞分化过程及促进出生后血管新生机制
4 总结与展望
EPCs的发现填补了出生后血管新生领域的空白。随后,其来源、作用和促进血管新生的机制逐渐获得深入研究。大量动物缺血和组织损伤模型验证了EPCs修复组织和血管再生的能力,为临床上基于EPCs的治疗性血管新生提供了理论依据。由于近年来发现单纯的EPCs移植常达不到预期的治疗目标,在此基础上加强EPCs的促血管新生作用的方法逐渐被探讨,如在移植前缺氧预处理EPCs[42]或采用微应力刺激促进EPCs增殖[43]。随着EPCs研究的不断深入,相信EPCs在临床上将得到更广泛的应用。
