卡培他滨对非靶标生物斑马鱼胚胎的发育毒性研究
2019-09-21王利利赵文广丁壮王正平赵燕娜韩军
王利利, 赵文广, 丁壮, 王正平, 赵燕娜, 韩军,3,*
卡培他滨对非靶标生物斑马鱼胚胎的发育毒性研究
王利利1, 赵文广2, 丁壮1, 王正平1, 赵燕娜1, 韩军1,3,*
1. 聊城大学, 生物制药研究院, 山东, 聊城 252000 2. 聊城市传染病医院, 山东, 聊城 252000 3. 聊城高新生物技术有限公司, 山东, 聊城 252000
为评价抗肿瘤药物卡培他滨(CAP)对非靶标生物的毒性, 以斑马鱼胚胎为受试生物, 研究了CAP对斑马鱼胚胎的发育毒性及对其抗氧化酶系的影响。结果表明, 直接暴露于卡培他滨中, 造成斑马鱼胚胎死亡率和畸形率增加, 且其机能有所下降。当暴露浓度高于20 μg·L-1时, 处理后的斑马鱼胚胎死亡率和畸形率显著升高, 与对照组相比有极显著差异。CAP浓度为0.2 μg·L-1时, 超氧化物歧化酶 (SOD) 活性和过氧化氢酶 (CAT) 活性均显著升高, 表明机体遭受一定程度的氧化损伤; 当浓度高于20 μg·L-1时, SOD和CAT活性显著降低, 表明斑马鱼仔鱼所受氧化损伤超出其自我修复能力, 引发致死性伤害。本文从发育毒性及氧化应激着手, 探究了CAP对非靶标生物的潜在危害, 为其生态效应提供一定的科学依据。
卡培他滨; 非靶标生物; 斑马鱼胚胎; 发育毒性; 氧化损伤
0 前言
卡培他滨 (Capecitabine, 简称CAP, 分子式为C15H22O6N3F), 化学名为N4-戊基羧酸-5’-脱氧-5-氟胞嘧啶, 是抗代谢氟嘧啶脱氧核苷氨基甲酸酯类抗肿瘤药[1], 能够抑制细胞分裂和干扰RNA和蛋白质的合成, 主要用于晚期原发性或转移型乳腺癌、直肠癌、结肠癌等癌症的治疗[2]。作为一种肿瘤内激活的前体药物, CAP具有较高的肿瘤选择性, 特异性较强, 目前CAP的使用量也在不断增加[3]。近年来, CAP的消耗量约每年75—90 kg[4], 随着药物的滥用, 药源污染物在环境中的污染程度日益增加并受到了广泛的关注[5]。据调研, 中型医院的医院废水中检测到CAP浓度高达1749 ng·L-1[6], CAP在12个西班牙污水处理厂中的检出浓度范围为nd(未检出)—72.6 ng·L-1[7]。随着CAP在水体中不断被检测出, 其释放入环境后所产生的环境效应的评价越来越受到关注[5–6]。目前对CAP的水生毒性研究主要集中与浮游动物, 如轮虫、大型溞等[8–9], 但对鱼类等高等水生生物的毒性风险还相对空白, 本文拟采用模式生物斑马鱼对CAP的水生生物毒性进行研究。
斑马鱼(Brachydanio rerio)作为模式生物已广泛应用于心脑血管疾病、免疫学以及肿瘤造模等的研究[10–11]。斑马鱼基因与人类基因同源性高达87%, 其模型数据大多数情况下适用于人体[12]。另外, 斑马鱼的卵具有透明性, 整个胚胎发育在体外完成, 因此不仅可以很容易获得完整胚胎, 还可以在显微镜下直接观察其发育的整个过程[13], 在人类疾病、药物效应及水生毒性评价等方面具有良好的研究意义[13–15]。同时, 斑马鱼胚胎毒性技术是各国标准组织认可的测定单一化学品毒性的方法之一, 本研究拟采用斑马鱼胚胎毒性技术对CAP的生物毒性进行系统性评价, 以便探讨CAP的毒性效应, 为其安全性评价提供一定的理论依据。
1 材料与方法
1.1 实验材料与仪器
试剂: 卡培他滨原料药 (CAP, 98%), 购自武汉宏信精细化工有限公司; 氯化钾 (Potassium chloride, KCl, 南京化学试剂有限公司); 蛋白质测试试剂盒(BCA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)均购自南京建成生物工程研究所; 其他试剂均为分析纯。
仪器: 电热恒温培养箱 (MGC-300A, 上海一恒); 紫外-可见分光光度计 (752, 上海菁华科技仪器有限公司); 冷冻离心机 (SIGMA2-16K, 希格玛SIGMA); 分析天平 (AUY220, SHIMADZU) 显微镜 (BK5000, 重庆奥特)。
1.2 受试生物
实验用斑马鱼为野生型AB品系, 成鱼购自江苏轩佳斑马鱼公司, 参考文献[16]进行斑马鱼的实验室驯养, 雌雄分开饲养, 平均体长为(3.60±0.30) cm, 选择行动灵敏, 逆水性强, 外观正常的健康个体进行实验室驯养, 实验室养殖用水为曝气48 h的自来水, 平均1 g鱼于1 L水中, 每天喂食2次, 产卵前实验室驯养14 d。实验室驯养期间, 自然死亡率不得高于1%, 将产卵期斑马鱼按雌雄比例2: 2放置于孵化器中待产, 于第二天抽去隔板开始交配产卵, 产卵时长为1 h, 收集并清洗胚胎, 置于光照培养箱中, 温度为(28±1) ℃, 光/暗周期为14 h: 10 h。于6 h后置于显微镜下观察, 去除死亡胚胎, 选取正常分裂的受精卵分组暴露于不同浓度的CAP溶液中。
1.3 暴露实验
于显微镜下观察, 挑选发育正常、大小相近的受精卵即胚胎进行暴露实验, 将胚胎于受精后6 h暴露于CAP溶液中, 其浓度分别为0 μg·L-1()、0.2 μg·L-1、20 μg·L-1和2000 μg·L-1。于24孔细胞板中每孔加入2 mL相应浓度的CAP溶液, 放入1枚胚胎, 每板放置20颗胚胎作为一个平行, 每个浓度设置3个平行。采用半静态换液, 即暴露溶液每24 h更换一半。暴露期间水温保持(28±1) ℃, 光/暗周期为14 h: 10 h。
以每孔放置1个胚胎样本, 胚胎发育毒性一般为24—144 h, 观察时期包括胚胎期和自由胚期。致死性毒理性终点()[17]: 卵凝滞、尾部无伸展、无心跳等; 亚致死毒理性终点(): 孵化延迟、心跳减缓或停止、自主运动次数减少等; 致畸性毒理性终点(): 脊柱弯曲、尾部畸形心包水肿等。分别于受精后观测胚胎孵化情况和144 h后仔鱼畸形率; 并于受精后24 h观察记录胚胎20 s内的自主运动, 于受精后72 h观测20 s内的心跳。
1.4 抗氧化指标测定
胚胎暴露144 h后, 用28 ℃双蒸水清洗受试斑马鱼仔鱼, 去除表面CAP干扰, 将仔鱼置于洁净匀浆管中, 参照文献制备仔鱼的组织匀浆[18]: 去除水分称重, 按1: 9 (g:mL) 加入预冷生理盐水, 在冰水浴中进行匀浆, 采用14000 r·min-1, 4 ℃离心匀浆液10 min, 取上清置于-80 ℃条件下保持备用, 蛋白含量及SOD、CAT的测定按试剂盒说明书进行。
1.5 统计学分析
采用SPSS 16.0软件进行数据分析, 运用单因素方差分析法 (one-way ANOVA)。*< 0.05表示实验组与对照组存在显著性差异; **< 0.01表示实验组与对照组存在极显著差异。
2 结果与分析
2.1 胚胎孵化率及胚胎机体性能
CAP暴露对斑马鱼胚胎的孵化率的影响见图1, 由图可知, 0.2 μg·L-1CAP暴露条件下, 对斑马鱼胚胎的孵化没有明显的影响, 随着CAP浓度的升高, 其孵化率显著下降 (< 0.01)。高浓度的CAP暴露对斑马鱼胚胎48 h和56 h的孵化率影响显著, 72 h时, 除去死亡胚胎, 存活的胚胎孵化率在各暴露条件下均无明显差异。表明20 μg·L-1和2000 μg·L-1CAP暴露致使斑马鱼胚胎的孵化时长延长, 至72 h后无明显差异。
以暴露后24 h的胚胎自主运动和暴露后72 h的胚胎心跳次数为指标, 对斑马鱼胚胎的机体性能进行考察 (见图2), 胚胎的自主运动与其孵化率有直接的关系, 自主运动较高时, 其孵化较快。从图中可知, 随着暴露CAP的浓度增加, 斑马鱼胚胎的自主运动有下降的趋势。低浓度下 (0.2 μg·L-1和20 μg·L-1), 自主运动虽有下降趋势, 但与对照组无明显差异 (> 0.05)。当暴露CAP浓度达2000 μg·L-1时, 表现出明显的抑制效果 (< 0.05), 这与孵化率的结果也存在一致性。另外, 从暴露后72 h的胚胎心跳次数也可以发现, 随着暴露CAP的浓度增高, 心跳次数逐渐降低, 当浓度达到2000 μg·L-1时, 与对照组相比, 心跳次数明显减慢 (< 0.05)。从上述结果可知, CAP对斑马鱼胚胎具有明显的损伤作用, 随着浓度的升高, 其损伤增强, 具有明显的浓度依赖性。

图1 CAP暴露对斑马鱼胚胎孵化率的影响
Figure 1 Hatching rate of zebrafish embryos upon exposure to different concentrations of CAP. (*< 0.05, **< 0.01)

图 2 CAP暴露24 h后斑马鱼胚胎自主运动 (A)及72 h对斑马鱼胚胎心跳次数 (B)
Figure 2 Spontaneous movement (A) and heart beats (B) of zebrafish embryos upon exposure to different concentrations of CAP, at 24 h and 72 h, respectively. (*< 0.05, **< 0.01)
2.2 仔鱼的死亡率以及畸形率
CAP暴露144 h后斑马鱼仔鱼的死亡率和畸形率见图3。由图可知, 与对照组相比, 当CAP的暴露浓度为0.2 μg·L-1时, 仔鱼的死亡率和畸形率均无明显变化 (> 0.05), 但当浓度升高到20 μg·L-1和2000 μg·L-1时, 其死亡率和畸形率均显著升高 (< 0.01), 且随暴露浓度增高, 死亡率和畸形率均呈增长趋势。主要的形态异常见图4, 当浓度升高时, 部分卵发育过程中出现了胎盘细胞破损甚至卵黄凝结, 影响胚胎的存活及孵化, 随着发育时间的延长, 斑马鱼幼体出现了腹部水肿、心胞囊肿以及脊柱弯曲等现象。
2.3 抗氧化应激效应
由图5可见, 不同暴露浓度的CAP处理144 h后, CAP暴露浓度为0.2 μg·L-1时, 仔鱼体内SOD和CAT活性均较空白组有明显升高(< 0.05), 而高于0.2 μg·L-1时, CAP暴露组斑马鱼胚胎SOD活力和CAT活力均有显著降低 (< 0.01)。从SOD活力变化可知, CAP处理144 h后, SOD活性随着CAP浓度的增大而呈现先增高后降低的趋势, 各暴露组间存在明显的差异 (< 0.05)。对于CAT活性变化, 20 μg·L-1和2000 μg·L-1浓度组与0.2 μg·L-1浓度组具有极显著差异 (< 0.01), 而20 μg·L-1浓度组与2000 μg·L-1浓度组间并无显著性差异 (> 0.05)。
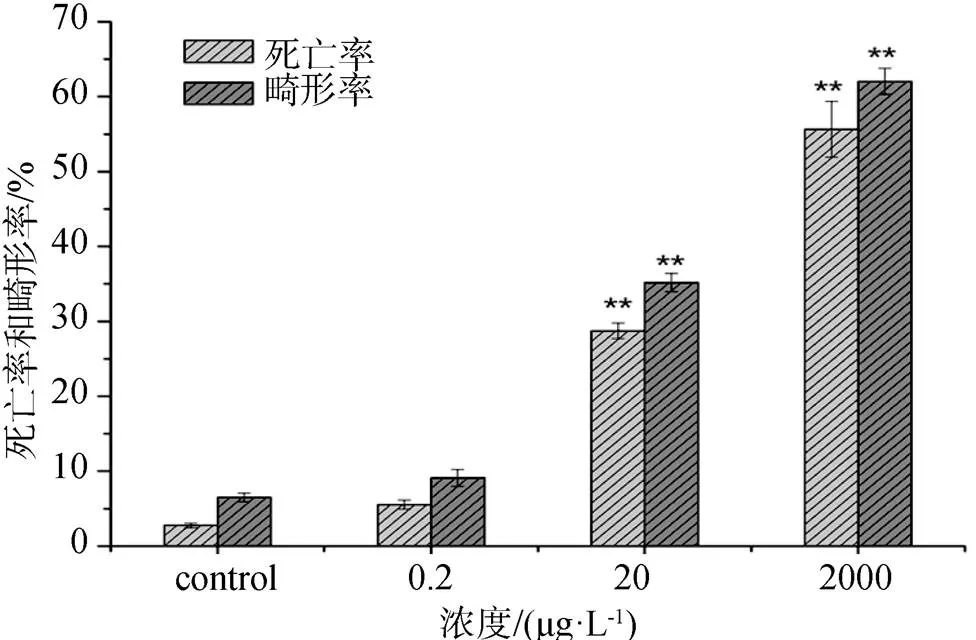
图 3 CAP暴露144 h对斑马鱼仔鱼的死亡率和畸形率的影响
Figure 3 Mortality and deformation rate of zebrafish larvae at 144 h upon exposure to different concentrations of CAP. (*< 0.05, **< 0.01)

图4 正常发育及畸形发育的斑马鱼胚胎
Figure 4 The embryos of zebrafish with normal and malformed development

图 5 CAP暴露144 h对斑马鱼仔鱼的SOD活性 (A) 和CAT活性 (B) 的影响
Figure 5 SOD activities (A) and CAT activities (B) of zebrafish larvae at 144 h upon exposure to different concentrations of CAP. (*< 0.05, **< 0.01)
3 讨论
CAP作为选择性抗肿瘤药物, 广泛运用于临床, 相对于传统的抗肿瘤药物5-FU, 具有更好的肿瘤细胞选择性, 研究表明, 5-FU在斑马鱼的传代过程中具有明显的毒性效应, 这可能归属于其杀细胞作用, 由于斑马鱼胚胎期细胞增殖较快, 相对于成鱼, 5-FU对斑马鱼胚胎的发育毒性较大[19]。由此, 作为前体的卡培他滨对增殖旺盛的正常细胞的毒性效应, 需进行系统地研究。
CAP的发育毒性 本研究通过模拟实验研究了直接暴露在一定浓度的CAP溶液中对斑马鱼胚胎发育的毒性效应[20–21]。结果发现浓度为0.2 μg·L-1时, 斑马鱼胚胎无论从孵化率、致死率方面, 以及24 h自主运动和72 h心跳次数方面, 都与对照组无明显差异。当浓度增加到20 μg·L-1时, CAP对于斑马鱼胚胎的发育表现出明显的毒性作用, 使胚胎孵化率明显降低, 死亡率和畸形率明显升高, 但对于自主运动和心跳次数并无明显的抑制作用。当CAP浓度达2000 μg·L-1时, 其毒性更加明显, 显著降低了胚胎孵化率, 增加了胚胎死亡率和畸形率, 并能够抑制胚胎的自主运动从而使胚胎脱膜困难, 抑制其心跳使其机能降低。可见, CAP对于斑马鱼胚胎的发育毒性及机能抑制作用具有明显的剂量依赖效应, 即CAP对胚胎的毒性随着CAP暴露浓度的升高而增加, 这与许多传统环境毒性物质的毒性效应规律相似[10]。因此, 该现象除了揭示CAP对正常增殖细胞的毒性作用之外, 也提示我们关注CAP在生产应用过程中进入环境后所引发的环境效应。
氧化损伤机制研究 氧化损伤被认为是许多化合物毒性的作用机制之一, 目前多利用离体细胞或成年动物进行研究, 但离体细胞的培养条件与体内环境存在很大差异, 不能有效地推及到整体生物。很多研究发现, 由于胚胎或幼体发育阶段的特殊性, 对外界刺激的响应机制并不完善, 因此, 相对于斑马鱼成体, 胚胎或者仔鱼更能体现整体生物细胞的应激水平[22]。基于以上考虑, 本研究以斑马鱼仔鱼 (144 h)为研究对象, 通过探讨CAP暴露对抗氧化系统的酶系的影响, 从氧化应激的角度讨论CAP毒理作用的机制。
SOD为超氧化物歧化酶, 是一种清除超氧阴离子的特异性功能酶, 可与超氧阴离子发生歧化反应, 使其分解为H2O和O2, 维持机体的氧化和抗氧化平衡[23]。SOD的活性水平升高时, 提示机体遭受一定程度的氧化损伤, 而当机体SOD活性的显著降低时, SOD酶的清除能力减弱, 表明所遭受的氧化损伤已超出机体自我修复的范围而出现严重损伤[24]。本研究结果发现, 当暴露CAP浓度较低时, 其损伤仍在仔鱼可修复范围, 通过提高自身的SOD水平进行对抗, 而当CAP的暴露浓度增加到20 μg·L-1以上时, SOD活性明显降低, 表现出极度损伤, 从死亡率等表观指标也可发现, 当暴露浓度升高到20 μg·L-1以上时, 死亡率, 畸形率等呈现较高的水平。同时也可以发现, CAP对斑马鱼仔鱼SOD活性的影响随浓度增加呈降低趋势。表明了CAP在高于一定浓度后, 能够导致胚胎体内超氧阴离子增多, 超出SOD酶清除作用而损伤机体, 并反过来抑制SOD的活性。与斑马鱼胚胎的死亡率和畸形率相一致, SOD的活性抑制程度随着CAP浓度的增加而增大, 表现出明显的浓度依赖性, 结果表明, 氧化应激系统损伤可能是导致斑马鱼畸形发育的潜在诱因。
CAT也是机体生物防御体系的关键酶之一, 也是氧化损伤的标志酶之一, 是过氧化物酶体的标志, 占过氧化物酶体总量的40%。CAT能够有效地清除体内的H2O2, 使机体免受H2O2的损害[25]。同样, 当氧化损伤超过生物承受范围则会造成生物体酶系的抑制, 即氧化应激系统受到严重损伤[26]。本研究发现, 与SOD活性规律相似, 当暴露在不同浓度的CAP溶液中时, 斑马鱼仔鱼体内CAT的活性同样表现出浓度依赖性。当暴露CAP浓度较低时, 仔鱼可通过提高自身的CAT水平对抗氧化损伤, 而当CAP的暴露浓度增加到20 μg·L-1以上时, CAT活性明显降低, 表现出极度损伤。结合SOD与CAT活性变化可知, CAP对于斑马鱼的损伤呈现一定的浓度依赖性。值得注意的是, 当CAP浓度增大到20 μg·L-1和2000 μg·L-1时, 斑马鱼幼仔体内CAT的抑制程度并无明显增强, 与斑马鱼的畸形发育率等现象有所不同。斑马鱼是一个复杂的生物体, 其行为学受到多种系统调控, 如氧化应激系统、神经系统、内分泌系统等, 多数情况下, 生物的行为是受到多种调控系统共同作用的, 斑马鱼死亡率和畸形率增加有可能是又不仅仅是抗氧化系统损伤而诱发, 值得我们后续进一步研究。
4 结论
斑马鱼胚胎直接暴露于CAP会引发一系列的毒性效应, 如死亡率、畸形率等的显著升高, 斑马鱼胚胎机能的下降等。当CAP暴露浓度高于20 μg·L-1时, 有明显的致死和致畸效应, 在48—56 h的敏感胚胎发育阶段, CAP对斑马鱼胚胎的发育毒性具有一定的浓度-效应关系。CAP暴露对斑马鱼胚胎/仔鱼的抗氧化指标均产生了较大的影响, SOD和CAT的活性均呈现低浓度升高, 高浓度降低的现象, 表明CAP对斑马鱼胚胎/仔鱼发育阶段产生氧化损伤, 进而引发一系列机能改变, 甚至导致死亡。
致谢: 本工作受到了山东省科技发展计划项目 (2014GSF118121)和“重大新药创制”科技重大专项2017年度立项课题(2017ZX09201003)资助, 并在山东省抗体药物协同创新中心、山东省纳米药物与释药系统工程技术研究中心、聊城市热熔挤出药物制剂工程技术研究中心、聊城市热熔挤出药物制剂工程实验室、聊城市传染病医院中完成, 各平台都给予了有力的支持。
[1] PETRELLI F, DI C S, LONATI V, et al. Vinorelbine with capecitabine, an evergreen doublet for advanced breast cancer: a systematic literature review and pooled-analysis of phase II-III studies[J]. Clinical Breast Cancer, 2016, 16(5): 327–334.
[2] BAZARBASHI S, OMAR A, ALJUBRAN A, et al. Pre-operative chemoradiotherapy using capecitabine and cetuximab followed by definitive surgery in patients with operable rectal cancer[J]. Hematology/oncology & Stem Cell Therapy, 2016, 9(4): 147–153
[3] LAM S W, GUCHELAAR H J, BOVEN E. The role of pharmacogenetics in capecitabine efficacy and toxicity[J]. Cancer Treatment Reviews, 2016, 50: 9–22.
[4] SANTOS M S F, FRANQUET-GRIELL H, LACORTE S, et al. Anticancer drugs in Portuguese surface waters - Estimation of concentrations and identification of potentially priority drugs[J]. Chemosphere, 2017, 184: 1250–1260.
[5] ANDREU V, GIMENOGARC A E, PASCUAL J A, et al. Presence of pharmaceuticals and heavy metals in the waters of a Mediterranean coastal wetland: Potential interactions and the influence of the environment[J]. Science of the Total Environment, 2016, 540(Pt 1): 278–286.
[6] OLALLA A, NEGREIRA N, LOPEZ DE ALDA M, et al. A case study to identify priority cytostatic contaminants in hospital effluents[J]. Chemosphere, 2018, 190: 417–430.
[7] NEGREIRA N, DE ALDA M L, BARCEL D. Cytostatic drugs and metabolites in municipal and hospital wastewaters in Spain: Filtration, occurrence, and environmental risk[J]. Science of The Total Environment, 2014, 497-498: 68–77.
[8] PARRELLA A, LAVORGNA M, CRISCUOLO E, et al. Acute and chronic toxicity of six anticancer drugs on rotifers and crustaceans[J]. Chemosphere, 2014, 115: 59–66.
[9] PARRELLA A, LAVORGNA M, CRISCUOLO E, et al. Eco-genotoxicity of six anticancer drugs using comet assay in daphnids[J]. J Hazard Mater, 2015, 286: 573–580.
[10] MIMEAULT M, BATRA S K. Emergence of zebrafish models in oncology for validating novel anticancer drug targets and nanomaterials[J]. Drug Discovery Today, 2013, 18(3-4): 128–140.
[11] LIU Chenwei, XIONG Feng, JIA Huizhen, et al. Graphene-based anticancer nanosystem and its biosafety evaluation using a zebrafish model[J]. Biomacromolecules, 2013, 14(2): 358–366.
[12] TON C, LIN Yingxin, WILLETT C. Zebrafish as a model for developmental neurotoxicity testing[J]. Birth Defects Research Part A Clinical & Molecular Teratology, 2010, 76(7): 553–567.
[13] PARK C B, JANG J, KIM S, et al. Single- and mixture toxicity of three organic UV-filters, ethylhexyl methoxycinnamate, octocrylene, and avobenzone on Daphnia magna[J]. Ecotoxicology & Environmental Safety, 2017, 137: 57–63.
[14] ZHANG Chaojie, WILLETT C, FREMGEN T. Zebrafish: an animal model for toxicological studies[J]. Current Protocols in Toxicology, 2003, Chapter 1(Chapter 1): Unit1.7.
[15] TSANG M, TSANG M. Zebrafish: A tool for chemical screens[J]. Birth Defects Research (Part C): Embryo Today: Reviews, 2010, 90(3): 185–192.
[16] YAN Zhengyu, YANG Qiulian, JIANG Weili, et al. Integrated toxic evaluation of sulfamethazine on zebrafish: Including two lifespan stages (embryo-larval and adult) and three exposure periods (exposure, post-exposure and re-exposure)[J]. Chemosphere, 2018, 195: 784–792.
[17] LIN Tao, CHEN Yanqiu, CHEN Wei. Impact of toxicological properties of sulfonamides on the growth of zebrafish embryos in the water[J]. Environmental Toxicology & Pharmacology, 2013, 36(3): 1068–1076.
[18] QUINTANEIRO C, PATR CIO D, NOVAIS S C, et al. Endocrine and physiological effects of linuron and S-metolachlor in zebrafish developing embryos[J]. Science of the Total Environment, 2017, 586: 390–400.
[19] KOV CS R, CSENKI Z, BAKOS K, et al. Assessment of toxicity and genotoxicity of low doses of 5-fluorouracil in zebrafish (Danio rerio) two-generation study[J]. Water Research, 2015, 77: 201–212.
[20] HRUBIK J, GLISIC B, SAMARDZIJA D, et al. Effect of PMA-induced protein kinase C activation on development and apoptosis in early zebrafish embryos[J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 2016, 190: 24–31.
[21] YAN Lu, GONG Chenxue, ZHANG Xiaofeng, et al. Perturbation of metabonome of embryo/larvae zebrafish after exposure to fipronil[J]. Environmental Toxicology & Pharmacology, 2016, 48: 39–45.
[22] WIEGAND C, PFLUGMACHER S, GIESE M, et al. Uptake, toxicity, and effects on detoxication enzymes of atrazine and trifluoroacetate in embryos of zebrafish[J]. Ecotoxicology and environmental safety, 2000, 45(2): 122–131.
[23] LIU Yanhua, GUO Ruixin, TANG Shengkai, et al. Single and mixture toxicities of BDE-47, 6-OH-BDE-47 and 6-MeO-BDE-47 on the feeding activity of Daphnia magna: From behavior assessment to neurotoxicity[J]. Chemosphere, 2018, 195: 542–550.
[24] WAN Jinjin, GUO Peiyong, PENG Xiaofang, et al. Effect of erythromycin exposure on the growth, antioxidant system and photosynthesis of Microcystis flos-aquae[J]. Journal of Hazardous Materials, 2015, 283: 778–786.
[25] CUI Feng, CHAI Tingting, QIAN Le, et al. Effects of three diamides (chlorantraniliprole, cyantraniliprole and flubendiamide) on life history, embryonic development and oxidative stress biomarkers of Daphnia magna[J]. Chemosphere, 2016, 169: 107–116.
[26] PARLAK V. Evaluation of apoptosis, oxidative stress responses, AChE activity and body malformations in zebrafish (Danio rerio) embryos exposed to deltamethrin[J]. Chemosphere, 2018, 207: 397–403.
Development effects of Capecitabine on the non-target organism of zebrafish embryo
WANG Lili1, ZHAO Wenguang2, DING Zhuang1, WANG Zhengping1, ZHAO Yannan1, HAN Jun1,3,*
1. Liaocheng University, Institute of Biopharmaceutical Research, Liaocheng, Shandong 252000, China 2. Liaocheng Infectious Disease Hospital, Liaocheng,Liaocheng,Shandong 252000, China 3. Liaocheng Hi-tech Biotechnology Co., Ltd., Liaocheng,Shandong 252000, China
To investigate the deleterious effects of Capecitabine (CAP) on non-target aquatic organisms, the developmental toxicity of CAP to zebrafish embryos and its effects on the antioxidant enzymes of zebrafish fry were studied. The exposure experiment showed that CAP could cause death and deformity of zebrafish embryos. When the CAP exposure concentration was higher than 20 μg·L-1, the mortality rate andmalformation rate of the treated embryos were significantly higher than those of the control. In antioxidant enzyme activities assays, results revealed that when exposure to 0.2 μg·L-1CAP, the superoxide dismutase (SOD) and catalase (CAT) activities in zebrafish fry increased significantly (< 0.05), implying that low concentration of CAP could trigger the oxidative stress response of zebrafish. When the CAP concentration was higher than 20 μg·L-1, the SOD and CAT activities greatly decreased, indicating that the oxidative damage caused by CAP exceeded the restoration capability of zebrafish larvae and caused fatal injuries. In this paper, the developmental toxicity and oxidative stress were used to explore the potential hazards of CAP on the non-target organisms, and to provide a scientific basis for its ecological effects.
Capecitabine; non-target organism; zebrafish embryo; developmental toxicity; oxidative damage
10.14108/j.cnki.1008-8873.2019.04.013
X174
A
1008-8873(2019)04-085-06
2018-06-15;
2018-09-18
山东省科技发展计划项目(2014GSF118121); “重大新药创制”科技重大专项2017年度立项课题(2017ZX09201003); 山东省抗体制药协同创新中心(聊城大学)开放课题项目(CIC-AD1828)
王利利(1987—), 女, 硕士研究生, 从事药物在环境中的生态效应研究, E-mail: 772897523@qq.com
韩军, E-mail: junhanmail@163.com
王利利, 赵文广, 丁壮, 等. 卡培他滨对非靶标生物斑马鱼胚胎的发育毒性研究[J]. 生态科学, 2019, 38(4): 85-90.
WANG Lili, ZHAO Wenguang, DING Zhuang, et al. Development effects of Capecitabine on the non-target organism of zebrafish embryo[J]. Ecological Science, 2019, 38(4): 85-90.
