92例残胃癌的临床病理特征及预后*
2019-09-20刘万鲁李永柏王润华
刘万鲁, 李永柏, 王润华
(贵州省人民医院, 贵州 贵阳 550002)
残胃癌(gastric stump cancer,GSC)最初的定义是指因胃十二指肠溃疡病行远端胃大部切除术5年后在残胃出现的原发癌[1]。 2017年日本胃癌协会公布的最新版《胃癌处理规约》仍沿用“残胃上的癌”的定义,且不区分首次手术胃疾病性质、切除范围、重建方式,并且没有约束特定时间间隔[2]。远端胃切除术后GSC的发病率占所有胃癌的1%~2%[3],由于上世纪六七十年代,胃大部切除术为胃十二指肠溃疡的流行术式,GSC的发生通常需要较长的潜伏期;其次胃癌术后生存率的提高,GSC发病率有所上升[4]。早期GSC缺乏特异性的临床症状,临床上确诊时多为症状较为明显的进展期GSC,因而根治性切除率较低(38%~40%)、且预后差[5]。GSC因发病率低,即使扩大了GSC的研究范围,对临床病理特征及预后仍不是很明确,相关研究对首次术后GSC发生间隔时间、肿瘤位置、治疗方式、预后等临床病理特征报道差异较大。本研究根据首次疾病的性质分组来分析GSC的临床病理特征、生存率及预后的危险因素。
1 对象与方法
1.1 对象
收集1998年1月-2018年6月接受治疗的GSC患者的临床病理资料,纳入标准:(1)因原发疾病行远端胃大部切除术后,残胃上发生癌的患者;(2)首次病变为胃癌者,当时手术为根治性切除;(3) 此次疾病的病理组织学确诊为GSC,且未发生远处转移。排除标准:(1)初次病变内镜下切除的患者;(2)合并其他恶性疾病;(3)初次病变为胃癌,且当时已发生远处转移;(4)病例资料不全的患者 。
1.2 观察指标
入选研究对象按照初次胃疾病的良、恶性分为:胃癌术后GSC-M (initial diseases were malignant,GSC-M)组、胃良性疾病术后GSC-B(initial diseases were benign,GSC-B)组,分别比较两组患者的性别、年龄、首次胃手术后诊断GSC间隔时间、首次手术的吻合方式、GSC肿瘤部位、肿瘤大小、肿瘤组织病理分化程度、病理分期(TNM)、治疗方式等临床病理特征,对两组患者进行生存分析并比较生存率。对初步诊断为GSC、符合研究标准的患者,通过电话、门诊复查、住院信息随访了解预后及生存情况。GSC生存期指确诊到患者死亡时间,存活患者记录最后一次随访时间,以月为单位,随访截止日期至2018年8月1日;对失访病例,失访按最后一次随访日期计算。失访病例及随访终点截止病例按统计分析要求列为截尾数据处理。
1.3 统计学分析
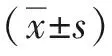
2 结果
2.1 基础资料
纳入的GSC患者135例,占同期所有胃癌患者的5.90%,排除临床资料不全的43例,最终纳入92例GSC,男性比例明显高于女性,GSC-M组59例,GSC-B 33例,两组患者临床基础资料比较结果见表1。
2.2 病理学分型及分期
GSC-M组与GSC-B两组在组织学T分期(P=0.219)、术后淋巴结分期(P=0.319)、淋巴结阳性率(P=0.428)、术后TNM分期(P=0.230)及理分化程度(P=0.662)比较,差异无统计学意义,见表2。

表1 两组患者基础资料比较Tab.1 General information comparison
2.3 肿瘤标志物
GSC-B组患者肿瘤标志物CEA、CA19-9、CA125指标升高人数分别为11例(33.3%)、5例(15.2%)、4例(12.1%); GSC-M组患者肿瘤标志物CEA、CA19-9、CA125指标升高人数分别为32例(54.2%)、23例(39.7%)、14例(23.7%); GSC-B组CA19-9升高患者比例高于GSC-M组,差异有统计学意义(P=0.015),见表3。
2.4 GSC手术方式及预后
GSC-B 组与GSC-M组术后局部复发时间、远处转移及转移时间、淋巴转移、住院时间比较,差异无统计学意义(P>0.05),GSC-M组5年生存率低于GSC-B组,差异有统计学意义(P<0.05),见表4。

表2 两组患者GSC病理分型及分期比较(n,%)Tab.2 Edmondson-steiner and staging comparison of both groups

表3 两组患者肿瘤标志物比较(n,%) Tab.3 Carcinoma marker comparison of both groups

表4 两组组患者手术及预后 Tab.4 Gastrectomy and prognosis of both groups
2.5 生存分析
92例GSC患者中位随访时间77.7(6~234)个月,68例(73.9%)随访至截止日期,期间44例死亡,5年累积生存率34.3%;总生存曲线见图1。GSC-B与GSC-M整体5年累积生存率分别为56.5%及27.3%,两组比较,差异有统计学意义(P=0.029),生存曲线见图2。

图1 92例GSC患者5年累积生存率曲线 Fig.1 5 years total survival rate curve of 92 GSC patients

注:1为GSC-B,2为GSC-M。图2 两组GSC患者5年累积生存率比较Fig.2 5 years total survival rate comparison of both groups of GSC patients
2.6 GSC预后多因素 Cox 回归分析
单因素结果显示,首次疾病性质、发病间隔时间(10年)、首次吻合方式、根治性切除、病理T分期、淋巴结转移率、术后病理分期、术后局部复发及远处转移与预后相关;将以上因素纳入Cox 比例风险回归模型,在多变量分析中,根治性切除(P=0.009)、病理T分期T3/T4(P=0.001)、淋巴结阳性(P=0.001)、低分化(P=0.024)是GSC预后的独立危险因素;首次疾病性质(P=0.450)、发病时间间隔(≥10年,P=0.143)、首次吻合方式(Billroth Ⅰ,P=0.064;Billroth Ⅱ,P=0.113)、肿瘤位置(吻合口,P=0.731;非吻合口,P=0.48)、肿瘤分期(P=0.478)因素不具有统计学意义。

表5 GSC预后的影响因素Cox回归多分析Tab.5 Cox regression analysis of influence factors of GSC prognosis
3 讨论
GSC作为胃癌的一种特殊类型,约占同期胃癌患者的1%~8%[6-7],1922年Balfour[1]首次报道了GSC,目前普遍认为良性疾病术后十二指肠胃内容物的返流和幽门螺杆菌感染导致的慢性萎缩性胃炎、肠上皮化生是重要的致癌因素[8-9]。然而随着溃疡病抑酸药物的优异疗效,使大多数患者免于手术,早中期胃癌的检出率及预后的提高,使胃癌术后残胃再发癌的患者越来越多,也使得GSC的发病机制,临床病理特征,预后发生了改变。本研究分析了GSC的临床病理特征,比较GSC-M和GSC-B临床病理特征的差异,分析影响GSC预后的相关因素。
本研究发现GSC男性比例明显高于女性,男女之比为5.6∶1, GSC-M男女比例为3.5∶1,GSC-B男女比例为32∶1,与文献报道一致[10-12],可能与胃癌和消化性溃疡好发于男性有关。本研究中GSC患者中位年龄为 65岁,与既往研究报道中位年龄 67岁无明显的差异[12]。胃癌术后诊断GSC 大多发生在10年以内[13-14],在本研究中GSC-M平均间隔年限为45.25个月,只有6.8%间隔在10年以上。GSC可发生于残胃的任何部位,远端胃切除术后胃肠内容物的返流和血清胃泌素的下降是致癌因素,对于GSC-M,因初次病变为胃癌,具有隐匿和跳跃性转移特性,部分患者有脉管内癌栓,微血管浸润,而良性疾病则不存在这种特性,这也可能是胃癌术后发生GSC的时间间隔短的原因之一[15-17]。
在胃肠道肿瘤中CEA 是最常见的肿瘤标志,胃癌患者中,17.7%~32.5%的患者通常有CEA升高,与胃癌的分期和预后相关[18-19]。 本研究中,46.7%患者的CEA 的升高,原发疾病为胃癌的患者升高率高于原疾病为消化性溃疡的患者(54.2%比33.3%),定期复查 CEA 的不但可以监测胃癌的发生,也可以监测GSC的发生。但本研究 CEA的升高与预后并无相关性。
GSC的治疗主要以根治性手术切除为主,辅助放化疗、免疫及生物治疗,根治性切除后GSC 5年生存率为22.2%~57%, N2及以上淋巴结转移者,生存率显著降低[20-22],在本研究中GSC 5年整体生存率为34.3%,GSC-B组 5年生存率高于GSC-M组,淋巴结阳性5年生存率44.11%,无淋巴结转移者5年生存率58.3%。几乎所有的研究一致表明,根治性切除是最重要的独立预后因素,一些研究报道了TNM分期、肿瘤部位、大小是重要的独立预后因素[23]。在本研究中根治性切除、病理T分期T3/T4、淋巴结阳性、低分化是独立的预后因素,肿瘤的发生位置及首次疾病性质与生存无关。
综上,本研究分析了首次疾病性质不同术后发生GSC患者的临床病理特征,发现根治性切除、病理T分期T3/T4、淋巴结阳性、低分化是GSC预后的独立危险因素。
