长链非编码RNA ITGβ2-AS1对胰腺癌细胞增殖和侵袭及迁移能力的影响*
2019-09-20陈世裕喻超潘耀振陈玲李琳杨哲豪吕彦霖邓路孙诚谊
陈世裕,喻超,潘耀振,陈玲,李琳,杨哲豪,吕彦霖,邓路,孙诚谊**
(1.贵州医科大学,贵州 贵阳 550004;2.贵州医科大学附院 肝胆外科,贵州 贵阳 550004;3.贵州医科大学 肝胆胰脾重点实验室,贵州 贵阳 550004;4.贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
胰腺癌(pancreatic cancer,PC)是全球癌症相关死亡率最高的第四大疾病[1-2],尽管现代医学技术取得了显著的进步,但PC病人的生存率仍然较低,5年总生存率仅为7%,平均生存时间<9个月[2-4]。早期诊断PC、采取恰当的手术方式和化疗,是治疗PC的有效方法[5-6];但由于PC早期缺乏明确诊断的分子标志物,因此大部分PC患者在明确诊断时已经失去了手术切除机会,治疗预后不良。因此,研究PC细胞的增殖、侵袭及迁移的分子机制,对治疗PC及改善其预后具有重要的意义。长链非编码RNA(long non-coding RNA,LncRNA)是一类不编码蛋白质的 RNA,主要参与细胞内转录激活、转录后调控蛋白功能等生物过程[7-8]。研究表明,LncRNA 能通过表观遗传修饰、RNA 降解及翻译后修饰等方式激活促癌基因或沉默抑癌基因,参与肿瘤的发生和转移等过程[9-11]。整合素蛋白家族 (integrin family,ITG) 是广泛分布于细胞表面的四类细胞黏附分子之一,是由α及β两个亚基组成的异源二聚体跨膜蛋白整合素家族,可以改变肿瘤的增殖、侵袭及迁移等多种生物学功能[12-14];整合素 β2 (ITGβ2)主要在各种白细胞的表面表达,并能够和肿瘤细胞表面的黏附分子结合,从而赋予肿瘤细胞向远处转移的能力[15-17]。LncRNA ITGβ2-AS1起源于ITGβ2启动子,LncRNA ITGβ2-AS1通过上调ITGβ2的表达从而促进乳腺癌的侵袭和迁移[18]。但是,LncRNA ITGβ2-AS1是否参与PC的发生及发展尚待进一步研究,本项研究主要从增殖、侵袭及迁移等方面研究LncRNA ITGβ2-AS1在PC中所起到的作用和分子机制。
1 材料与方法
1.1 细胞株与主要试剂
实验所用细胞株为中山大学肿瘤防治中心惠赠,胎牛血清(FBS)、胰蛋白酶(TRYPSIN)、DMEM及RPMI-1640培养基购自美国gibco公司,Cell Counting Kit-8(CCK-8)试剂盒购自Beyotime公司,Transwell侵袭小室购自美国Corning公司,Matrigel购自美国BD公司,RNA提取试剂Trizol购自美国Invitrogen公司,ITGβ2-AS1-sh购自RIBOBIO公司,逆转录试剂盒及SYBR Premix ExTaq试剂盒均购自日本TaKaRa公司。
1.2 方法
1.2.1生物信息学分析 利用cBioPortal网站在线分析癌症基因组图谱(TCGA)数据库分析179例PC癌组织及171例癌旁组织ITGβ2-AS1的表达情况。
1.2.2细胞培养 人正常胰腺导管上皮细胞株HPDE和人PC细胞株AsPC-1、CFPAC-1、PANC-1、MIA PaCa-2、Capan-2、BxPC-3、Hs766T及SW1990分别使用含10%FBS的DMEM及RPMI-1640培养基培养于37 ℃、含5% CO2的恒温恒湿培养箱中。
1.2.3ITGβ2-AS1 mRNA表达 选择处于对数生长期的各组细胞株,提取其总RNA,分别测量A260/A280时的吸光度,选取吸光度值在1.8~2.0的样品进行实验。依照逆转录试剂盒的说明,分别将样品逆转录为cDNA,再选择GAPDH作为内参,使用SYBR Premix ExTaq试剂盒进行qPCR实验。
1.2.4细胞增殖 根据mRNA表达的结果,选取表达升高倍数最大的PANC-1细胞作为细胞功能学实验所用细胞株,利用慢病毒载体稳定转染,构建ITGβ2-AS1干扰阴性对照组(Negative Control组)及ITGβ2-AS1干扰组(ITGβ2-AS1-sh组)。分别取对数生长期的两组细胞消化并计数,按照3×103/孔的数量接种于96孔板中,设6、24、48及72 h时间点,在每个对应的时间点再分别设5个复孔,每孔均加入CCK-8试剂10 μL,于避光条件下置37 ℃恒温恒湿细胞培养箱孵育2 h后取出,轻微震荡摇匀后,置酶标仪于450 nm波长处测定OD值。
1.2.5平板克隆实验 分别取1.2.4项下对数生长期的两组细胞消化并计数,于6孔板中种植1×103个细胞,置37 ℃恒温恒湿细胞培养箱中培养10~14 d后,用4%多聚甲醛固定20~30 min、0.25%结晶紫染液染色20~30 min,于流水中冲洗数遍后置烘箱中烘干,拍照记录。
1.2.6细胞划痕实验 分别取1.2.4项下对数生长期的两组细胞消化并计数,于6孔板中种植5×105个细胞,待其均匀铺开成单层并长至90%时,用200 μL枪头置各孔上方的直尺垂直均匀下划,用PBS清洗干净后、加入不含FBS的培养基,分别于0及48 h置显微镜下拍照记录。
1.2.7细胞侵袭及迁移实验 分别取1.2.4项下处于对数生长期的两组细胞,用无血清培养基饥饿处理24 h后消化并计数,在上室种植含2×105个细胞的无血清培养基细胞重悬液200 μL(种植前上室将Matrigel与无血清培养基按照1 ∶8的比例铺上稀释过的 Matrigel 60 μL),下室加入700 μL完全培养基,置37 ℃恒温恒湿细胞培养箱中培养24~30 h后取出,用4%多聚甲醛固定20~30 min、0.25%结晶紫染液染色20~30 min,用棉签清洗上室、烘箱烘干,置显微镜下拍照记录(迁移实验不加Matrigel,其余步骤同上)。
1.3 统计学处理
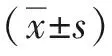
2 结果
2.1 ITGβ2-AS1表达
分析TCGA数据库结果如图1A所示,ITGβ2-AS1在PC组织中的表达显著高于癌旁组织(P<0.05);如图1B的qPCR实验结果所示,ITGβ2-AS1在8株人PC细胞中的表达显著高于人正常胰腺导管上皮细胞HPDE,其中在PANC-1细胞株中表达升高的倍数最大,差异具有统计学意义(P<0.05)。

(1)与癌旁组织比较,P<0.05;(2)与HPDE细胞比较,P<0.05。图1 ITGβ2-AS1在PC组织及细胞中的表达Fig.1 Expression of ITGβ2-AS1 in pancreatic cancer tissues and cells
2.2 ITGβ2-AS1对PC细胞增殖能力的影响
CCK-8实验结果显示,在PANC-1细胞培养48 、72 h时,ITGβ2-AS1-sh组与Negative Control组比较,450 nm波长处的OD值显著下降(见图2A);平板克隆实验结果显示,Negative Control组中细胞集落形成数量为(308.3±12.7)个,ITGβ2-AS1-sh组为(165±9.4)个(见图2B);结果显示干扰ITGβ2-AS1后,PC细胞的增殖能力显著下降,差异有统计学意义(P<0.05)。
2.3 ITGβ2-AS1对PC细胞迁移及侵袭能力的影响
细胞划痕实验结果显示,在相同时间点,ITGβ2-AS1-sh组与Negative Control组比较,PC细胞的迁移距离变短(见图3A);Transwell实验结果显示,Negative Control组中PC细胞的数目为迁移(627±15)个、侵袭(428±32)个,ITGβ2-AS1-sh组为迁移(312±26)个、侵袭(239±21)个(见图3B);结果显示,干扰ITGβ2-AS1后,PC细胞的迁移及侵袭能力显著下降,差异有统计学意义(P<0.05)。

注:(1)与ITGβ2-AS1-sh组比较,P<0.05。图2 ITGβ2-AS1对PC细胞增殖能力的影响Fig.2 Effect of ITGβ2-AS1 on proliferation of pancreatic cancer cells

注:(1)与ITGβ2-AS1组比较,P<0.05。图3 ITGβ2-AS1对PC细胞迁移和侵袭能力的影响Fig.3 Effect of ITGβ2-AS1 on migration and invasion of pancreatic cancer cells
2.4 ITGβ2-AS1对PC细胞ITGβ2表达水平的影响
ITGβ2-AS1与ITGβ2的相关性回归分析结果显示,ITGβ2-AS1与ITGβ2的表达呈正相关(P<0.05,r=0.41)。qPCR和Western blot实验结果显示,干扰ITGβ2-AS1后,ITGβ2在mRNA和蛋白水平上的表达均显著下降,提示ITGβ2-AS1与ITGβ2存在共表达关系,干扰ITGβ2-AS1后ITGβ2的表达下降,差异有统计学意义(P<0.05)。见图4。

注:(1)与Negative Control组比较,P<0.05。图4 ITGβ2-AS1对PC细胞ITGβ2表达水平的影响Fig.4 Effect of ITGβ2-AS1 on the expression of ITGβ2 in pancreatic cancer cells
3 讨论
目前,越来越多的研究表明LncRNA在包括PC在内的多种肿瘤的发生发展过程中发挥着重要的作用[19-22]。已有研究报道LncRNA ITGβ2-AS1在乳腺癌组织中的表达与癌旁组织相比明显上调,预示着临床上的不良预后[18]。肿瘤细胞的增殖、侵袭及迁移等恶性生物学行为特性是罹患肿瘤的病人治疗困难以及预后不良的最主要原因。因此,本课题组围绕LncRNA ITGβ2-AS1在PC的病理生理过程中的作用展开研究。TCGA数据库分析结果显示,ITGβ2-AS1在PC组织中的表达与癌旁组织相比明显上升。本研究进一步通过qPCR实验发现,ITGβ2-AS1在人PC细胞中的表达与人正常胰腺导管上皮细胞相比显著上调。因此,本研究推测ITGβ2-AS1可能与PC的恶性生物学行为密切相关。
有研究报道,ITGβ2-AS1可以通过上调EMT相关蛋白ITGβ2的表达从而促进乳腺癌细胞的侵袭和迁移[18]。因此,本研究推测可以通过干扰ITGβ2-AS1从而抑制PC细胞的侵袭及迁移。本研究进一步通过一系列相关的细胞功能学实验深入研究,CCK-8、平板克隆、细胞划痕及Transwell实验结果提示,干扰ITGβ2-AS1后,PC细胞的增殖、迁移及侵袭能力显著下降。qPCR及Western blot实验结果提示,干扰ITGβ2-AS1后ITGβ2的表达下降。推测ITGβ2-AS1可能具有调控PC细胞增殖、侵袭和迁移的作用。
综上所述,本项研究在体外初步验证了在干扰LncRNA ITGβ2-AS1后,PC细胞的增殖、侵袭及迁移能力受到抑制,有望为寻求治疗PC的新型分子靶点提供思路。然而,其具体的作用途径及分子生物学机制尚未明确,还需要进一步的探索及研究予以阐明。
