17β-雌二醇素对人三阴乳腺癌细胞增殖和凋亡的影响*
2019-09-20张莹金爱王旭东
张莹, 金爱, 王旭东
(贵州医科大学 基础医学院 生理学教研室, 贵州 贵阳 550004)
三阴乳腺癌(triple negative breast cancer,TNBC)在各种乳腺癌亚型中具有较大的浸润性,经常发生局部复发和器官转移,是全世界女性最常见的恶性疾病之一[1]。17β-雌二醇素(17β-Estradiolum,E2)主要由卵巢分泌产生,是促进女性第二性征发育和性器官成熟的重要激素,能够促进TNBC细胞的活性、增殖及转移[2-3]。钙激活中性蛋白酶(calcium-activated neutral protease,CANP或Calpain)是Ca2+依赖性的半胱氨酸蛋白酶水解家族,被某些特异性蛋白水解后可调节多种酶和蛋白质的生物学功能,并且在细胞增殖、信号转导等方面发挥着重要作用[4-6]。目前已有研究显示,E2可通过CANP介导多种癌细胞的周期蛋白水解、增殖及迁移,也可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路介导CANP2影响TNBC的迁移及黏附[7]。Hippo信号通路首先在果蝇中发现,是由G蛋白偶联受体(G protein-coupled estrogen receptor,GPER)和磷脂酰肌醇激酶(phosphatidylinositol 3-kinase,PI3K)调节[8];Yes相关蛋白(yes-associated protein,YAP)是Hippo信号传导途径的主要下游因子,参与器官生长、组织修复,在多种恶性肿瘤中被广泛激活,YAP过表达可以刺激肿瘤的发生和转移,因此Hippo-YAP信号通路已被认为是肿瘤发生和转移的重要因素[9-10]。另有研究显示,干扰YAP基因的表达能有效抑制乳腺细胞的增殖并促进凋亡[11],但CANP与YAP的相关性研究尚未见报道。因此,本研究通过细胞分子生物学手段,探讨E2对TNBC细胞增殖和凋亡的生物学行为及CANP-YAP信号通路的介导作用,力图为探寻TNBC的临床有效治疗提供实验依据。
1 材料和方法
1.1 材料和试剂
1.1.1材料 人源乳腺癌细胞系MDA-MB-231及MDA-MB-468分别购自中国科学院昆明细胞库及中国科学院上海细胞库。
1.1.2试剂 E2、钙蛋白酶抑制剂(calpeptin,Cal)、钙蛋白酶抑制剂Ⅲ(calpain Inhibitor Ⅲ,CI Ⅲ)、噻唑蓝(methylthiazolydiphenyl-tetrazolium bromide ,MTT)和二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司,YAP抗体购自美国CST公司,蛋白内参(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自中国巴傲德生物科技有限公司,羊抗小鼠IgG-HRP和羊抗兔IgG-HRP购自美国Santa Cruz公司,全细胞裂解液(radio-immunoprecipitation asay,RIPA)、蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)及BCA蛋白定量试剂盒(bicinchoninic acid,BCA)购自中国碧云天生物技术有限公司,广谱磷酸酶抑制剂混合物和广谱蛋白酶抑制剂混合物购自中国博士德生物公司。
1.2 方法
1.2.1细胞培养 MDA-MB-231及MDA-MB-468细胞均采用含有10%血清和1%青霉素-链霉素的L-15培养基,在25 cm2不透气培养瓶于5% CO2的37 ℃恒温无菌细胞培养箱中隔绝培养48 h。
1.2.2实验分组 实验分为4组,DMSO组加1‰ DMSO处理细胞,E2组用10 nmol/L E2处理细胞,E2联合Cal组在用10 μmol/L Cal预处理细胞2 h后、再加入10 nmol/L E2处理细胞,E2联合CI Ⅲ组在用10 μmol/L CI Ⅲ预处理细胞2 h后、再加入10 nmol/L E2处理细胞。
1.2.3MTT实验 取所有细胞以每孔8 000个细胞密度接种于96孔细胞培养板中,待48 h后,每孔加入MTT溶液20 μL,放回细胞培养箱孵育3 h,弃上清,每孔再加DMSO 150 μL,室温下适当摇晃孵育20 min至甲臜完全溶解,采用酶标仪测定每个孔490 nm处的吸光度值。所有过程均避光操作。
1.2.4细胞平板克隆形成试验 收集生长状态良好的两种细胞,按每孔200个细胞接种于6孔板中。按照实验分组1.2.2加药处理,于细胞培养箱中培养2~3周,培养板中有明显细胞集落时停止培养;4%多聚甲醛固定20 min,0.1%结晶紫水染色10 min,磷酸盐缓冲液(phosphate buffer saline,PBS)洗去非细胞染色,自然晾干后10倍物镜下拍照计数,并计算克隆形成率[克隆形成率(%)=克隆数/200×100% ]。
1.2.5细胞凋亡试验 用无乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)的0.25%胰酶消化收集1.2.2项下加药处理的细胞,用预冷的PBS洗涤3次,按照凯基Annexin V-FITC/PI细胞凋亡试剂盒说明操作,加入重悬分散细胞500 μL,加入Annexin V-FITC 5 μL充分混匀低温静置5 min,再加入碘化丙啶5 μL 震荡混匀、避光孵育5~15 min,1 h内在倒置荧光显微镜下随机取4个视野拍照记录,并用Image J软件检测荧光强度。
1.2.6蛋白印迹(Western blot)检测 所有细胞培养到细胞生长对数期时,加入新鲜配置的全细胞裂解液(RIPA ∶PMSF ∶磷酸酶抑制剂 ∶多种蛋白酶抑制剂=100 ∶1 ∶1 ∶1)充分裂解细胞,置于冰上水平振摇20 min;用刮刀收取总蛋白后采用BCA法测定蛋白浓度,以30 μg蛋白上样,10%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)至溴酚蓝条带到玻板下缘1 cm处,在300 mA恒定电流下将分离蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%伊利脱脂奶粉室温封闭2 h,按实验要求稀释抗体大肿瘤抑制基因(large tumor suppressor gene 1,LATS1)(1 ∶5 000)、YAP(1 ∶1 000)、GAPDH(1 ∶10 000),4 ℃摇晃孵育过夜;磷酸盐缓冲液(tris-buffered saline tween,TBST)每10 min洗膜3次,加入相应二抗(1 ∶4 000)室温振摇孵育2 h,TBST洗膜3次,10 mi n/次;将化学发光试剂均匀滴加到PVDF膜上,Syngene Imaging系统进行成像,条带灰度处理分析目的蛋白表达量[目的蛋白表达量=目的条带的光密度(optical density,OD)/内参OD×100%],实验结果重复3次。
1.3 统计学方法
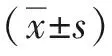
2 结果
2.1 E2对MDA-MB-231及468细胞增殖和凋亡的影响
MTT实验结果显示,E2组MDA-MB-231及468细胞的增殖率均显著高于DMSO组,差异有统计学意义(P<0.05,或P<0.01),见图1A;细胞平板克隆形成试验结果显示,E2组MDA-MB-231及468细胞的菌落形成率均显著高于DMSO组,差异有统计学意义(P<0.05),见图1B、1C;细胞凋亡试验结果显示,E2组MDA-MB-231及468细胞荧光凋亡强度显著低于DMSO组(P<0.05),见图1D。

注:A为MTT实验,B为平板克隆实验,C为平板克隆实验的直条图,D为荧光凋亡实验; 与DMSO组比较,(1)P<0.01,(2)P<0.05。图1 E2对MDA-MB-231及468细胞增殖率和凋亡的影响Fig.1 Effect of E2 on proliferation and apoptosis of MDA-MB-23 and 468 cells
2.2 E2对MDA-MB-231及468细胞的YAP蛋白表达的影响
蛋白印迹检测结果显示,E2组MDA-MB-231、468细胞中YAP蛋白表达显著高于DMSO组,差异有统计学意义(P<0.05),见图2。提示E2能上调MDA-MB-231和468细胞YAP表达。

注:(1)与DMSO组比较,P<0.05。 图2 E2对MDA-MB-231及468细胞的YAP蛋白表达影响Fig.2 Effects of E2 on YAP protein expression in MDA-MB-231 and 468 cells
2.3 CANP抑制剂对E2诱导MDA-MB-231及468细胞增殖和增强抗凋亡能力的影响
MTT实验结果显示,E2联合Cal组和E2联合CI Ⅲ组MDA-MB-231、468细胞的增殖率均显著低于E2组,差异有统计学意义(P<0.05,或P<0.01),见图3A;细胞平板克隆形成试验结果显示,E2联合Cal组和E2联合CI Ⅲ组MDA-MB-231、468细胞的菌落形成率均显著低于E2组,差异有统计学意义(P<0.05),见图3B、3C;细胞凋亡试验结果显示,E2联合Cal组和E2联合CI Ⅲ组MDA-MB-231、468细胞的荧光凋亡强度显著高于E2组,见图3D。

注:A为MTT实验,B为平板克隆实验,C为平板克隆实验的直条图,D为荧光凋亡实验; 与E2组比较,(1)P <0.05,(2)P <0.01。图3 CANP抑制剂对E2诱导MDA-MB-231及468细胞增殖和增强抗凋亡能力的影响Fig.3 Effects of CANP inhibitors on proliferation and anti-apoptotic ability of MDA-MB-231 and 468 cells induced by E2
CANP抑制剂对E2诱导MDA-MB-231及468细胞的YAP表达影响
Western blot结果显示,E2联合Cal组和E2联合CI Ⅲ组中MDA-MB-231、468细胞YAP蛋白表达均显著高于E2组,差异有统计学意义(P<0.05,或P<0.01),见图4。

注:与E2组比较,(1)P <0.05,(2)P <0.01。图4 CANP抑制剂对E2诱导MDA-MB-231及468细胞YAP表达的影响(Western blot)Fig.4 Effects of CANP inhibitors on E2-induced YAP expression in MDA-MB-231 and 468 cells
3 讨论
乳腺癌是世界范围内影响女性生命健康的最常见疾病,也是女性癌症患者死亡的主要原因,发病率呈现逐渐升高的趋势[12]。目前该疾病已成为全球性问题,预计在未来几年内发病率和死亡率会逐年增加,并有向年轻化发展的趋势[13]。因此探讨TNBC发病机制、寻找治疗方法是目前全球学者都关注的问题。有证据表明,E2是导致乳腺癌恶性生长的重要原因,大多数人类乳腺癌初期均为雌激素依赖性[14]。雌激素受体(estrogen receptor,ER)核心蛋白在正常情况下受到严格调控,病理条件下表达缺失[15]。ER核因子或ER核外信号调节失控可促进ER阳性乳腺癌细胞的转移[16]。有文献报道,雌激素可通过GPER促进与肿瘤发生密切相关的Homeobox(HOX)转录本反义基因上调和诱导乳腺癌细胞迁移[17]。本研究发现,在MDA-MB-231、468细胞中,E2刺激可明显使上皮—间质转化(epithelial-mesenchymal transition,EMT)相关蛋白表达上调,并促进细胞活性增殖、迁移、侵袭。钙蛋白酶1和钙蛋白酶2在细胞中普遍表达,是细胞内非溶酶体细胞质需要钙激活的半胱氨酸内肽酶[18]。CANP的内源特异性抑制剂是钙蛋白酶抑制蛋白,具有恶性和良性组织中酶表达之间的差异[19]。Salehin等[18]研究表明,CANP信号通路参与介导包括HER2(+)或人乳腺腺癌细胞SKBR3和MDA-MB-231凋亡;也有报道称,在MAPK信号的作用下CANP2具有影响细胞黏附与迁移的能力[20]。以上研究表明,在癌症中CANP与肿瘤的许多恶性行为学相关。YAP是人类恶性肿瘤中普遍激活的高度相关的转录调节因子,最近的研究表明,YAP对于癌症的发生或大多数实体瘤的生长是必需的,可活化诱导癌症干细胞属性、增殖、药物抗性和转移[21]。本研究结果表明,Cal和CI Ⅲ能明显抑制E2对模型细胞增殖、抵抗细胞凋亡和细胞内YAP蛋白表达的影响,提示E2对TNBC细胞的恶性增殖及YAP蛋白表达的影响可能与CANP信号通路相关。
综上所述,本研究结果表明,E2具有诱导模型细胞增殖、抵抗细胞凋亡的能力,Cal和CI Ⅲ可以阻断E2诱导的上述生物学效应,提示E2可通过CANP-YAP信号通路促进肿瘤细胞的恶性生物学行为。
