高效液相色谱-串联质谱法测定牛肉中泰拉霉素代谢物残留量研究
2019-09-20杨修镇陈玲尹伶灵张呈军牛华星懂玲玲吉利伟
杨修镇 陈玲 尹伶灵 张呈军 牛华星 懂玲玲 吉利伟
高效液相色谱-串联质谱法测定牛肉中泰拉霉素代谢物残留量研究
杨修镇 陈玲 尹伶灵 张呈军 牛华星 懂玲玲 吉利伟
(山东省兽药质量检验所 山东省畜产品质量安全监测与风险评估重点实验室 山东 济南 250022) (山东舍里乐药业有限公司 山东济宁)
建立牛肉中泰拉霉素代谢物的高效液相色谱-串联质谱检测方法,色谱柱为C18(100mm× 2.1mm,1.7μm),以0.1%甲酸水-0.1%甲酸甲醇为流动相进行梯度洗脱,采用电喷雾离子源正离子检测模式(ESI+)和多反应监测(MRM)模式测定,基质匹配标准曲线法定量。结果表明,泰拉霉素代谢物进样浓度在1~100ng/ml范围内与峰面积呈良好的线性关系(r2=0.9999);方法检出限和定量限分别为10μg/kg和30μg/kg;定量限、1/2MRL、MRL和2MRL 4个添加水平下,回收率在70%~110%之间,相对标准偏差小于10%。本方法简便、准确、快速、灵敏,适用于牛肉中泰拉霉素代谢物残留量的检测。
高效液相色谱-串联质谱 牛肉 泰拉霉素代谢物
泰拉霉素是一种动物专用的新型半合成的大环内酯类抗生素,与其他许多大环内酯类抗生素不同的是,其具有3个碱性氨基基团,酸解离常数(pKa)分别为8.6、9.6、9.9,这些特征有利于穿通革兰氏阴性菌的外膜[1]。研究表明[2, 3],与泰乐菌素、替米考星、恩诺沙星和氟苯尼考等药物相比,泰拉霉素具有抗菌活性强、药物代谢动力学特征卓越、临床疗效好、减缓细菌耐药性产生等优点,在畜牧业中具有广阔的应用前景。我国农业部在2008年第957号公告中首次批准进口泰拉霉素原料药和泰拉霉素注射液在国内使用[4]。EMA[5]和FDA[6]以泰拉霉素代谢物CP-60300为代谢标示物,并通过每日允许最大摄入量和放射标记法残留消除试验规定了代谢标示物最大残留限量。基于此本文对牛肉中泰拉霉素代谢标示物的残留检测方法进行了研究。
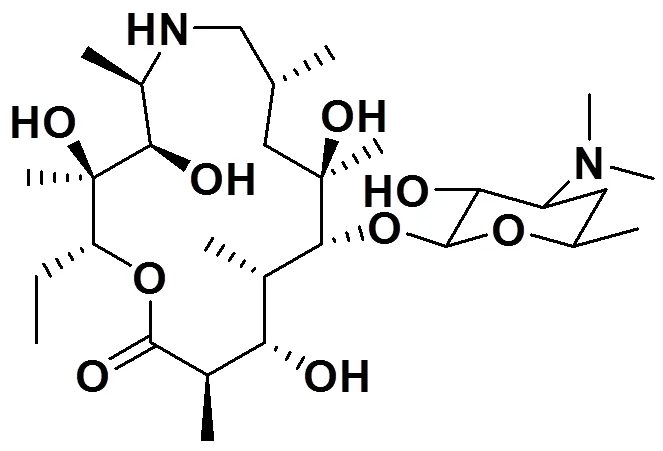
图1 泰拉霉素代谢物化学结构式
1 材料与方法
1.1 仪器与材料
高效液相-串联质谱仪(Waters Xevo TQ-S):配有电喷雾离子源(ESI);电子天平(感量0.01g、0.00001g);高速分散均质机(FJ-200);多管涡旋振荡器(VX-III);离心机(CF16RXⅡ,转速10000 r/min);氮吹仪(N-EVAP-112);有机滤膜(0.22 µm);固相萃取仪装置及MCX固相萃取柱(Waters公司);泰拉霉素代谢物标准品(山东鲁抗舍里乐药业有限公司高新区分公司自制,含量94.7%);甲醇、甲酸为色谱纯;盐酸为优级纯;水为超纯水;其余试剂均为分析纯。
1.2 标准溶液配制
精密称取泰拉霉素代谢物标准品10mg,置10ml容量瓶中,用50%甲醇水溶液(含0.1%甲酸)溶解并稀释至刻度,配制成浓度各为1mg/ml的标准贮备液。精密量取泰拉霉素代谢物贮备液100µl,置10ml容量瓶中,用甲醇-0.1%甲酸溶液(1:9,v/v)稀释至刻度,配制成浓度为10µg/ml的溶液,再精密量取100µl,置10ml容量瓶中,用甲醇-0.1%甲酸溶液(1:9,v/v)稀释至刻度,配制成浓度为1µg/ml的溶液。
1.3 前处理条件
1.3.1 提取 根据参考文献[7]方法,称取匀浆后的样品1g(精确至0.01g)置50ml离心管中,加入2mol/L盐酸4.5ml,涡旋1min,振荡提取10min,置60℃水浴消化1h,10000r/min离心10min,收集上清液,下层加入2mol/L盐酸4.5ml,重复提取一次,合并上清液,加水定容至10ml,精密量取1ml加水4ml涡旋混匀,备用。
1.3.2 净化 MCX固相萃取柱依次用3ml甲醇和3ml水活化,取备用液全部过柱,再依次用0.1mol/L HCl、甲醇各3ml洗涤,抽干,用5%氨化甲醇5ml洗脱。洗脱液于50℃水浴氮气吹干,残余物中加甲醇-0.1%甲酸溶液(1:9,v/v)1ml涡旋1min复容,10000r/min离心5min,过0.22μm滤膜,滤液供液相色谱-串联质谱测定。
1.4 仪器条件
1.4.1 色谱条件 色谱柱:BEH C18(100mm×2.1 mm,1.7µm);流动相:A相为0.1%甲酸甲醇溶液,B相为0.1%甲酸水溶液;流速:0.3ml/min;进样量:5μl。柱温:35℃;洗脱条件如表1。
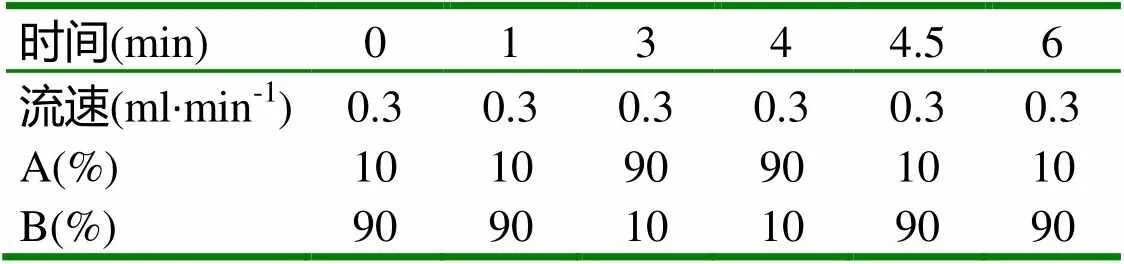
表1 流动相梯度洗脱条件
1.4.2 质谱条件 电离模式:电喷雾正离子(ESI+),毛细管电压:3.2kv,离子源温度:150℃,脱溶剂温度:450℃,脱溶剂气流速:550L/Hr,锥孔反吹气流速:50L/Hr;脱溶剂气、锥孔气、碰撞气均为高纯氮,采集方式:多反应监测(MRM),泰拉霉素代谢物的定性、定量离子见表2。

表2 泰拉霉素代谢物特征离子参考质谱条件
2 结果与分析
2.1 方法的专属性
选择20个牛肉空白样品按照1.3项方法处理后,在规定的测试条件下进行检测,未发现有假阳性结果,表明该方法的专属性良好。
2.2 基质效应
称取牛肉空白样品1g(精确至0.01g),平行六份,按照1.3项方法处理至“洗脱液于50℃水浴氮气吹干”。精密吸取浓度为1µg/ml的标准溶液100µl,置10ml容量瓶中,用甲醇-0.1%甲酸溶液(1:9,v/v)稀释至刻度,配制成浓度为10ng/ml的溶液,分别精密吸取1ml置空白样品吹干的基质中,涡旋1min复容,10000r/min离心5min,过0.22μm滤膜,在规定的测试条件下进行检测,所得面积均值和RSD如表3所示。结果表明,牛肉基质标准品溶液与溶剂标准品溶液相比有明显的基质抑制作用,因此,后续试验均采用基质匹配标准曲线进行定量校正。
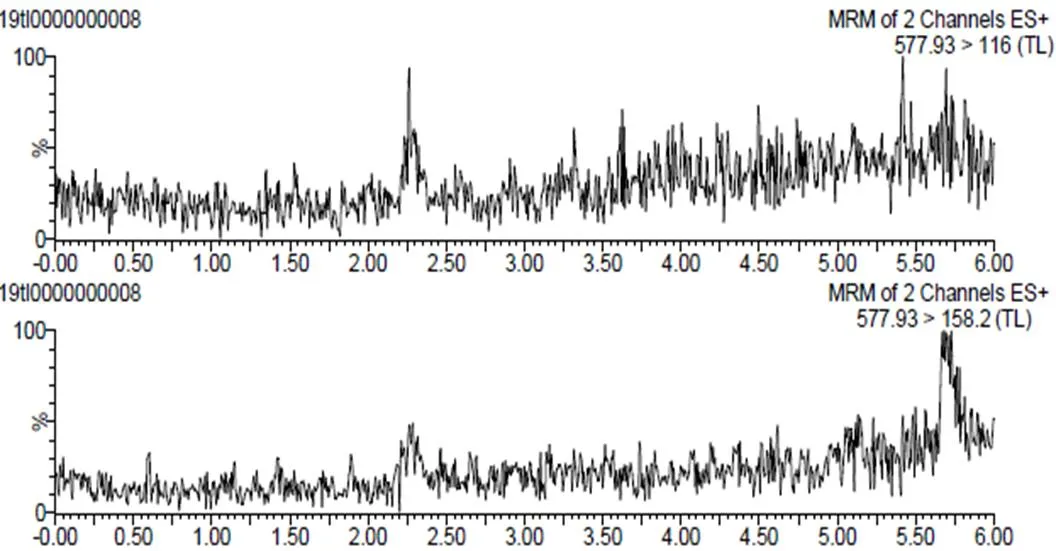
图2 牛肉空白样品
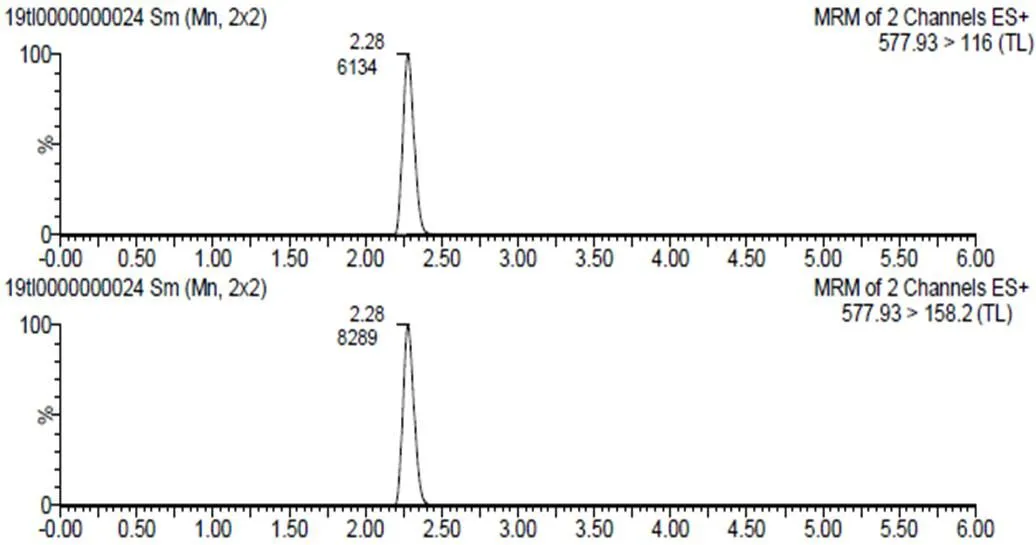
图3 牛肉空白样品添加30μg/kg

表3 基质效应 (ng·ml-1、%)
2.3 线性范围
精密吸取1µg/ml的标准工作液,用甲醇-0.1%甲酸溶液(1:9,v/v)配制浓度为1、2、4、10、40、100ng/ml的系列标准溶液,精密吸取1ml分置空白样品吹干的基质中,涡旋1min复容,10000 r/min离心5min,过0.22μm滤膜,在规定的测试条件下进行检测,以泰拉霉素代谢物定量离子峰面积为纵坐标,泰拉霉素代谢物浓度为横坐标,绘制标准曲线,得回归方程为:y=3415.6x-578.65,曲线的R2为0.9999,在1~100ng/ml浓度范围内呈良好的线性关系。
2.4 方法的灵敏度
在牛肉空白样品中添加泰拉霉素代谢物标准溶液,1.3项方法处理后,在规定的测试条件下进行检测,计算信噪比。满足欧盟657号决议[8]规定的定性条件的最低添加量为本方法的检出限,大于检出限,定量离子色谱峰的信噪比(S/N)满足在10:1以上且回收率满足70%~110%之间的最低添加量为本方法的定量限[9]。本方法的检出限为10μg/kg,定量限为30 μg/kg。
2.5 方法的准确度和精密度
取3批牛肉空白样品,每批中添加泰拉霉素代谢物30μg/kg(LQD)、150μg/kg(1/2MRL)、300 μg/kg(MRL)、600μg/kg(2MRL)4个不同浓度,每个浓度平行5份,1.3项方法处理后,在规定的测试条件下进行检测,计算回收率,回收率在70%~ 110%之间,批内、批间相对标准偏差均小于10%,结果见表4。
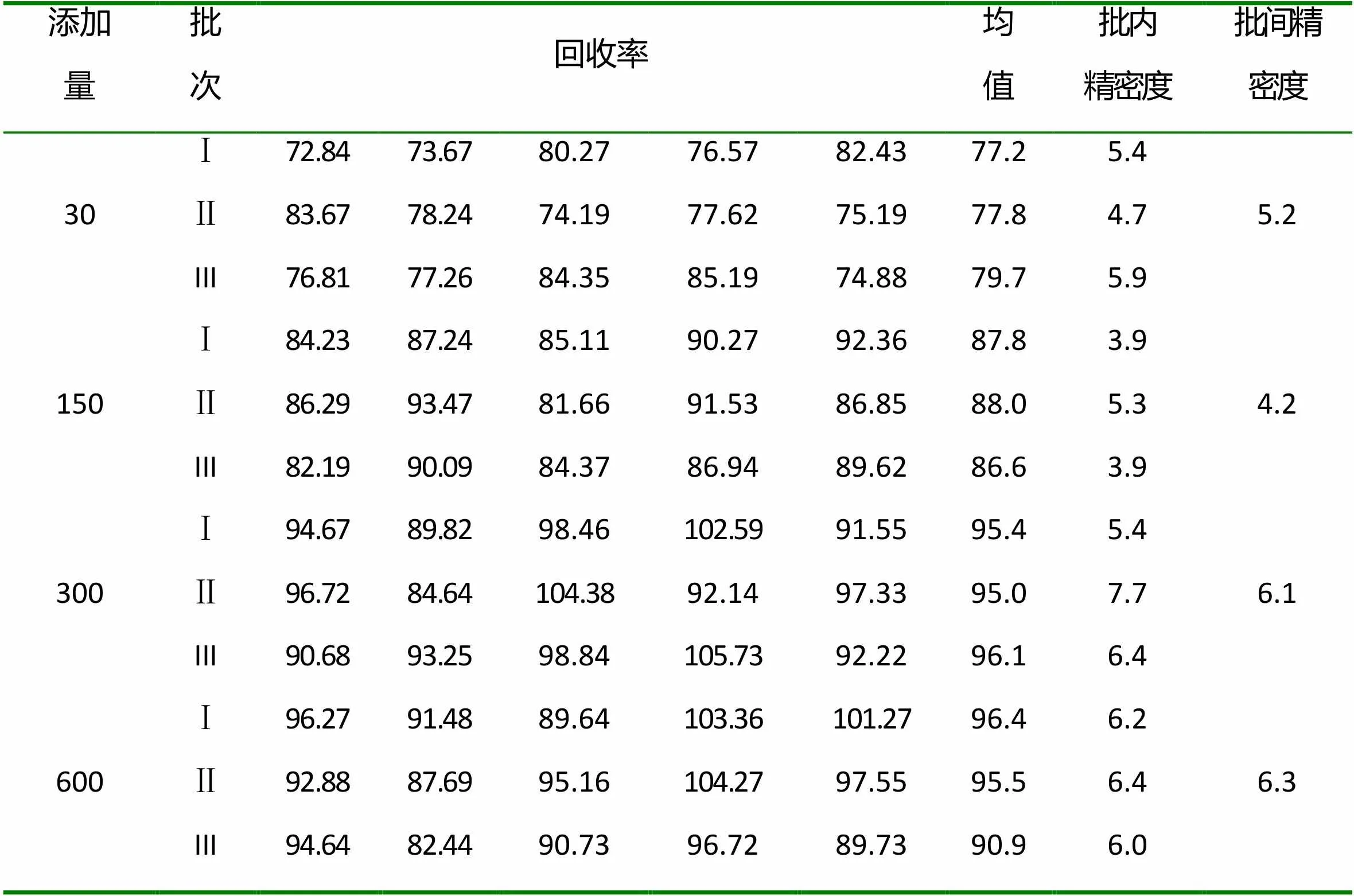
表4 方法准确度与精密度 (μg·㎏-1、%)
2.6 100批样品检测结果
从农贸市场随机购买的100批牛肉按照本研究建立的方法进行检测,结果均有3批检出泰拉霉素代谢物,其中1批低于定量限,另外两批分别为36.4μg/kg、48.2μg/kg,远低于最大残留限量。
3 讨论与小结
(1)前处理过程中提取时尝试了多种提取液,包括乙腈、甲醇、水、盐酸溶液,测试结果表明,泰拉霉素代谢物极性较大且具有碱性,在盐酸溶液中的提取率最高,依据参考文献[7]选用2 mol/L盐酸消化处理后干扰物明显减少。MCX固相萃取柱具有反相和阳离子交换双重保留性能,对碱性化合物具有良好的保留能力,净化后基线更为平直,回收率大大提高。(2)泰拉霉素作为一种新药,其在畜禽产品中的残留研究报道较少,刘勇军等[10]建立了高效液相色谱-串联质谱(HPLC-MS/MS)测定猪肉样品中泰拉霉素残留的方法,徐曹燕等[11]建立了鸡组织中泰拉霉素残留的检测方法,检测的都是泰拉霉素原型,而目前没有关于泰拉霉素原型的最大残留限量规定。国内通过检测泰拉霉素代谢标志物来检测组织中泰拉霉素残留的研究较少,本方法用2 mol/L盐酸消化提取,MCX固相萃取柱净化,高效液相色谱-串联质谱正离子模式测定,结果泰拉霉素代谢物在牛肉中的检测限为10μg/kg、定量限为30μg/ kg,远低于最大残留限量,满足残留检测要求。整个实验过程简单、快速,回收率较高,精密度好,适用于牛肉中泰拉霉素代谢物残留量的检测。
[1] 张刚, 郭丽清, 徐金雷等. 泰拉霉素的研究进展[J]. 北京联合大学学报, 2017, 31(2): 48-53.
[2] Kilgore W R, Spensley M S, SUN F S, et al. Therapeutic efficacy of tulathromycin, a novel triamilide antimicrobial, against bovine respiratory disease in feeder calves[J]. Veterinary Therapeutics, 2005, 6(2): 143-53.
[3] Nautrup B P, Van Vlaenderen I, Gasper S, et al. Estimating the comparative clinical and economic consequences of tulathromycin for treatment of present or anticipated outbreaks of bovine respiratory disease in feedlot cattle in the United States[J]. Journal of Animal Science, 2013, 91(12): 5868-5877.
[4] 农业部. 中华人民共和国农业部公告第957号[S]. 2008.
[5] Ema. Scientiric Discussion[S]. CVMP/0968/03, 2003.
[6] Fda. Freedom of Information Summary[S]. Nana 141-244, 2005.
[7] Cox S R, Mclaughlin C, Fielder A E, et al. Rapid and Prolonged Distribution of Tulathromycin into Lung Homogenate and Pulmonary Epithelial Lining Fluid of Holstein Calves Following a Single Subcutaneous Administration of 2.5 mg/kg Body Weight[J]. International Journal of Applied Research in Veterinary Medicine, 2010, 8(3): 129-37.
[8] Commission Decision(EC) No 657/2002 of the European parliament and of the council[S].
[9] 吴剑平, 张婧, 贡松松等. 分散固相萃取结合液相色谱串联质谱法检测牛可食性组织中太地罗新残留量[J]. 中国兽药杂志, 2019, 25(3): 37-46.
[10] 刘勇军, 吴银良, 姜艳彬等. 高效液相色谱-串联质谱法测定猪肉中泰拉霉素残留[J]. 分析化学研究简报, 2009, 37(10): 1489-1493.
[11] 徐曹燕, 李琳, 汤春莲等. 鸡组织中泰拉霉素残留的高效液相色谱-串联质谱测定法[J]. 西北农林科技大学学报(自然科学版), 2016, 44(6): 16-22.
(2019–05–20)
S818.9
A
1007-1733(2019)09-0001-04
