1-氯-3-丁烯-2-醇的细胞遗传毒性
2019-09-20李玉峰刘欣杰张新宇
李玉峰,刘欣杰,张新宇
(上海大学环境与化学工程学院环境污染与健康研究所, 上海200444)
1,3-丁二烯(简称丁二烯)是一种石油化工产品, 主要用于制造合成橡胶、树脂和塑料. 它是一种无色气体, 也是一种空气污染物, 在环境中的主要来源是化石燃料和生物质的不完全燃烧, 如汽车尾气和香烟烟雾等[1]. 因此, 丁二烯广泛存在于城市空气中, 其浓度范围通常为(0.1 ~1.0)×10-9[1].
丁二烯是一种已确定的人类致癌物(IARC Group 1), 可在暴露人体上诱发淋巴-造血系统癌症[1]. 丁二烯致癌风险很高,0.014×10-9浓度丁二烯的致癌风险水平达到了10-6[2], 而苯需要(0.04 ~0.14)×10-9浓度才能达到同样的风险水平[3]. 已有多项研究表明, 丁二烯是具有最高致癌风险的环境污染物之一[4-7], 也是香烟烟雾中致癌性最强的化合物[8], 即使在二手烟和三手烟中也是最有害的挥发性有机化合物之一[9].
代谢是丁二烯致癌的根本原因. 丁二烯进入生物体内后可通过两条途径代谢, 产生多种具有致突变性的产物. 这两条途径分别称为P450 途径和MPO(myeloperoxidase, 髓过氧化酶)途径(见图1)[10]. 在P450 途径中, 丁二烯在肝脏、肾脏和肺脏等器官中被P450 酶代谢为3,4-环氧-1-丁烯(3,4-epoxy-1-butene, EB)、1,2,3,4-双环氧丁烷(1,2,3,4-diepoxybutane, DEB)和3,4-环氧-1,2-丁二醇(3,4-epoxy-1,2-butanediol, EBD)[1]. 在MPO 途径中, 丁二烯在骨髓和血液白细胞中被MPO 代谢为1-氯-3-丁烯-2-醇(1-chloro-2-hydroxy-3-butene, CHB)[10-11]. 上述4 种产物已被证明具有致突变性. 由于丁二烯在人体内致癌作用的靶器官是淋巴-造血系统[1-2], 而骨髓是此系统的关键组成部分, 这提示MPO 途径可能与丁二烯的致癌作用密切相关[10]. 因此, 作为这条途径上的产物, CHB 可能在丁二烯致癌作用中起关键作用, 值得深入研究.
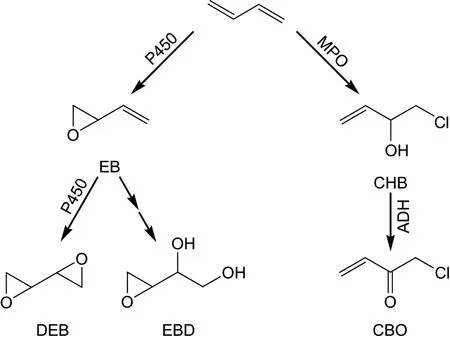
图1 丁二烯的代谢途径和主要代谢产物Fig.1 Metabolic pathways and major metabolites of 1,3-butadiene
由图1 可知, CHB 可以在乙醇脱氢酶(alcohol dehydrogenase, ADH)作用下进一步代谢为1-氯-3-丁烯-2-酮(1-chloro-3-buten-2-one, CBO)[12]. CBO 是一种强的Michael 受体,其分子两端均可与亲核试剂反应, 因此具有交联能力. 研究发现: CBO 很容易与谷胱甘肽(glutathione,GSH)反应生成单/双偶联产物, 也容易与蛋白质反应并引起蛋白质交联[12], 或者与核酸碱基及DNA 反应产生多种DNA 加合物[13-16]. CHB 和CBO 均有细胞毒性和遗传毒性, 且CBO的毒性比CHB 强约100 倍, 但二者的遗传毒性特征并不完全相同: CHB 会产生两种类型的DNA 损伤, 即DNA 单链断裂和碱性不稳定位点(alkali-labile sites, ALS), 但CBO 只产生ALS 损伤, 且CHB 还具有致突变性[17].
然而, 上述研究只是发现了CHB 具有遗传毒性(即能够引起DNA 损伤), 以及能够引起两种类型的DNA 损伤, 但CHB 引起DNA 损伤的途径还不清楚. 有一种推测是CHB 的毒性可能是其在细胞内转化为CBO 导致的, 因为CBO 毒性比CHB 强得多, 只要很少量CHB 被转化为CBO 就足以引起显著的毒性. 因此, 本工作对此进行了进一步研究, 发现CHB 毒性主要还是由其自身的反应性引起的, 而并非是由其在细胞内转化为CBO 引起的.
1 实验部分
1.1 试剂与材料
二甲亚砜(dimethyl sulfoxide, DMSO)购于国药集团化学试剂有限公司. 4-甲基吡唑(4-methylpyrazole,4-MP)和1-卞基咪唑(1-benzylimidazole,BI)购于Sigma-Aldrich. 3-丁烯-2-醇(3-buten-2-ol, BO)购于Alfa Aesar. DMEM(Dulbecco’s modified Eagle’s medium)培养基、IMDM(Iscove’s modified Dulbecco’s medium)培养基、胎牛血清(fetal bovine serum, FBS)购于Life Technologies. 青霉素和链霉素购于北京鼎国生物科技有限公司. 人胚肝L02 细胞株和人白血病HL-60 细胞株购于中国科学院细胞库. CHB 和CBO 按照文献[12]方法合成.
1.2 细胞培养
L02 细胞在含10% FBS, 100 U/mL 青霉素和100 µg/mL 链霉素的DMEM 培养基中, 在含有5% CO2的37◦C 培养箱中培养. 待细胞处于对数生长期, 生长至70%~80%时进行传代或实验. HL-60 细胞在含20% FBS, 100 U/mL 青霉素和100 µg/mL 链霉素的IMDM 培养基中, 在含有5% CO2的37◦C 培养箱中培养. 待细胞处于对数生长期, 即细胞传代后的24 h 之内进行实验.
1.3 化合物遗传毒性检测的一般程序
除去细胞上的培养液(HL-60 细胞为悬浮细胞, 故需通过离心沉淀细胞后, 再除去上清液).待测化合物溶于DMSO 制成0.5 或1 mol/L 溶液, 以0.1%体积加入到无血清培养基中(当需要长时间(≥12 h)处理细胞时, 使用含有血清的培养基), 混合均匀后添加到细胞上. 在含有5% CO2的37◦C培养箱中培养1 h 后, 用标准彗星实验(the Comet assay)检测DNA 损伤情况[18]. 阴性对照组细胞用含0.1%体积DMSO 的无血清培养基培养1 h.
彗星实验, 又称单细胞凝胶电泳(single cell gel eletrophoresis, SCGE)分析, 是目前使用最广泛的一种检测真核细胞DNA 损伤的方法. 标准彗星实验在强碱性(pH >13)条件下进行,可检测DNA 的链断裂、碱性不稳定位点(即失去碱基的位点)以及DNA-DNA/DNA-蛋白质交联. 其基本原理是将细胞以单个状态固定在琼脂糖凝胶中, 经过裂解并去除组蛋白后, 只剩下裸露的DNA 留在琼脂糖中, 再施以适当的直流电场进行电泳, 损伤的DNA 向阳极迁移而形成拖尾. 拖尾程度与DNA 损伤呈正相关关系, 因而可以以拖尾程度定量衡量DNA 受损程度. 由于电泳后观察到的DNA 状态(通过荧光染料染色)具有一个明亮的圆形头部, 带有一条较暗的尾部, 形似彗星, 故得名彗星实验.
1.4 含有CHB 的培养基溶液放置不同时间后遗传毒性的变化情况
按照1.3 节中的程序制备含有500 µmol/L CHB 的无血清培养基溶液, 在37◦C 培养箱中分别放置0.5, 1, 4和18 h, 然后添加到L02 细胞上, 培养1 h, 用彗星实验进行检测.
1.5 CHB 引起的DNA 损伤随着不同细胞处理时间的变化
按照1.3 节中的程序制备含有1 000 µmol/L CHB 的培养基溶液, 添加到L02 细胞上, 分别在培养箱中培养0.5, 1, 2, 4 和12 h, 用彗星实验进行检测.
1.6 P450 酶和ADH 抑制剂对CHB 遗传毒性的影响
L02 和HL-60 细胞用含1 000 µmol/L BI 和1 000 µmol/L 4-MP 的无血清培养基培养1 h, 然后用1 000 µmol/L CHB 培养1 h, 用彗星实验进行检测.
1.7 数据处理方法
所有实验设置至少3 个平行样(平行样具体数目见图标中的说明), 取平行样的平均值和标准偏差. 实验组与对照组数据的比较使用Student’s t-test, 以0.05 作为统计显著性的临界值.
2 实验结果
2.1 BO 的遗传毒性
CHB 具有遗传毒性. 从化学结构的角度分析, 这可能应归因于CHB 分子中的氯甲基. 因为氯甲基的存在导致CHB 具有亲电性, 可能与DNA 或蛋白质发生反应而产生毒性. 为验证这一点, 本工作检测了3-丁烯-2-醇(3-buten-2-ol, BO)的遗传毒性. BO 与CHB 在结构上的唯一差别就是BO 分子中没有氯原子.
结果表明, 500 和1 000 µmol/L BO 在细胞上没有引起任何DNA 损伤, 而在同样条件下,1 000 µmol/L CHB 产生的DNA 损伤达20.4% ± 3.0%(阴性对照组为7.4%±2.3%, 见图2).因此可知, 氯甲基是CHB 遗传毒性中的关键结构因素.
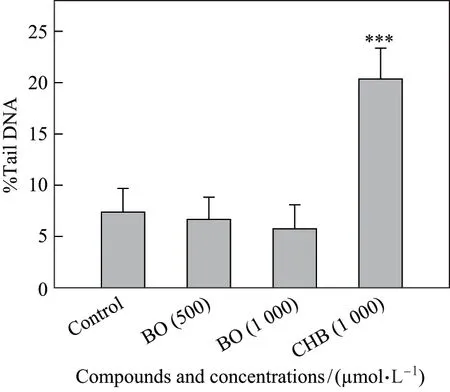
图2 500 和1 000µmol/L BO 与1 000µmol/L CHB 引起的DNA 损伤对比(5 个平行样,***p <0.001)Fig.2 DNA damage caused by 500, 1 000 µmol/L BO, and 1 000 µmol/L CHB (quintuplicate,***p <0.001)
2.2 含有CHB 的培养基溶液放置后遗传毒性增强
CHB 分子中的氯甲基使得CHB 具有反应性, 不仅可能与生物分子发生反应, 而且还可能在溶液中发生水解等反应, 从而转化为其他毒性化合物. 这也可能是CHB 具有遗传毒性的原因之一. 为检验这种推测, 将含有500 µmol/L CHB 的无血清培养基在37◦C 放置0.5, 1, 4 和18 h, 然后检查培养基的毒性, 结果如图3 所示.
含有CHB 的培养基溶液放置后毒性发生了改变. 与未放置的溶液(图3 中0 h 的数据)相比, 放置0.5 和1 h 后的毒性实际上没有发生变化(p >0.05). 然而, 放置4 和18 h 后的溶液毒性明显增强, 且差异具有统计显著性(*p <0.05, **p <0.01). 这说明CHB 在溶液中会转化为其他毒性更强的化合物, 但此转化过程较慢, 在1 h 内的转化可忽略.
2.3 CHB 引起的DNA 损伤随着细胞处理时间的变化
为观察CHB 引起的DNA 损伤随细胞处理时间的变化趋势并与上述实验结果进行对比,用1 000 µmol/L CHB 分别处理细胞0.5, 1, 2, 4 和12 h, 然后检查DNA 损伤情况, 结果如图4 所示.

图3 含有500 µmol/L CHB 的无血清培养基溶液在37 ◦C 放置不同时间后的遗传毒性(3 个平行样,*p <0.05, **p <0.01)Fig.3 Genotoxicity of 500 µmol/L CHB in FBS-free media after incubation at 37 ◦C for specified time (triplicate, *p <0.05, **p <0.01)

图4 1 000 µmol/L CHB 引起的DNA 损伤随细胞处理时间不同的变化情况(4 个平行样, **p <0.01,***p <0.001)Fig.4 DNA damage caused by 1 000 µmol/L CHB at different cell-incubation time (tetraplicate,**p <0.01, ***p <0.001)
结果表明, 在4 h 内, CHB 引起的DNA 损伤随细胞处理时间的增加而增大. 与阴性对照组(4.6% ± 1.6%, 图中未显示)相比, 细胞用CHB 处理0.5 h 即产生了相当强的损伤(14.0%±3.7%, **p <0.01); 处理1 h 后损伤继续增大, 但与0.5 h 的结果相比, 差异不具有统计显著性. 然而, 处理2 和4 h 后产生的DNA 损伤与处理0.5 h 的相比, 差异具有统计显著性(**p <0.01, ***p <0.001). 另一方面, 过长的处理时间(12 h)反而会导致DNA 损伤的减小(但此时的损伤仍然明显高于0.5 h 的损伤, **p <0.01), 这可能是由于DNA 修复的缘故.
2.4 CHB 对DNA 的损伤机理
由于CHB 可被ADH 代谢为CBO, 而CBO 的毒性约为CHB 的100 倍, 因此只要1%的CHB 在细胞内被代谢为CBO, 就能产生观察到的CHB 毒性结果. 为检验这种可能性, 使用ADH 抑制剂4-MP 进行实验. 考虑到CHB 还可能被P450 酶代谢为CBO, 故也使用了P450广谱抑制剂BI. 此实验在L02 和HL-60 两种细胞株上进行.
实验结果显示, 在两种细胞株中, 加入抑制剂4-MP 和BI 后对于CHB 引起的DNA 损伤没有影响(图略), 表明CHB 的遗传毒性不是通过转化为CBO 产生的.
3 讨 论
CHB 可能是1,3-丁二烯对人体产生致癌效应的一种关键代谢产物, 因此对它的研究非常重要. 已经发现CHB 能够损伤DNA, 引起DNA 单链断裂和ALS. 本工作的研究目的是希望阐明CHB 是通过什么途径损伤DNA 的.
一种化合物可通过直接和间接途径损伤DNA. 直接途径就是化合物直接与DNA 发生反应, 形成DNA 加合物或引起DNA 脱碱基(即形成ALS)或DNA 断裂. 间接途径则较为复杂,包括: ①转化为其他能直接与DNA 发生反应的化合物, 这种转化可以是化学转化(即通过简单化学反应的转化, 如水解等), 也可以是生物转化(即在酶的作用下进行的转化); ②其他细胞机理(主要是氧化应激).
没有氯原子的对应化合物BO 即使在相当高的浓度(1 000 µmol/L)下都没有表现出任何遗传毒性, 而同样条件下的CHB 则产生了强毒性(见图2). 这说明氯甲基的存在是CHB 毒性产生的关键结构因素. 从化学反应性来看就容易解释了. 因为氯甲基是亲电性的, 且氯甲基相邻碳原子上有一个羟基, 其吸电子能力进一步增强了氯甲基的亲电性, 故氯甲基能与DNA 碱基中的氮原子发生亲核取代反应, 从而损伤DNA. 因此, 就化学反应性而言, CHB 是能够通过直接途径损伤DNA 的.
含有CHB 的培养基溶液放置后出现了遗传毒性增加的现象(见图3), 表明CHB 能发生化学转化, 且转化形成的化合物毒性更强. 这可能也是氯甲基反应性引起的结果. 因为水分子中的氧原子或CHB 自身的羟基氧原子能与氯甲基发生亲核取代反应, 即发生CHB 的水解或分子内的环合, 产生3-丁烯-1,2-二醇(3-buten-1,2-diol, BDD)或EB(见图5). BDD 毒性很弱而EB 毒性较强[19], 故CHB 的化学转化可能主要产生EB.
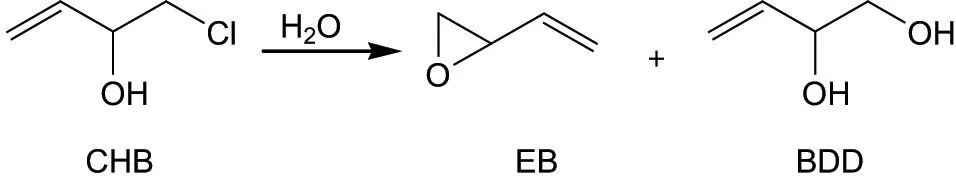
图5 在溶液中CHB 可能转化为EB 和BDDFig.5 CHB may be converted to EB and BDD in solution
然而, CHB 化学转化过程较慢. 与未经放置的含有CHB 的培养基溶液相比, 放置0.5 和1 h 的溶液毒性实际上没有变化(见图3). 与此形成鲜明对照的是, 直接用CHB 溶液处理细胞时, 即使处理时间只有0.5 h, 产生的DNA 损伤已经相当强(见图4). 显然, 这说明CHB 的毒性是由其自身引起的, 而不是化学转化为其他化合物的结果. 当然, 如果CHB 处理细胞的时间较长(≥4 h), 则不排除化学转化对CHB 表现出来的毒性有一定贡献的可能(见图3 和4). 必须指出, 这种情况(即长时间处理细胞)较为复杂, 毒性可能产生累积效应, 故化学转化对CHB毒性的贡献只是一种推测, 证据尚不充分.
使用P450 酶和ADH 抑制剂的实验结果表明, CHB 的毒性并非由于其生物转化为CBO产生. 实际上, 已有文献报道培养的肝细胞内没有P450 和ADH 等代谢酶的表达[20]. 因此,CHB 在L02 细胞中引起DNA 损伤这一事实本身已经说明其毒性并非转化为CBO 的结果.
最后, CHB 的毒性也不大可能是由其他细胞机理引起的. 本工作对CHB 是否引起氧化应激进行了初步检测. 结果表明, CHB 在L02 细胞中没有引起明显的氧化应激.
综上所述, 本研究结果说明, CHB 可能主要通过直接途径(即直接与DNA 发生反应)而不是通过转化为CBO 损伤DNA. 但在长时间(≥4 h)处理细胞的情况下, 化学转化为其他毒性化合物可能对CHB 的毒性产生也有一定贡献.
4 结束语
本工作对CHB 产生遗传毒性的原因进行了研究, 发现CHB 主要通过直接途经引起DNA损伤. 这可能归因于CHB 的亲电反应性. 研究结果对于深入理解CHB 的毒性和致突变性提供了重要的基础.
