黄牛SH2B1基因多态性及其与体尺性状的关联性分析
2019-09-20张毅威桂林生郭文莉余横伟杨武才昝林森赵春平
张毅威, 桂林生, 郭文莉, 胡 言, 余横伟, 杨武才, 昝林森, 赵春平
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
SH2B衔接因子蛋白l(Src homology 2 B adaptor protein 1,SH2B1)属于SH2B接头蛋白家族,该家族蛋白含有SH2和PH结构域[1]。SH2B1蛋白在小鼠的中枢神经和外周组织中广泛表达,在脂肪和肌肉等组织中含量丰富[2]。研究发现SH2B1的SH2结构域能够与多种生长因子受体或细胞因子结合,其中包括胰岛素受体(IR)、IR底物(IRS)1和2、Janus激酶(JAK)1和2,参与多种激素和多个细胞因子的信号通路,从而在生长发育、食欲、体重、代谢平衡、免疫调节等发面发挥着重要作用[3]。
近年来,国内外在人和小鼠上开展了大量关于SH2B1基因功能的研究[3-4]。研究发现完全敲除SH2B1基因的小鼠表现为胰岛素抵抗、瘦素抵抗、脂肪代谢紊乱、葡萄糖耐受性丧失等一系列与肥胖症相关的症状。如果让SH2B1仅在小鼠神经组织中表达,则可逆转这些肥胖相关的症状。如果让SH2B1在神经组织中过表达,将明显的缓解由HFD给药所引起的瘦素抵抗和肥胖[2]。此外,Song等通过对SH2B1敲除小鼠进行研究,发现SH2B1缺失小鼠表现为代谢能力下降、生长发育迟缓、体型明显变小、存活率降低、寿命变短等特征,表明SH2B1对代谢和生长亦有调控作用[1]。还有研究表明,SH2B1参与调控脂肪细胞分化,如果去除或者阻断SH2B1的作用,将导致脂肪干细胞分化为成熟的脂肪细胞困难并妨碍脂肪细胞中脂质的累积,表明SH2B1在脂肪细胞分化和脂肪沉积中发挥着作用[5-6]。SH2B1基因内的多个SNP位点与肥胖密切相关。在人上,SH2B1基因上的5个完全连锁的SNP与腰围、体重、血清瘦素水平和体内脂肪含量等显著相关[7]。目前在家畜上也开展了SH2B1基因相关的研究。在探讨SH2B1基因在牛生长发育等方面的作用中,杨明娟等分析了SH2B1基因在南阳牛等群体中的遗传变异及其与生长性状的关系,发现SH2B1基因第2 795 bp处存在G>A的错义突变,导致相应的氨基酸由Ala突变为Thr。关联分析显示,该突变位点与生长性状显著相关,认为该基因可作为南阳牛体尺、体重和日增重选择的分子育种候选标记[8]。
鉴于SH2B1基因在肥胖症、脂肪代谢、生长发育中的重要作用,为深入探讨该基因在中国黄牛的组织表达规律和遗传多态性,本研究拟分析SH2B1基因在秦川牛不同组织中的相对表达量;此外,以4个中国地方黄牛品种为研究对象,包括秦川牛、郏县红牛、巴山牛和南阳牛,检测SH2B1基因在4个黄牛群体中的多态性,并分析不同基因型对秦川牛体尺性状的影响,以期为深入研究SH2B1的功能及分子标记辅助选择打下了基础,为秦川牛选育改良提供理论基础。
1 材料与方法
1.1 试验材料
采集3头2周岁秦川牛的6种组织,包括肾脏、肝脏、背最长肌、小肠、脂肪、心脏。采集18~24月龄的4个地方黄牛品种共1 062头的血样,包括秦川牛476头、郏县红牛335头、巴山牛142头、南阳牛109头。对秦川牛进行体尺测量,测定性状包括体长(BL)、体高(WH)、腰高(HH)、臀长(RL)、坐骨端宽(HW)、胸深(CD)、胸围(CC)[9]。
1.2 试验方法
1.2.1 RNA的提取和组织表达的分析 采用TRIZOL试剂盒提取总RNA,再经过反转录得到cDNA[9]。利用实时荧光定量PCR仪检测基因表达。反应体系总体积为20 μL,包括:2.0 μL cDNA(50 ng),0.8 μL上、下游引物(0.4 μmol/L),10 μL SYBR Premix Ex TaqTM Ⅱ,0.4 μL ROX reference dye和6 μL水。具体扩增步骤为:95 ℃,30 s;然后95 ℃,5 s,40个循环;最后60 ℃,45 s。每个样品重复3次,β-actin作为内参基因,采用2-ΔΔCt方法计算SH2B1基因的相对表达水平[10]。
1.2.2 基因组DNA的提取及检测 本试验采用血液基因组DNA提取试剂盒提取包括秦川牛在内的共1 062头的血样基因组DNA,提取后的 DNA用TE缓冲液溶解,采用0.5 g/L琼脂糖凝胶电泳检测DNA质量,测定DNA浓度后,-20 ℃保存备用[9]。
1.2.3 引物设计合成及PCR扩增 参照GeneBank中公布的牛SH2B1的序列(AC_000182.1),利用Primer 5.0软件设计引物见表1,引物由上海生工生物工程技术服务有限公司合成,PCR反应体系30 μL,包括:含有核酸染料的dNTPs、TaqDNA聚合酶、10×Buffer的Mix 15.0 μL,dd H2O 11.8 μL,10.0 μmol/L混合引物(上游引物和下游引物各10.0 pmol/μL)1.2 μL,模板DNA(50 ng/μL)2.0 μL。PCR反应程序:95 ℃预变性5 min;94 ℃,30 s,最适温度退火30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min,4 ℃保存,用10 g/L琼脂糖凝胶电泳检测PCR产物。

表1 牛SH2B1基因引物序列及相关信息
1.2.4 数据统计与分析 运用遗传多样性分析软件(Genpop 32)统计各突变点的等位基因频率和基因型频率,同时计算多态信息含量(PIC)、有效等位基因数(Ne)、遗传杂合度(He)和遗传纯合度(Ho)。使用SPSS 16.0软件对不同位点基因型的分布进行Hardy-Weinberg平衡适应性检验[11]。
利用SPSS 19.0软件检验各基因座位的基因型频率和秦川牛的体尺性状指标的关联性,数学模型为:
Yijm=μ+Gi+Aj+Sm+Eijm
(1)
式中:Yijlm为每头牛测量的性状;μ为性状的平均值;Gi为与基因型相关固定效应;Ai为由于年龄造成的固定效应;Sm为父本的固定效应;Eijlm为随机误差[12]。
2 结果与分析
2.1 SH2B1基因PCR扩增片段测序结果
牛SH2B1基因位于25号染色体上,基因全长8 550 bp,含8个外显子。参考NCBI数据库中GenBank公布的牛SH2B1基因序列(AC_000182.1),对测序结果进行DNA序列比对和突变位点分析,共检测到2个SNP位点,分别是在扩增序列的第6 073位处发生一处单碱基C>T的突变(图1),该SNP位于SH2B1基因第4内含子区域;另外在序列第8 067位发生一处T>C突变(图2),该SNP位于SH2B1基因的3′UTR区域。
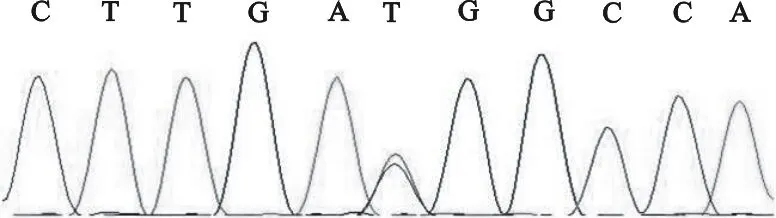
图1 多态位点C6073T序列图
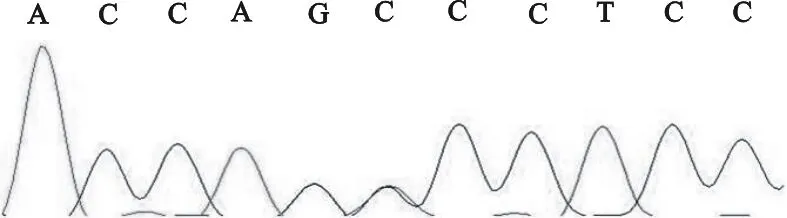
图2 多态位点T8067C序列图
2.2 秦川牛SH2B1基因mRNA的组织表达分析
SH2B1基因在秦川牛6种组织中表达情况分析结果见图3。从图3可以看出,SH2B1基因在各组织中呈泛表达状态,表明该基因在体组织中分布广泛,其表达量从高到低依次为心脏、背最长肌、肾脏、脂肪、肝脏、小肠。

图3 秦川牛SH2B1基因mRNA的组织表达分析
2.3 SH2B1基因多态位点的遗传学分析
4个黄牛群体中SH2B1基因2个多态位点的基因频率和遗传多态性统计结果见表2。由表2可知,秦川牛群体中,SNP1和SNP2位点均处于Hardy-Weinberg平衡状态(P>0.05)。在SNP1位点上,C和T等位基因的频率分别为67.86%和32.14%;CC、CT、TT基因型频率分别为48.32%,39.08%,12.61%;基因杂合度和有效等位基因分别是0.436 2和1.773 8。在SNP2位点上,T和C等位基因频率分别为78.36%和21.64%;TT、TC、CC等位基因频率分别为63.03%,30.67%,6.30%;基因杂合度和有效等位基因分别为0.339 1和1.513 1。秦川牛群体中SH2B1基因在2个SNPs位点多态信息含量分别为0.341 1和0.281 6,均属于中度多态。
郏县红牛群体中,SH2B1基因在第1个多态位点有3种基因型,即CC、CT和TT,他们的频率分别为57.01%,32.24%,10.75%,等位基因C和T的频率分别为73.13%和26.87%。该位点的多态信息含量、基因杂合度和有效等位基因数分别为0.315 8,0.393 0,1.647 3。因为0.25 巴山牛群体中,在SNP1上,C和T等位基因的频率分别为69.37%和30.63%,CC、CT、TT基因型频率分别为51.41%,35.92%,12.68%;在SNP2上,T和C等位基因频率分别为76.76%和23.24%,TT、TC、CC基因型频率分别为65.49%,22.54%,11.97%;巴山牛群SH2B1基因在2个SNPs位点的多态信息含量(PIC)分别为0.334 7和0.293 1,皆属于中度多态。在第1个多态位点处于Hardy-Weinberg平衡状态,在第2个多态位点处于Hardy-Weinberg极不平衡状态(P<0.01)。2个SNP位点的基因杂合度和有效等位基因数分别为0.425 0,1.739 1和0.356 8,1.554 7。 南阳牛群体中,在SNP1上,CC、CT、TT基因型频率分别为48.62%,32.11%,19.27%;在SNP2上,TT、TC、CC基因型频率分别为59.63%,32.11%,8.26%。Hardy-Weinberg的结果与巴山牛不同,在第1个多态位点处于Hardy-Weinberg极不平衡状态(P<0.01),而在第2个多态位点处于Hardy-Weinberg平衡状态。南阳牛群SH2B1基因在2个SNPs位点的多态信息含量(PIC)分别为0.352 5和0.300 3,皆属于中度多态。在SNP1,基因杂合度和有效等位基因分别是0.456 9和1.841 3,而在SNP2,这两项指标分别为0.368 0和1.582 3。 表2 SH2B1基因各多态位点在4种黄牛群体的基因型频率 对秦川牛的7个体尺性状进行测定,并对SH2B1基因2个多态位点不同基因型与体尺性状进行关联分析,结果(表3)表明,在C6073T多态位点,CC型个体(n=230)在体长(BL)、腰高(HH)、坐骨端宽(HW)都显著优于TT型(P<0.05),而CC个体和TT型个体之间,胸围(CC)差异极显著(P<0.01)。此外,TT个体的坐骨端宽(HW)与其他个体之间差异也显著(P<0.05),显著小于CC和CT型。 对秦川牛的第2个多态位点(T8067C)和不同基因型之间进行关联性分析,分析结果(表3)表明,TT型个体在体长(BL)这项指标与TC型(n=146)差异不显著,但CC型个体(n=30)与其他个体之间差异极显著(P<0.01);体高(WH)这项指标,TT型与TC型个体对CC型个体差异显著(P<0.05),CC型个体与其他个体间差异极显著(P<0.01)。 表3 秦川牛SH2B1基因各多态位点不同基因型与体尺性状的关联分析 注:同列数据后标注不同小写字母表示差异显著(P<0.05);同列数据后标注不同大写字母表示差异极显著(P<0.01)。BL(体长),WH(体高),HH(腰高),RL(臀长),HW(坐骨端宽),CD(胸深),CC(胸围)。 SH2B衔接因子蛋白l是一种信号分子,参与多种信号传导,在体内能量代谢调节等过程中发挥着重要的作用。细胞实验表明,SH2B1基因可以参与生长激素诱导的JAK2活化、延缓IR酪氨酸及IRS的去磷酸化、增强IRS的磷酸化[6,13-14]。SH2B1敲除鼠的实验表明,SH2B1对血糖、血脂、肥胖、胰岛素、瘦素等具有重要的调节作用[15-16]。杨明娟等分析了SH2B1基因在中国黄牛群体中的遗传变异及其与生长性状的关系,发现SH2B1基因上存在的错义突变与生长性状显著相关,认为该基因可作为中国黄牛生产性状的分子育种候选标记[8]。因此,本试验研究了秦川牛、郏县红牛、巴山牛和南阳牛4个中国地方品种SH2B1基因的多态性,在该基因的第4内含子和3′UTR共发现了2个多态位点,即C6073T和T8067C,这2个多态位点处于中度多态,因此,在生产中可以对SH2B1基因进行进一步加强选择。进行卡方检验之后发现在C6073T多态位点上郏县红牛和南阳牛均处于Hardy-Weinberg极不平衡状态,这可能是经过了长期选育以后造成的基因频率的改变,也有可能是牛品种自身的原因,还有可能是不同地区人为对牛性状的不同选育而造成的;相反巴山牛和秦川牛处于Hardy-Weinberg平衡状态,说明在人工选育、迁徙和遗传漂变等外界因素作用下,这个C6073T多态位点的基因型处于动态平衡中[8]。 经过长期选育以后,秦川牛等地方牛品种的生产性能得到了快速提高。此外,加大对特定基因的选择强度必定成为提高秦川牛以及其他地方黄牛生产性状的一个有效手段。SH2B1基因各突变位点不同基因型与秦川牛体尺的关联性分析表明:C6073T位点与秦川牛的体长、髋高、坐骨端宽显著相关,对秦川牛的胸围影响极显著。而T8067C位点对于秦川牛体长,体高影响显著,并且T8067C的显性纯合子相对于杂合子在体高方面影响显著。通过对C6073T和T8067C 2个多态位点有关于体长、体高、髋高、臀长、坐骨端宽、胸深、胸围的体尺相关性分析后,笔者认为,SH2B1基因可能是影响秦川牛体长的主效基因或与之紧密连锁,可以尝试把SH2B1基因作为秦川牛新品系培育的辅助选择分子标记。 测序和序列比对表明,2个SNPs位于内含子区域和3′UTR区域,并未改变其编码的蛋白质的结构。然而,最近的研究提供的证据表明,在3′UTR的基因突变可能通过影响mRNA的稳定性和翻译,从而有可能影响蛋白表达及表型[17-19]。例如,牛NUCB2基因上的2个无意突变与秦川牛和南阳牛的体尺及生长性状显著相关[20],OBR基因内含子8上的2个多态位点与肉鸡的腹脂重和腹脂率显著相关[21],PAX3基因内含子上的1个SNP与草原红牛和南阳牛的体长和体高相关[22]。本研究发现SH2B1基因的内含子区域和3′UTR区域的突变,与秦川肉牛的体尺性状显著相关,笔者推测这2个SNP位点可能对SH2B1蛋白表达、折叠或功能具有一定的影响。 在对秦川牛的不同组织进行了实时定量PCR分析后,笔者发现SH2B1基因在各组织中广泛表达,表达量最高的组织是背最长肌和心脏组织,在小肠中表达量最少,在肾脏、肝脏与脂肪组织中表达量中等,这一结果表明该基因在牛组织中的表达情况和人上的类似[2],即在许多组织中广泛表达,这也与SH2B1参与多种信号途径传递的功能相一致。 本试验只对秦川牛SH2B1基因与体尺指标做了相关性分析,并没有对郏县红牛、巴山牛和南阳牛SH2B1基因对于体尺指标进行相关性分析,所以在秦川牛身上得出的结论是否可以推广到其他3个地方品种的育种方面,还有待进一步研究。 研究通过qPCR,对SH2B1基因在不同组织中的表达进行分析,并利用DNA测序技术在4个黄牛群体中检测了SH2B1基因的多态性,结果表明该基因在秦川牛各组织中广泛表达。此外在SH2B1基因的第4内含子和3′UTR各发现了1个单核苷酸多态位点,分别是C6073T和T8067C,并分析了这2个多态位点在4个黄牛群体中的等位基因频率、多态信息含量、基因杂合度、有效等位基因数,进行了哈温伯格平衡检验。在秦川牛群体中,就SH2B1基因各多态位点不同基因型与体尺性状进行关联型分析,结果表明这2个位点与秦川牛某些体尺性状有显著相关性。因此,SH2B1基因可以作为影响秦川牛生产性状的遗传标记候选基因。

2.4 SH2B1基因2个多态位点突变与秦川牛体尺性状的相关性分析

3 讨 论
4 结 论
