利用盐湖提锂尾液制备氢氧化锂工艺研究
2019-09-20周晓军刘国旺杨尚明董守龙张世春
周晓军,刘国旺,杨尚明,董守龙,张世春,张 锋
(青海锂业有限公司,青海格尔木816000)
氢氧化锂作为许多锂产品的重要原料之一,被广泛应用于制备锂基润滑脂、三元锂电池正极材料及碱性蓄电池电解液的添加剂等[1]。随着近期新能源产业的迅猛发展,三元电极材料以其高能量密度等优点受到广泛关注,作为关键基础材料的氢氧化锂的需求量在全球范围内大幅增长。
中国锂资源多集中于盐湖卤水中,其中青海和西藏等地盐湖中的锂资源储量占中国锂资源总储量的约80%[2]。青海地区高镁锂比盐湖卤水提锂企业采用的技术主要有吸附法、萃取法、电渗析法、浸取煅烧法和纳滤法等[3-4],而溶剂萃取法是当前国内外研究比较多的盐湖卤水提锂技术,尤其是对于高镁锂比盐湖卤水提锂,其具有广阔的应用前景[5-7]。
笔者采用萃取、吸附、电解相结合的工艺成功实现了提锂尾液中锂的回收利用,提高了锂资源的利用率,对实现锂盐产品的多元化和填补氢氧化锂市场空缺具有重要意义,为青海盐湖地区提锂尾液回收利用开辟了一条新的工艺路线。
1 实验部分
1.1 原料和仪器
原料:提锂尾液(主要离子含量见表1);N523(实验室合成,质量分数为98%);磷酸三丁酯(TBP,分析纯);磺化煤油(工业级);盐酸(分析纯);FeCl3(质量分数≥97%)。

表1 提锂尾液主要离子含量
仪器:AB204-S电子天平;SevenCompact pH计;S2-AA3000原子吸收光谱仪;电解装置;R3002旋转蒸发仪;DZF-6050S真空干燥箱。
1.2 实验方法
实验过程分为3个步骤:1)采用TBP为萃取剂,FeCl3为协萃剂,从提锂尾液中提取锂制备LiCl溶液;2)将LiCl溶液经过阳离子交换吸附树脂,进一步降低 Ca2+、Mg2+含量;3)以 LiCl溶液为阳极液,采用离子膜电解制备LiOH溶液,将LiOH溶液在旋转蒸发仪中蒸发浓缩,经洗涤、真空干燥,得到LiOH·H2O产品。
2 实验结果
2.1 萃取过程
2.1.1 萃取体系的选择
萃取剂作为影响萃取效果的主要因素直接决定着萃取效果,优良的萃取剂应当具备较高的萃取容量及选择性,并具有传质速率快、理化性能好等特点。表2对醇、酮及双酮类,有机磷类,冠醚类等萃取体系进行了比较。中国对TBP萃取剂提取盐湖卤水中的锂有丰富的研究,时东等[8]研究了N523-TBP混合萃取体系从盐湖卤水中萃取锂的共萃取效应、盐析效应及共存离子对萃取效果的影响,实验证明FeCl3溶液的共萃效果最佳,Mg2+的盐析效应更强,因此TBP萃取剂更适用于高镁锂比盐湖卤水。针对高镁锂比盐湖提锂尾液中锂的回收利用,选择适用于高镁锂比盐湖卤水的有机磷类萃取体系。

表2 各类萃取体系特点
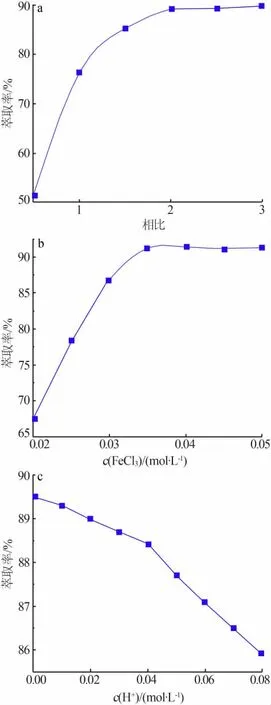
图 1 相比(a)、FeCl3浓度(b)、初始水相酸度(c)对萃取率的影响
2.1.2 萃取过程
1)相比(油相与水相的体积比)对萃取效果的影响。以提锂尾液为水相,萃取时间为20 min,在常温下以不同的相比进行萃取实验,相比对萃取率的影响见图1a。由图1a看出,相比对萃取率有很大的影响。相比为0.5~1.5时,随着相比的增大萃取率快速增加;相比为1.5~2.0时,随着相比的增大萃取率增长缓慢;相比大于2.0后,随着相比的增大萃取率基本无变化。主要原因为,相比较小时没有足够多的有机溶剂与金属离子络合,因此萃取率较低;当有机溶剂总量超过与金属离子络合所需的量时,相比增大对萃取率基本无影响。因此,针对不同Li+含量的盐湖提锂尾液应选择合适的相比。实验中相比大于1.5后萃取率增加缓慢,因此选择相比为1.5。
2)协萃剂浓度对萃取效果的影响。FeCl3溶液作为萃取过程中重要的协萃剂,其加入量的多少对萃取效果有重要的影响。配制不同浓度的FeCl3溶液,在单级萃取的情况下加入相同体积不同浓度的FeCl3溶液,比较单级萃取率,结果见图1b。由图1b看出,当FeCl3浓度为0.020~0.035 mol/L时,随着FeCl3浓度增加萃取率快速增大;当FeCl3浓度为0.035~0.050 mol/L时,随着FeCl3浓度增加萃取率基本没有变化。主要原因为,FeCl3在萃取过程中以LiFeCl3+络合的形式与Li结合,并实现协萃作用,当Fe3+总含量高于络合Li+所需的总量时,FeCl3浓度的增大对提高萃取率无太大影响。根据实验结果,选择协萃剂FeCl3的浓度为0.035 mol/L。
3)初始水相酸度对萃取效果影响。水相和有机相中都含有Fe3+,其水解会产生固相沉淀,为防止其水解,需使水相保持酸性。然而,H+同样会与FeCl3络合生成HFeCl3+,不利于Li+与协萃剂络合,所以水相酸度应该控制在一个合适的范围。采用分析纯盐酸对提锂尾液进行调酸,控制相比为2,协萃剂浓度为0.035 mol/L,萃取时间为20 min,分别在不同酸度下进行萃取实验,结果见图1c。由图1c看出,Li+萃取率随酸度的增加而降低。根据实验结果及以上论述,选择 H+浓度为 0.01~0.02 mol/L。
2.1.3 洗涤过程
萃取完成后的负载有机相中含有少量的镁、钾、钠等杂质离子,需要经过洗涤降低其含量。一般采用盐酸等酸类洗涤剂对负载有机相中的杂质离子进行洗涤,然而这些洗涤剂存在Li+和Fe3+损失率大、杂质离子洗脱率低等缺陷。时东等[9]研究表明,用盐酸和LiCl溶液的混合液作为洗涤剂具有较佳的效果。实验以2 mol/L盐酸和1 mol/L LiCl溶液为原料,按照不同的体积比混合作为洗涤剂,洗涤相比为15,洗涤时间为5 min,在常温条件下进行实验,洗涤效果见表3。从表3看出,当盐酸与氯化锂体积比为1∶2时,Li+和Fe3+损失率最小,而对Mg2+洗脱率相对较低。这主要是因为,洗涤液中Li+和Cl-浓度较高时,可以减少FeCl4-的分解和H+对Li+的置换。

表3 不同体积比混合洗涤剂的洗涤效果
2.1.4 反萃过程
1)反萃液浓度对反萃率的影响。分别以不同浓度的盐酸作为反萃剂,控制相比为6,反萃时间为20 min,在常温下进行单级反萃,检测萃取相中锂的含量并计算反萃率,结果见图2a。由图2a看出,反萃液浓度对反萃率有很大的影响。在较低反萃液浓度(2.0~3.5 mol/L)下,反萃率随盐酸浓度的增大而增大;当盐酸浓度达到3.5 mol/L后,随着盐酸浓度的增大反萃率无明显增大。因此,选择反萃液用盐酸浓度为3.5 mol/L。
2)相比对反萃率的影响。固定反萃时间为20min,以3.5 mol/L的盐酸为反萃剂,以不同相比在常温下进行反萃实验,结果见图2b。从图2b看出,反萃相比越小反萃率越大。然而,相比越小水相中Li+浓度越低。在实际生产过程中应综合考虑反萃率和Li+浓度。为保证反萃后水相中Li+含量较高,选择反萃相比为8。
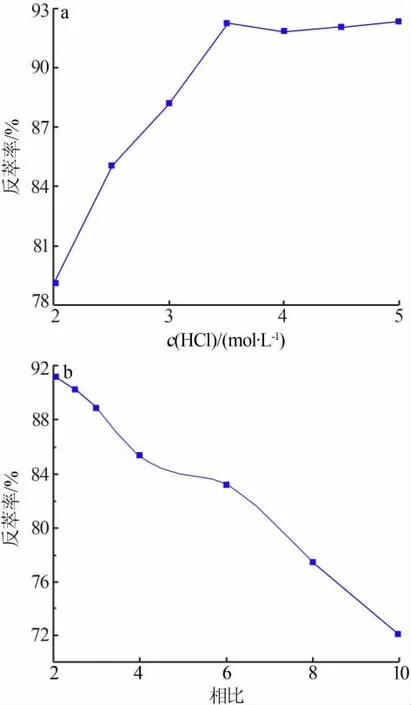
图2 盐酸浓度(a)、反萃相比(b)对反萃率的影响
根据以上实验结果确定实验条件:萃取相比为1.5,协萃剂浓度为 0.035 mol/L,初始水相酸度为0.02 mol/L,萃取时间为20 min;洗涤液为体积比为1∶2的2 mol/L盐酸和1 mol/L LiCl溶液的混合液,洗涤相比为15,洗涤时间为5min;反萃剂采用3.5mol/L的盐酸,反萃相比为8,反萃时间为20 min。采用上述条件从提锂尾液中萃取得到的水相(以下称LiCl溶液)中主要离子含量见表4。

表4 萃取得到的水相(LiCl溶液)主要离子含量
2.2 吸附过程
萃取制备的LiCl溶液中含有少量的Ca2+和Mg2+,电解过程中液相含有的Ca2+和Mg2+会与膜上的离子交换点相结合,占据交换点而使其无法正常迁移Li+,同时Ca2+和Mg2+会与阴极液中的 OH-结合生成沉淀,沉积于膜表面或内部,堵塞离子和水的迁移通道,降低离子的迁移速率,导致电流效率下降。因此,在电解之前需要采用化学或物理方法降低溶液中的Ca2+和Mg2+含量,如纳滤、吸附、沉淀法等。
实验以阳离子交换树脂为吸附剂,采用吸附法进一步降低溶液中的Ca2+和Mg2+含量。调整LiCl溶液pH在6.5~7.0,控制每小时流量为树脂装填体积的2倍,在常温下进行吸附实验,吸附实验结束后LiCl溶液中主要离子含量见表5。由表5看出,吸附后溶液中Ca2+和Mg2+含量大幅降低。为满足电解实验的需要,将去除Ca2+和Mg2+后的LiCl溶液在自然条件下蒸发浓缩至质量分数为21%~25%。

表5 吸附实验后LiCl溶液中主要离子含量
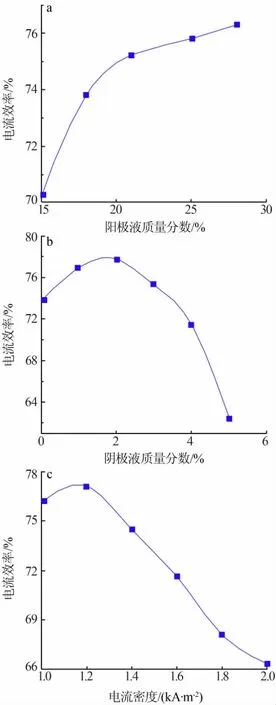
图 3 阳极液质量分数(a)、阴极液质量分数(b)、电流密度(c)对电流效率的影响
2.3 电解过程
离子膜电解法作为目前最先进的制碱工艺,具有三废少、污染低及易管理等优点。在工业化应用中,其能耗主要集中在电能的消耗上,提高电流效率(电解过程中主反应消耗的电能与总消耗的电能之间的比值)可以有效提高电能的利用率。实验探讨了阳极液质量分数、阴极液质量分数和电流密度3个变量对电流效率的影响。
1)阳极液质量分数对电流效率的影响。电解过程中LiCl溶液作为阳极液,其质量分数的高低对电流效率有重要的影响。阳极液质量分数过低时,会导致工作电压和耗电量上升,电流效率降低,并且会引起膜鼓泡,造成膜的不可逆破坏。较高的阳极液质量分数可以提高溶液的电导率,减小电压压降,同时氯在电解液中的溶解度也会降低。但是,质量分数过高会增加氯化物透过膜的迁移量,影响产品纯度。
固定阴极液LiOH溶液质量分数为2%、电流密度为1.2 kA/m2、温度为25℃,在阳极液质量分数分别为15%、18%、21%、25%、28%条件下进行电解实验,计算电流效率的结果见图3a。从图3a看出,当阳极液质量分数为15%~21%时,随着阳极液质量分数的增加电流效率快速增加;当阳极液质量分数大于21%后电流效率增加缓慢。造成该现象的主要原因是,阳极液质量分数增大导致溶液电导率升高,溶液的阻抗降低,离子迁移率增加,因此电流效率增加。当阳极液质量分数继续增加时,由于膜的性能限制,迁移率基本无太大变化。另一方面,随着阳极液质量分数增大,溶液的黏度也增大,流动性减弱,促使离子运动速度减慢,从而电流效率降低。根据实验结果,阳极液最佳质量分数为21%~25%。
2)阴极液质量分数对电流效率的影响。固定阳极液质量分数为21%、电流密度为1.2 kA/m2、温度为25℃,以RO水以及质量分数分别为1%、2%、3%、4%、5%的LiOH溶液作为阴极液进行实验,结果见图3b。从图3b看出,电流效率随阴极液质量分数的增大先增大后减小,当阴极液质量分数为1%~2%时电流效率最高。主要是因为,阴极液适当的质量分数可以提高电解液的电导率,降低能量消耗,但是阴极液质量分数过低会导致离子膜阴极侧羧酸层含水量增加,减弱对阴离子的阻挡作用,致使电流效率降低。
3)电流密度对电流效率的影响。固定阳极液质量分数为21%、阴极液质量分数为1.5%、温度为25℃,在不同电流密度下进行电解实验,结果见图3c。从图3c看出,电流效率随电流密度的增大先增加后降低,电流密度为1.2 kA/m2时电流效率达到最大值。
根据以上实验结果,将制备的LiCl溶液蒸发浓缩至质量分数为21%,阴极液为质量分数为1.5%的LiOH溶液,电流密度为1.2 kA/m2,温度为25℃,电解得到的LiOH溶液主要离子含量见表6。

表6 LiOH溶液主要离子含量
2.4 蒸发结晶过程
将LiOH溶液置于旋转蒸发仪中进行蒸发浓缩,浓缩至表面有晶体析出时停止蒸发过程并进行冷凝,冷凝30 min后进行固液分离,得到的固相为LiOH·H2O半成品,剩余母液与LiOH溶液混合用于下一次蒸发浓缩。
将LiOH·H2O半成品进行2次淋洗,然后置于真空干燥箱中在75℃干燥1.5 h,干燥过程控制真空度为0.06 MPa。干燥过程完成后检测分析产品中主要离子含量,并与GB/T 26008—2010《电池级单水氢氧化锂》(LiOH·H2O-D1)作比较,结果见表 7。由表7看出,制备的LiOH·H2O组分满足标准的要求。
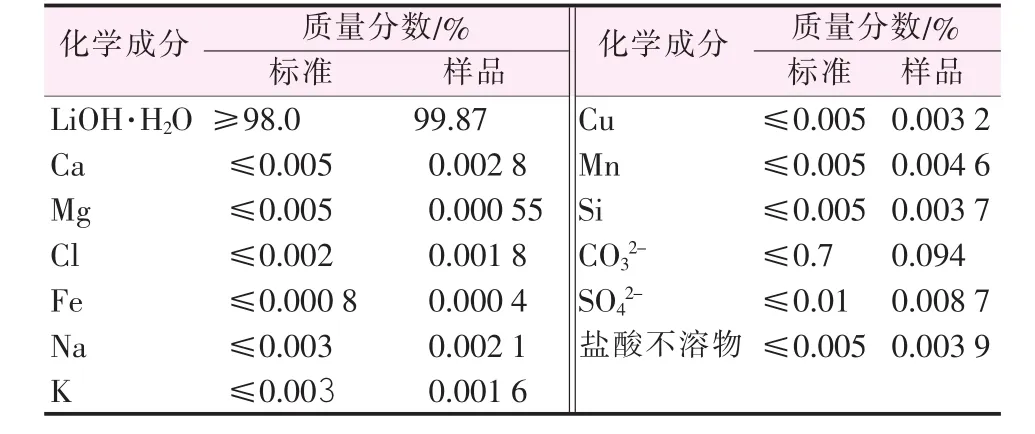
表7 氢氧化锂固相产品主要组分并与标准对比结果
3 结论
综合以上实验结果可以看出,采用有机磷萃取体系从提锂尾液中分离得到LiCl溶液,再经过阳离子交换树脂吸附降低其中的Ca2+和Mg2+含量,最终经离子膜电解制备的氢氧化锂完全满足电池级氢氧化锂标准的要求,证明萃取-吸附-电解组合工艺可以成功地回收利用青海地区盐湖提锂尾液中的锂资源。
