液相合成纳米氧化锌及其光催化性能探讨
2019-09-20左龙涛
况 怡,李 军,金 央,陈 明,左龙涛
(四川大学化学工程学院,四川成都610065)
纳米氧化锌是一种重要的Ⅱ-Ⅵ半导体[1],在室温下具有3.37 eV的宽直接带隙和60 meV的大激子结合能[2],因其颗粒尺寸小、比表面积大而具有表面效应、小尺寸效应和宏观量子隧道效应,使其可应用于磁、光、电、化学、物理学、敏感性等方面,在橡胶、涂料、油墨、颜填料、催化剂、高档化妆品以及医药等领域展示出广阔的应用前景[3]。同时,由于纳米氧化锌具有强激子发射和易于纳米结构生长的特点,而且制备成本低、无毒,以及具有优良的化学稳定性、较大的界面面积以及较好的结晶度,使其较TiO2具有更为优异的光催化能力[4]。目前,研究人员已经开发出多种制备氧化锌纳米结构的方法,分别为微乳液法[5]、有机前驱体热分解法、喷雾热解法、电沉积法、超声波法、微波辅助法、磁控溅射法、脉冲激光沉积法、化学气相沉积法、水热法[6]、溶剂热法[7]、溶胶-凝胶法[8]、单一化学法[9]和液相直接沉淀法[10]等。但是,这些技术大部分并未大规模广泛使用,其中最可能实现工业化的方法为液相直接沉淀法,此方法操作简单、易于控制、成本低廉。但是,目前研究者多数通过直接沉淀得到前驱体再进行煅烧得到纳米氧化锌,对于反应条件对产品粒径、形貌及性能的影响未得到一致的结果,同时未较为全面地进行研究。笔者意在系统研究各个参数对产品的影响,而且通过直接液相沉淀一步得到纳米氧化锌,省去其中较为耗能的煅烧过程[11]。笔者以硝酸锌和氢氧化钠为原料,采用直接沉淀法合成纳米氧化锌,通过激光粒度仪、X射线衍射仪(XRD)、扫描电镜(SEM)等仪器分析研究在水溶液中合成较小中位径纳米氧化锌的最佳工艺条件。但是,在最优操作条件下制备的纳米氧化锌的性能未达到预期。考虑到液相直接合成法具有分散性差、易产生团聚[12]等特点,而且目前提出较多的团聚机理主要为表面效应、表面电子效应、毛细管吸附、晶桥理论、化学键理论、范德华力以及氢键作用,而水属于强极性溶剂,因此选用极性较弱且常见的醇溶剂来进行研究,对比不同醇溶剂制备纳米氧化锌的中位径、形貌的差异以及其对光催化性能的影响。
1 实验部分
1.1 实验原料
六水合硝酸锌、氢氧化钠、无水乙醇、正丙醇、正丁醇、正己醇、正庚醇、正辛醇、纳米氧化锌,均为分析纯;去离子水,实验室自制。
1.2 实验方法
1.2.1 纳米氧化锌的制备
1)以水为反应溶剂。称取一定量氢氧化钠溶于100 mL去离子水中,磁力搅拌30 min至完全分散,然后倒入250 mL三口烧瓶中,将其置于恒温水浴中加热至一定温度。称取一定量六水合硝酸锌溶于100 mL去离子水中,磁力搅拌5 min,然后置于恒温水浴中预热30 min,然后以1 mL/min的速率滴入上述三口烧瓶中。滴加完毕后恒温反应一段时间,悬浮液趁热过滤,用去离子水和无水乙醇分别洗涤3次,干燥得到纳米氧化锌。
2)以醇为反应溶剂。以不同碳链长度的醇为反应溶剂,按照上述方法制备纳米氧化锌。
1.2.2 分析表征
光催化降解实验以亚甲基蓝(MB)为降解物,在NAI-GHY-DSGGH型光催化反应器中进行降解反应。将25 mg纳米氧化锌加入到质量浓度为20 mg/L的25 mL MB溶液中,超声2 min后于暗处搅拌20 min,然后在光催化反应器中进行降解反应,每隔20 min取5 mL样品,即刻离心分离两次取上层清液,于UV-3100型紫外分光光度计(扫描波长为664 nm)中测其吸光度,以不加催化剂做空白对照。
使用XRD-6100型X射线粉末衍射仪对样品进行物相分析。使用JL-1166型激光粒度仪对样品的粒径进行测量。使用JSM-7500F型扫描电子显微镜以及谢乐方程分析XRD峰的宽度来确定ZnO粒径。使用UV-3100紫外可见分光光度计对MB质量浓度进行测定。
2 结果与讨论
2.1 水为溶剂制备纳米氧化锌
2.1.1 反应时间对纳米氧化锌粒径的影响
在c(Zn2+)=0.5 mol/L、c(Zn2+)∶c(OH-)=1∶2、反应温度为70℃条件下,将硝酸锌溶液滴加完时刻的反应时间记为 0 h, 分别进行 0、1、2、3、4、5、6、7、8、9 h恒温反应,考察反应时间对纳米氧化锌中位径的影响,结果见表1。由表1可知,随着反应时间增加,纳米氧化锌中位径逐渐减小,当反应时间为3 h后,纳米氧化锌中位径基本保持不变。这可能是因为反应按以下过程进行:

式(1)(2)反应速率快,属于毫秒级反应,随着硝酸锌不断加入,溶液中OH-浓度不断降低,体系过饱和度降低,纳米氧化锌结晶诱导期增长,因此需要增加反应时间来使纳米氧化锌结晶析出。当反应时间为3 h时,纳米氧化锌生成量达到最大。随着反应时间进一步延长,颗粒中位径变化不大,长径比增大。图1为反应时间分别为0、3、10 h制备的纳米氧化锌SEM照片。由图1可知,当反应时间过短或过长时,纳米氧化锌长径比以及粒径均比反应时间为3 h时大。因此,最佳反应时间为3 h。
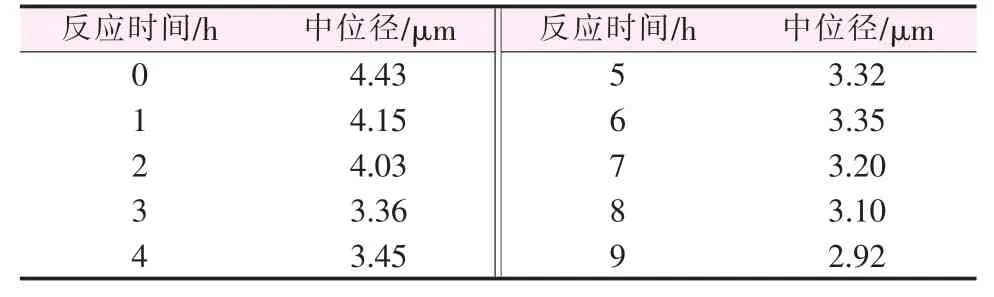
表1 不同反应时间制备纳米氧化锌中位径

图1 不同反应时间制备纳米氧化锌SEM照片
2.1.2 反应温度对纳米氧化锌粒径的影响
在c(Zn2+)=0.5 mol/L、c(Zn2+)∶c(OH-)=1∶2、反应时间为3 h条件下,分别在反应温度为50、60、70、80、90℃条件下进行反应,考察反应温度对纳米氧化锌中位径的影响,结果见表2。由表2可知,随着反应温度升高,产品的中位径先减小后增大,70℃时粒径最小。图2为不同反应温度制备纳米氧化锌SEM照片。由图2可知,当温度较低时,产品为片状不定型物质,即在温度较低时纳米氧化锌无法成型,产品中位径较大;随着温度升高,纳米氧化锌长径比增大;随着温度进一步升高,纳米氧化锌沿c轴生长速率加快,分子热运动加剧,团聚加剧。因此,最佳反应温度为70℃。

表2 不同反应温度制备纳米氧化锌中位径

图2 不同反应温度制备纳米氧化锌SEM照片
2.1.3 反应物浓度对纳米氧化锌粒径的影响
在c(Zn2+)∶c(OH-)=1∶2、反应时间为 3 h、反应温度为 70 ℃条件下,分别在反应物浓度[c(Zn2+)]为0.005、0.025、0.05、0.25、0.5 mol/L 条件下进行实验,考察反应物初始浓度对纳米氧化锌中位径的影响,结果见表3。由表3可知,随着反应物初始浓度增大,纳米氧化锌中位径先增大后基本不变并有略微减小。在反应物初始浓度较低时,体系中产品浓度低,分子热运动碰撞几率小,团聚较少;随着反应物初始浓度增加,产品浓度增大,团聚程度也增大;之后继续增加反应物初始浓度,对碰撞几率的影响不大,因而产品中位径基本变化不大。图3为不同反应物浓度制备纳米氧化锌SEM照片。由图3可知,当反应物初始浓度较小时,单个纳米颗粒粒径较大,主要是因为溶液中颗粒较少,空间位阻小,晶体生长不受限;适当增大反应物浓度有利于控制晶体生长。因而,最佳反应物初始浓度为0.5 mol/L。
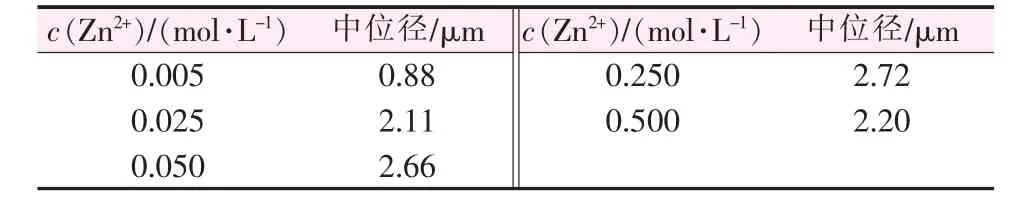
表3 不同反应物浓度制备纳米氧化锌中位径

图3 不同反应物浓度制备纳米氧化锌SEM照片
2.1.4 反应物配比对纳米氧化锌粒径的影响
在c(Zn2+)=0.5 mol/L、反应时间为 3 h、反应温度为70℃条件下,分别在反应物配比[c(Zn2+)∶c(OH-)]为 1∶1.00、1∶2.00、1∶2.05、1∶2.10、1∶2.50、1∶3.00条件下进行实验,考察反应物配比对纳米氧化锌中位径的影响。因反应物配比主要影响溶液pH,因而考察了溶液pH(反应结束时溶液pH)对纳米氧化锌中位径的影响,结果见表4。由表4可知,纳米氧化锌中位径随pH变化不大。氧化锌生长基元Zn(OH)42-具有负电性,在正极面上易生长,当溶液中OH-较多时,OH-吸附在正极面上,使得纳米氧化锌沿c轴生长趋势变缓,一定程度上减小了长径比。但是,纳米氧化锌属于两性氧化物,当OH-增大到一定值时,其会产生溶解现象,因而不宜将反应pH控制在较高范围。图4为不同pH制备纳米氧化锌SEM照片。结合图4看出,为得到形貌较好并使产品收益率最高,此处取反应物化学计量比为1∶2,可以得到较优产品。

表4 不同反应pH制备纳米氧化锌中位径

图4 不同反应pH制备纳米氧化锌SEM照片
2.1.5 纳米氧化锌降解MB的效果
取最优反应条件即反应时间为3 h、反应温度为70℃、锌离子浓度为0.5 mol/L、反应物配比为1∶2条件下制备的纳米氧化锌进行光催化降解MB实验,结果表明光照20 min MB降解率为15.06%,光照3 h MB降解率仅为70%,与阿拉丁纳米氧化锌光催化降解MB的结果相近。实验结果表明,以水为溶剂制备的纳米氧化锌光催化降低MB的效果不是特别理想。可能的原因是,以水为溶剂时,纳米氧化锌在强极性溶剂水中分散性能不好,团聚系数较大,因而考虑采用极性较弱且较常见的醇溶剂进行实验。
2.2 以醇为溶剂制备纳米氧化锌
2.2.1 不同醇溶剂对纳米氧化锌粒径的影响
在c(Zn2+)=0.5 mol/L、c(Zn2+)∶c(OH-)=1∶2、反应时间为3 h、反应温度为70℃条件下,以不同醇作为溶剂进行反应,得到纳米氧化锌中位径见表5。由表5可知,纳米氧化锌中位径与溶剂极性以及碳链长度无明显的关系。图5为不同醇溶剂制备纳米氧化锌SEM照片。从图5看出,不同醇溶剂制备纳米氧化锌的形貌随碳链长度的增长由球状向柱状发展,主要是纳米氧化锌各晶面生长速率不同。正常情况下纳米氧化锌具有沿c轴生长的趋势,然而对于不同的醇溶剂,其与各晶面之间的作用力不同,因而会选择性地吸附于纳米氧化锌某一晶面,后抑制该晶面的生长,由此产生不同的形貌。

表5 不同醇溶剂制备纳米氧化锌中位径

图5 不同醇溶剂制备纳米氧化锌SEM照片
2.2.2 不同醇溶剂制备纳米氧化锌光催化性能
以不同醇溶剂制备纳米氧化锌,考察其光催化降解MB的效率,结果见图6。由图6可知,无论以何种醇为溶剂,制备的纳米氧化锌对MB光催化降解率均随着时间的延长而增加,但速率不断降低。主要原因为,在光催化反应过程中,纳米氧化锌作为催化剂,溶液中的MB分子需扩散并吸附在催化剂表面才可以进行降解反应,随着反应的进行,溶液中的扩散推动力减小,因而光催化速率不断降低。由图6还可以看出,随着醇溶剂碳链长度的增加,制备的纳米氧化锌光催化性能总体不断降低。可能的原因是,随着醇溶剂碳链长度增加,溶剂黏度增大,纳米氧化锌分散性变差,颗粒团聚程度加剧,比表面积减小;另一方面,部分醇溶剂无法全部清除,附着在纳米氧化锌表面,占据了活性位点的同时增大了空间位阻,使得光催化性能减弱。因此,应选择碳链长度较短的醇作为溶剂合成纳米氧化锌,乙醇为最佳溶剂。
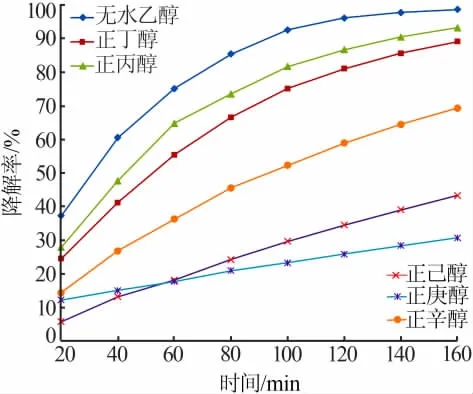
图6 不同醇溶剂制备纳米氧化锌对MB光催化降解率
3 结论
通过研究反应时间、反应温度、反应物浓度[c(Zn2+)]以及反应物配比[c(Zn2+)∶c(OH-)]等因素对直接沉淀法合成纳米氧化锌中位径以及形貌的影响,得到制备中位径较小、长径比适中的纳米氧化锌的最优反应条件,即:反应时间为3 h、反应温度为70 ℃、c(Zn2+)=0.5 mol/L、c(Zn2+)∶c(OH-)=1∶2。 在此操作条件下,研究了以不同种类的醇作为溶剂对合成纳米氧化锌中位径以及形貌的影响,并探讨其光催化性能。研究发现,随着溶剂碳链长度的增长,纳米氧化锌中位径呈现上下波动,无明显变化规律,形貌由球状向柱状发展,光催化性能总体不断减弱。该液相合成法操作简单、易于控制、成本低廉,以乙醇为溶剂制备的纳米氧化锌样品光催化效果较优且稳定,为工业化生产纳米氧化锌提供理论基础。
