非小细胞肺癌组织miR-155、PDCD4表达变化及意义
2019-09-18韩昕白维君
韩昕,白维君
(辽宁省肿瘤医院,沈阳110042)
肺癌是全球范围内发病率和病死率最高的恶性肿瘤,近年来我国肺癌发病率逐年增高,虽然手术、放化疗及新的靶向治疗药物不断发展,患者病死率仍较高,5年生存率低[1]。非小细胞肺癌(NSCLC)是肺癌最常见的病理类型,目前仍缺乏有效的早期筛查手段,大部分患者发现时已为中晚期,预后较差[2]。因此有必要深入研究NSCLC发生发展的分子机制。微小RNA(miRNA)是非编码RNA调控因子,长度为18~25个核苷酸,参与多种细胞信号传导通路的调控,在炎症、肿瘤、自身免疫性疾病中发挥重要的生物学作用[3]。miR-155在乳腺癌、肺癌、膀胱癌等肿瘤组织中异常表达,与患者总体生存期有关[4]。有研究表明,miR-155可结合并抑制抑癌基因VHL、TP53INP1等的表达,并促进核因子κB(NF-κB)、Janus酪氨酸蛋白激酶2/转录激活因子3(STAT3)通路的激活,导致肿瘤细胞增殖和远处转移[5]。程序性细胞死亡因子4(PDCD4)基因位于人类染色体10q25.2,具有抑癌基因的作用,其编码的PDCD4蛋白能结合并抑制真核翻译起始因子4A(eIF4A)的解旋酶活性,抑制肿瘤细胞核糖体的蛋白合成过程,促进肿瘤细胞凋亡[6]。目前对NSCLC组织中miR-155与PDCD4的表达变化研究较少。本研究通过检测NSCLC组织中miR-155、PDCD4的表达,初步探讨其临床意义。
1 资料与方法
1.1 临床资料 选取2015年2月~2017年12月于本院就诊并行手术治疗的NSCLC患者60例,男34例,女26例;年龄41~62(52.1±6.3)岁;肺腺癌39例,鳞状细胞癌(鳞癌)21例;TNM分期[7]:Ⅰ期15例、Ⅱ期20例,Ⅲ期20例,Ⅳ期5例;组织分化程度:高分化19例,中分化10例,低分化31例;伴淋巴结转移28例,无淋巴结转移32例。纳入标准:均经术后病理检查诊断为NSCLC;既往未接受过免疫治疗、化疗等;临床资料完整。排除标准:合并急性感染性疾病(急性胃肠炎、呼吸道感染等)、其他恶性肿瘤病史、严重的肝肺等脏器功能不全。本研究经本院伦理委员会审核批准,患者或其家属均签署知情同意书。
1.2 癌组织及癌旁组织中miR-155、PDCD4 mRNA表达检测 采用实时荧光定量PCR(qRT-PCR)技术。术中收集癌组织及其癌旁正常组织(距离癌组织边缘3 cm以上),置于冻存管内液氮罐中速冻,于-80 ℃冰箱保存。取组织约100 mg,分别应用总RNA提取试剂盒(RNAiso Plus,9108,Takara)及miRNA isolation试剂盒(RNAiso for Small RNA,9753A,Takara)提取组织中总RNA。紫外分光光度法鉴定RNA溶液的浓度及纯度,-80 ℃冰箱保存。以总RNA为模板,分别用cDNA合成试剂盒(One Step PrimeScript RT-PCR Kit,RR064, Takara )合成cDNA。严格按照反转录试剂盒说明书进行操作。miR-155特异性茎环正向引物序列:5′-CGGCGGTTTAATGCTAATCGTGAT-3′,反向引物序列:5′-CCAGTGCAGGGTCCGAGGTAT-3′;以U6作为内参,上游引物序列:5′-CGGCGGTCGTGAAGCGTTCCAT-3′,下游引物序列:3′-CCAGTGCAGGGTCCGAGGTAT-5′。PDCD4上游引物序列:5′-ATGTGGAGGAGGTGGATGTG-3′,下游引物序列:5′-TGGTGTTAAAGTCTTCTCAAATGC-3′;以β-actin作为内参,上游引物序列:5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物序列:5′-CTCCTTAATGTCACGCACGATTT-3′。miR-155的总反应体系20 μL,包括cDNA 2 μL、上下游引物各1 μL、PCR Master MixⅡ 10 μL、TaqMan miRNA assay 1 μL、RNse free水6 μL。PDCD4总反应体系25 μL,包括cDNA 2 μL、TaqDNA聚合酶0.25 μL、上下游引物各0.1 μL、10×PCR缓冲液2.5 μL、10 mmol/L dNTPs 0.5 μL,加双蒸水补充至25 μL。qRT-PCR反应条件:95 ℃ 3 min;95 ℃变性12 s、62 ℃退火50 s、72 ℃延伸10 s,共40个循环。反应均在ABI2500 qRT-PCR仪上完成,每个样本重复3次。用2-ΔΔCt法计算目的基因相对表达量。
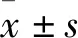
2 结果
2.1 癌组织与癌旁组织中miR-155、PDCD4 mRNA表达比较 癌组织与癌旁组织中miR-155相对表达量分别为3.342±0.784、0.651±0.192,PDCD4 mRNA相对表达量分别为0.133±0.021、1.153±0.352。癌组织中miR-155相对表达量高于癌旁组织(t=26.244,P=0.000),PDCD4 mRNA相对表达量低于癌旁组织(t=22.347,P=0.000)。
2.2 癌组织中miR-155、PDCD4 mRNA表达与NSCLC患者临床病理参数的关系 癌组织中miR-155、PDCD4 mRNA表达与肿瘤分期及组织学分级有关(P均<0.05),而与患者性别、年龄及肿瘤病理类型、直径及淋巴结转移无关(P均>0.05)。见表1。
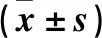
表1 癌组织中miR-155、PDCD4 mRNA表达与NSCLC患者临床病理参数的关系
2.3 NSCLC组织中miR-155与PDCD4 mRNA表达的相关性 NSCLC组织中miR-155相对表达量与PDCD4 mRNA相对表达量呈负相关(r=-0.618,P=0.000)。
3 讨论
80%~85%的肺癌为NSCLC,而NSCLC中鳞癌和腺癌最为常见[8]。虽然近年来诊断和治疗技术取得较大发展,但NSCLC患者的5年生存率仍较低[9],因此需深入研究其发病机制。非编码RNA如LncRNA、miRNA等在肿瘤的发生和进展中发挥重要作用,通过调控细胞信号传导及靶基因的表达,影响肿瘤细胞增殖、分化、凋亡及浸润转移等生物学行为[10]。miRNA是一类小的非编码RNA,是转录后基因调控的主要参与者,可结合靶基因mRNA的3′非编码区,影响mRNA的稳定性和基因表达。miRNA在正常生理和病理条件下均起重要的调控作用。肿瘤细胞内的miRNA可促进肿瘤相关基因(p65、STAT3等)的表达,同时能抑制抑瘤基因(PTEN、VHL等)的表达,在肿瘤增殖、凋亡、浸润转移、肿瘤干细胞特性维持、肿瘤代谢、肿瘤血管生成及免疫逃逸等多个方面发挥重要的调控作用。在NSCLC组织中已检测出多种miRNA表达异常,如miR-155、miR-133b等,检测其表达有助于NSCLC的早期诊断、治疗及预后评估[11]。其中miR-155可结合SOCS1、SOCS6和PTEN等基因mRNA的3′非编码区,直接抑制抑瘤基因的表达,发挥促进肿瘤发生发展的生物学效应。
PDCD4作为一种细胞凋亡相关基因,能编码长度约469个氨基酸,其氨基端的α螺旋结构区能结合翻译起始因子eIF4A的N端,通过抑制核糖体复合物形成,影响蛋白合成。其在凋亡诱导过程中表达上调,而在直肠癌、胰腺癌等多种肿瘤组织中均发现其表达下调[12]。现已证实多种miRNA能调控PDCD4表达,如胰腺癌组织中miR-429能促进肿瘤细胞中PDCD4表达[13],而在NSCLC组织中miR-21可调控PI3K/AKT/mTOR信号通路,抑制PDCD4表达[14,15]。而目前NSCLC中miR-155与PDCD4的关系报道较少,有必要深入研究。
本研究癌组织中miR-155的相对表达量高于癌旁组织,与以往研究[16]报道一致。目前miR-155高表达的机制尚不明确,可能与其编码基因miR-155HG启动子区的表观遗传学修饰,如乙酰化修饰后的激活有关[17]。尚有研究显示,长链非编码RNA(如XIST)能作为内源竞争性RNA结合miR-155,抑制miR-155对下游癌基因TERF1、CDX1等表达的影响,抑制肿瘤细胞增殖和转移,而肿瘤发生时XIST基因表达降低,对miR-155的抑制作用减弱[18]。此外,本研究NSCLC癌组织中miR-155的表达与肿瘤分期、组织学分级有关,肿瘤分期Ⅲ~Ⅳ期、低分化的癌组织中miR-155表达高。表明癌组织中miR-155表达与NSCLC的发生发展有关。研究表明,miR-155高表达能够激活PI3K/SGK3/β-catenin信号通路,促进肿瘤细胞发生上皮间质转化(EMT),进而促进肿瘤的局部浸润和远处转移,导致患者预后不良[19]。本研究癌组织中miR-155与PDCD4的表达呈负相关,其机制可能为PDCD4是miR-155的靶基因,miR-155能够结合PDCD4 mRNA的3′非编码区,通过降低PDCD4 mRNA稳定性,干扰PDCD4的翻译。而在体外细胞实验中沉默miR-155表达后,PDCD4表达增加,并抑制肿瘤细胞的浸润和侵袭[20]。
本研究癌组织中PDCD4 mRNA相对表达量低于癌旁组织,其原因一方面与PDCD4基因5′CpG岛的高甲基化影响基因转录有关;另一方面小非编码RNA降低PDCD4 mRNA的稳定性,在翻译水平降低其表达。此外,PDCD4能结合并抑制NF-κB p65的活性,抑制转录因子STAT3及下游靶基因表达,当PDCD4表达减少后,STAT3促进miR-181b表达,进一步抑制PDCD4表达,形成一条负反馈环路。本研究NSCLC组织中PDCD4的表达与肿瘤分期、组织学分级有关,肿瘤分期Ⅲ~Ⅳ期、低分化癌组织中PDCD4表达低。表明PDCD4可能参与NSCLC发生发展的过程。目前其机制尚不明确,其原因可能为PDCD4表达越低,与转录因子twist1的DNA结合域的结合减少。twist1活化下游靶基因如Vimentin的表达,抑制E-钙黏素的表达,促进肿瘤细胞发生EMT,进而促进肿瘤的浸润和转移。
综上所述,NSCLC组织中miR-155表达升高,而PDCD4表达降低,两者共同参与NSCLC的发生发展,有可能成为NSCLC诊断、治疗及预后评估的肿瘤标志物,但两者之间的具体机制有待进一步研究。
