从健康人外周血单个核细胞中分离出高纯度的CD3-CD56+CD16+NK细胞对肝癌细胞的杀伤作用分析
2019-09-18沙卫红王启仪
卢 铨, 陈 浩, 沙卫红, 王启仪
1.汕头大学医学院,广东 汕头 515041; 2.广东省人民医院 广东省医学科学院消化内科
自然杀伤细胞(natural killer cells,NK)是机体天然免疫系统的主要细胞成分之一,在抗病毒、抗肿瘤和移植排斥反应中起着十分重要的作用[1-2]。由于它无编码受体成分的基因重排,即无需肿瘤特异性抗原识别便可以直接杀伤肿瘤细胞,因此被认为是肿瘤免疫治疗的重要效应细胞[3]。
NKG2D是一个与肿瘤免疫相关的受体,在人体内主要表达于NK细胞、T细胞表面,通过与机体应激配体的结合激活免疫细胞,从而清除破坏的或转变的细胞[4]。课题组前期研究表明,原发性肝癌患者的NK细胞杀伤率、NK细胞表面NKG2D的表达率明显降低,提高NK细胞NKG2D的表达水平有助于增强肝癌的过继免疫治疗[5]。研究表明,CD3-CD56+CD16+NK细胞亚群主要分布于外周血,是主要的毒性杀伤细胞;而CD3-CD56+NK细胞亚群主要分布于淋巴结及炎症部位,分泌大量细胞因子[6]。随后对NK细胞多个亚群进行分析,发现CD3-CD56+CD16+NK细胞表面CD95、NKG2D及细胞内穿孔素和颗粒酶B的阳性表达率较CD3-CD56+NK细胞亚群明显升高,表明其具有更佳的靶细胞杀伤作用[7]。由于既往研究表明,白介素2(interleukin-2,IL-2)、白介素15(interleukin-15,IL-15)或干细胞刺激因子(stem cell factor,SCF)能诱导NK细胞增殖,并上调NK细胞表面NKG2D的表达[8-10]。因此在本次研究中,通过观察经IL-2/IL-15/SCF联合诱导的CD3-CD56+CD16+NK细胞的体外扩增能力和NKG2D的表达变化,探讨其对肝癌细胞杀伤活性的影响。
1 材料与方法
1.1 材料
1.1.1 肿瘤细胞株:人肝癌细胞株HepG2、SMMC-7721由广东省人民医院中心实验室保存并传代。
1.1.2 主要试剂:APC-Cy7-CD16、PE-Cy5-CD56购自美国Bjolegend公司;PE-Cy7-CD3、FITC-NKG2D购自美国e-Bioscience公司;NK cell Biotin-Antibody Cocktail、NK cell MicroBead Cocktail、Pre-SeperationFilte、MiniMACS Seperator、MS Column及MACS缓冲液均购自德国Miltenyi公司;CCK-8试剂盒购自碧云天生物研究所;重组人IL-2和SCF购自上海普欣公司;重组人IL-15购自Protech公司;NKG2D单抗购自R&D公司。
1.2 实验时间及地点本实验于2017年10月至2018年8月在广东省人民医院中心实验室完成,为细胞体外实验。
1.3 实验方法
1.3.1 免疫磁珠分选法分离纯化NK细胞:抽取新鲜健康成人外周血15 ml,肝素抗凝,用淋巴细胞分离液常规方法分离得到外周血单个核细胞,用MACS缓冲液重悬细胞。依次加入NK cell Biotin-Antibody Cocktail和NK cell MicroBead Cocktail作细胞阳性分选,收集富含NK细胞的细胞悬液,用流式细胞术检测CD3-CD56+CD16+NK细胞纯度。
1.3.2 实验分组:磁珠纯化后的NK细胞后分为4组,分别为:(1)空白对照组:不添加任何细胞因子;(2)IL-2组:加入终浓度为500 U/ml的IL-2;(3)IL-15组:加入终浓度为20 ng/ml的IL-15;(4)IL-2/IL-15/SCF组:加入终浓度为500 U/ml的IL-2、100 U/ml的SCF和20 ng/ml的IL-15。培养基为体积分数为10% AB血清的SCGM培养基,置于37 ℃,体积分数为5%的CO2条件下培养孵育。每3 d换液并补充相应细胞因子。于培养第14天用锥虫蓝染色计数法检测细胞扩增能力变化。
1.3.3 流式细胞术检测细胞表面NKG2D表达水平:取培养14 d的各组NK细胞,按1×106μg-1细胞加入FITC-NKG2D,上流式细胞仪检测。使用Cell Quest软件处理资料,检测NKG2D表达水平。封闭NKG2D受体时,10 μl NKG2D单抗(终质量浓度10 μg/ml)封闭5×105ml-1NK细胞上NKG2D受体,以流式细胞术检测封闭效果。
1.3.4 检测NK细胞对肝癌细胞杀伤活性:按效靶比为10∶1,取培养14 d的各组NK细胞,细胞数量为1×105/(100 μl),分别与对数生长期的HepG2、SMMC-7721细胞[调整肿瘤细胞数量为1×104/(100 μl)]混合,加入96孔板中,作为实验孔,每组样品设3个复孔;同时设相应的靶细胞孔(只加入肿瘤细胞),效应细胞孔(只加入各组NK细胞)和培养基空白对照孔。将培养板置饱和湿度为37 ℃、体积分数为5%的CO2环境下培养12 h,每孔加入10 μl的CCK-8溶液,继续培养4 h后450 nm波长测吸光度值,吸光度值均为3个复孔所得平均值。杀伤活性/%= [1-(实验孔吸光度值-效应孔吸光度值)/靶细胞孔吸光度值]×100%。
1.4 主要观察指标免疫磁珠分选前后、IL-2/IL-15/SCF诱导前后、NKG2D封闭前后CD3-CD56+CD16+NK细胞的杀伤活性。
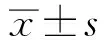
2 结果
2.1 免疫磁珠分选前后CD3-CD56+CD16+NK细胞纯度和杀伤活性的变化外周血单个核细胞经免疫磁珠分选后,CD3-CD56+CD16+NK细胞的纯度由纯化前的(21.12±2.34)%增至(89.07±1.89)%(见图1)。效靶比为10∶1时,分选前后NK细胞对HepG2、SMMC-7721细胞杀伤率存在明显差异,差异有统计学意义(P<0.05)(见图2)。
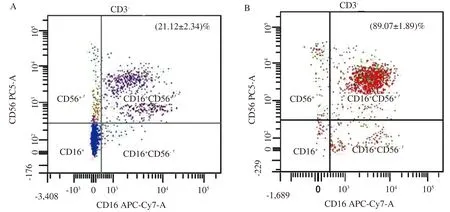
图1 流式细胞仪检测CD3-CD56+ CD16+NK 细胞的纯度A:免疫磁珠分选前;B:免疫磁珠分选后Fig 1 Purity of CD3-CD56+ CD16+NK cells detected by flow cytometry A:before MACS purification; B:after MACS purification
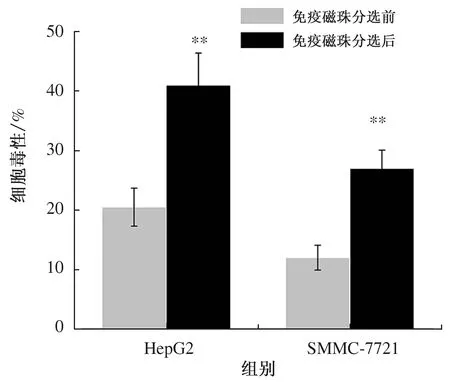
注:与免疫磁珠分选前比较,**P<0.05。
2.2 IL-2/IL-15/SCF诱导前后CD3-CD56+CD16+NK细胞扩增能力、NKG2D表达和杀伤活性的变化经免疫磁珠纯化的NK细胞在不同培养体系中培养扩增的第14天,IL-2组、IL-15组和IL-2/IL-15/SCF组扩增倍数分别为(10.12±1.21)%、(15.37±1.37)%和(32.87±3.51)%。IL-2/IL-15/SCF组的扩增倍数显著高于其余各组(P<0.05)。
NKG2D在CD3-CD56+CD16+NK细胞上呈高表达,随着培养时间延长,各组NKG2D表达率均持续升高,而IL-2/IL-15/SCF组升高的速率显著高于其余各组(P<0.05),提示IL-2/IL-15/SCF联用可以进一步促进CD3-CD56+CD16+NK细胞上NKG2D的表达(见图3、表1)。
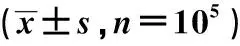

组别培养前培养14 d对照组39.21±4.1240.54±5.76IL-2组38.79±3.92 53.82±5.03#IL-15组39.57±4.0156.72±5.76#IL-2/IL-15/SCF组40.12±4.6573.41±6.37#*
注:与对照组相比,#P<0.05; IL-2/IL-15/SCF组与其余组相比,*P<0.05。
效靶比为10∶1时,IL-2组、IL-15组、IL-2/IL-15/SCF组的NK细胞对肝癌细胞杀伤活性逐渐增强。其中IL-2/IL-15/SCF诱导的CD3-CD56+CD16+NK细胞在培养14 d后对HepG2、SMMC-7721肝癌细胞的杀伤活性分别为(68.12±4.25)%和(51.12±4.95)%,较其余3组杀伤活性显著增强(P<0.05)(见表2~3),提示IL-2/IL-15/SCF可以增加NK细胞对HepG2、SMMC-7721的杀伤活性。

图3 第14天各组CD3-CD56+CD16+NK细胞表面NKD2G受体表达情况 Fig 3 The expression of NKD2G on CD3-CD56+CD16+ NK cells at 14 days of culture
2.3 NKG2D封闭后对CD3-CD56+CD16+NK细胞杀伤不同肝癌细胞株活性的影响NKG2D单抗封闭NK细胞表面NKG2D分子后,各组NK细胞对HepG2细胞的杀伤活性较阻断前相比显著下降(P<0.05)(见表2),提示NK细胞的NKG2D在高表达NKG2D配体的肿瘤细胞杀伤中起重要的作用。而在低表达NKG2D配体的SMMC-7721细胞,封闭了NK细胞表面NKG2D分子后,各组NK细胞对该肿瘤细胞的杀伤活性影响轻微(见表3),提示对低表达NKG2D配体的SMMC-7721细胞的杀伤作用可能还通过非NKG2D途径来实现。
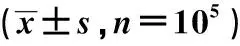

组别不封闭封闭NKD2G对照组39.21±4.1221.84±5.76#IL-2组48.72±3.2223.92±2.03#IL-15组54.57±4.3123.72±2.76#IL-2/IL-15/SCF组68.12±4.2528.21±6.17#*
注:与封闭前相比,#P<0.05;封闭后IL-2/IL-15/SCF组与其他3组相比,*P<0.05。
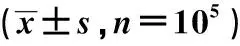
表3 第14天用CCK-8试剂测得NK细胞对SMMC-7721细胞的杀伤活性Tab 3 Cytotoxicity to SMMC-7721 detected by CCK-8 assay at 14th day of culture %
注:与封闭前相比,#P>0.05。
3 讨论
课题组前期研究和既往多项研究均表明,肝癌患者的NK细胞数量、杀伤率、表面NKG2D的表达率明显降低[3,6-7],提高NK细胞NKG2D表达水平,有助于改善肝癌的治疗和预后。基于此,利用IL-2/IL-15/SCF诱导激活纯化的CD3-CD56+CD16+NK细胞,观察诱导后其体外扩增能力、NKG2D表达及其对不同肝癌细胞株杀伤作用的变化。实验结果表明,IL-2/IL-15/SCF能增强CD3-CD56+CD16+NK细胞体外扩增能力、NKG2D表达水平以及对多种肝癌细胞株的杀伤能力。这一作用主要通过上调NKG2D表达引起,但CD3-CD56+CD16+NK细胞对不同肝癌细胞株和NKG2D封闭后杀伤活性的差异,表明其杀伤作用具有多种机制,并非完全依赖于NKG2D机制。
NK细胞在体内外可以被多种细胞因子活化,从而促进NK细胞的分化、增殖及细胞毒效应。IL-2、IL-15是活化NK细胞最常用的细胞因子,两者均通过IL-2R发挥作用,联用时可产生协同作用提高生物学效应[11-13]。SCF主要由骨髓基质细胞产生,与IL-2联用时能促进NK细胞的增殖,抑制NK细胞的凋亡,与IL-15联用时能促进CD56+造血干细胞定向分化为NK细胞,有利于NK细胞的发育分化及体外存活[14]。实验将3种细胞因子联用,旨在协同激活NK细胞的增殖、成熟及细胞毒活性。实验结果表明,与常用的单用IL-2和IL-15比较,IL-2/IL-15/SCF诱导的CD3-CD56+CD16+NK细胞具有更强的体外扩增能力,并且能明显上调NK细胞表面NKG2D的表达及更强的肝癌细胞杀伤活性。
NK细胞的杀伤作用与其细胞表面的受体和靶细胞表面的配体密切相关。NKG2D在所有NK细胞表面均有表达,是介导NK细胞杀伤活性的主要活化性受体[15]。NK细胞表面的NKG2D受体通过与肿瘤细胞表面的相应配体结合使NK细胞活化获得攻击靶细胞的能力。人的NKG2D配体有多种,其中MHC-Ⅰ类相关分子MICA(MHC class I chain-related gene A)为NKG2D最主要配体之一[16]。王义平等[17]发现,NK细胞的杀伤活性与多种肿瘤细胞MICA表达水平呈正相关。黎建军等[18]对BEL7402、HepG2、SMMC-7721等肝癌细胞表面MIC蛋白表达进行分析,发现BEL7402及HepG2细胞株表面表达MIC,而SMMC-7721则很少表达。实验结果表明IL-2/IL-15/SCF诱导的CD3-CD56+CD16+NK细胞对HepG2杀伤作用最强,而对SMMC-7721杀伤作用较弱。提示NK细胞杀伤肝癌细胞的能力和肝癌细胞MIC的表达密切相关。对于高表达膜型MICA的HepG2细胞株,封闭NKG2D表达后,CD3-CD56+CD16+NK细胞对其杀伤效应显著下降,表明NKG2D-NKG2DL途径是NK细胞杀伤表达相应配体的肿瘤细胞的重要方式。对于不表达膜型MICA的SMMC-7721细胞,NK细胞对其杀伤效应较弱,封闭NKG2D后其杀伤效应下降不明显。提示NK细胞对该类型肝癌细胞的杀伤可能存在非NKG2D依赖的机制,比如NK细胞表面的其他活化性受体如NCRs、DNAM-1等也可能参与到杀伤作用中,相关机制有待下一步研究证实。
