儿科重症监护室耐碳青霉烯类肠杆菌科细菌的分布特征及危险因素分析
2019-09-17李秋阳金凤玲
李秋阳,金凤玲
(1.兰州大学第一临床医学院,甘肃兰州 730000;2.兰州大学第一医院,甘肃兰州 730000)
碳青霉烯类作为目前抗菌谱最广的抗菌药物,对革兰阳性及革兰阴性菌均有良好的抗菌作用。但由于抗菌药物的滥用,近年来细菌的耐药率不断增高,肠杆菌科细菌对碳青霉烯类耐药也呈逐年上升趋势[1-2]。儿童作为一类特殊群体,因各器官系统发育不完善而成为了耐碳青霉烯类肠杆菌科细菌(CRE)感染的好发人群[3]。儿科重症监护室(PICU)的患儿由于一般情况差、免疫力低下、病情重及侵入性操作多,使肠杆菌科细菌感染及耐药的可能性相对升高。为提高对CRE感染的防治能力,本研究通过病例对照研究方法来探讨PICUCRE的分布特征及危险因素,现报道如下。
1 资料与方法
1.1一般资料 本文采用病例对照(1∶1)研究,收集兰州大学第一医院PICU 2013年3月至2018年4月分离CRE的病例共81例,选取PICU同时期分离出碳青霉烯类敏感肠杆菌科细菌(CSE)且性别、年龄、标本来源、菌种相近者81例,呼吸道标本合格标准参考《全国临床检验操作规程》(第3版)。将分离CRE者定义为CRE组,分离CSE者定义为CSE组[4]。由于新生儿的特殊性,又根据患儿年龄分为新生儿与非新生儿两组分别进行统计分析。新生儿CRE组42例,平均年龄13.40 d,男性比例64.3%;CSE组42例,平均年龄15.90 d,男性比例64.3%。非新生儿CRE组39例,平均年龄180.72 d,男性比例46.2%;CSE组39例,平均年龄246.51 d,男性比例48.7%。
1.2仪器与试剂 采用VITEK 2全自动细菌鉴定仪及其配套革兰阴性细菌鉴定卡(GN)、药敏卡(GN13)进行细菌鉴定及药敏试验。补充药敏试验按美国临床实验室标准化协会(CLSI)推荐的K-B纸片扩散法进行,结果判断依据CLSI推荐的标准。质控菌株为大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213、粪肠球菌ATCC 29212和铜绿假单胞菌ATCC 27853。
1.3统计学处理 分别回顾性分析新生儿与非新生儿病例资料,采用χ2检验与非参数秩和检验进行单因素分析,采用二元logistics回归进行多因素分析。采用SPSS23.0软件进行统计学分析。
2 结 果
2.1CRE患者资料分布特征
2.1.1新生儿 CRE患者资料分布特征
2.1.1.1标本来源 在43株CRE中,纳入分析标本42例(1例同时检出2种CRE),其中呼吸道来源标本29例(69.0%),血流标本9例(21.4%),泌尿系1例(2.4%),皮肤软组织标本3例(7.1%)。见表1。
2.1.1.2菌株构成 在43株CRE中,肺炎克雷伯菌24株(55.8%),阴沟肠杆菌13株(30.2%),大肠埃希菌的3株(7.0%),产酸克雷伯菌1株(2.3%),弗劳地柠檬酸杆菌1株(2.3%),产气肠杆菌1株(2.3%)。见表1。
2.1.1.3首次检出CRE距入院时间 在42例CRE患者中,首次检出CRE距入院时间≤3 d 10例(23.8%),3<入院时间≤7 d 9例(21.4%),7<入院时间≤11 d 9例(21.4%),11<入院时间≤15 d 4例(9.5%),入院时间>15 d 10例(23.8%),平均首次检出CRE距入院时间为10.1 d;在42例CSE患者中,首次检出CRE距入院时间入院时间≤3 d 16例(38.1%),3<入院时间≤7 d 13例(31.0%),7<入院时间≤11 d 7例(16.7%),11<入院时间≤15 d 2例(4.8%),入院时间>15 d 4例(9.5%),平均首次检出目标CSE距入院时间为5.9 d。
2.1.2非新生儿CRE患者资料分布特征
2.1.2.1标本来源 39株CRE均为呼吸道来源(100%)。见表1。
2.1.2.2菌株构成 在39株CRE中,肺炎克雷伯菌28株(71.8%),阴沟肠杆菌8株(20.5%),大肠埃希菌2株(5.1%),产酸克雷伯菌1株(2.6%)。见表1。
2.1.2.3首次检出CRE距入院时间 在39例CRE患者中,首次检出CRE距入院时间≤3 d 10例(25.6%),3<入院时间≤7 d 13例(33.3%),7<入院时间≤11 d 9例(23.1%),11<入院时间≤15 d 3例(7.7%),>15 d 4例(10.3%),平均首次检出CRE距入院时间为8.5 d;在39例CSE患者中,首次检出CRE距入院时间≤3 d 21例(53.8%),3<入院时间≤7 d 8例(20.5%),7<入院时间≤11 d 3例(7.7%),11<入院时间≤15 d 3例(7.7%),入院时间>15 d 4例(10.3%),平均首次检出目标CSE距入院时间为6.5 d。
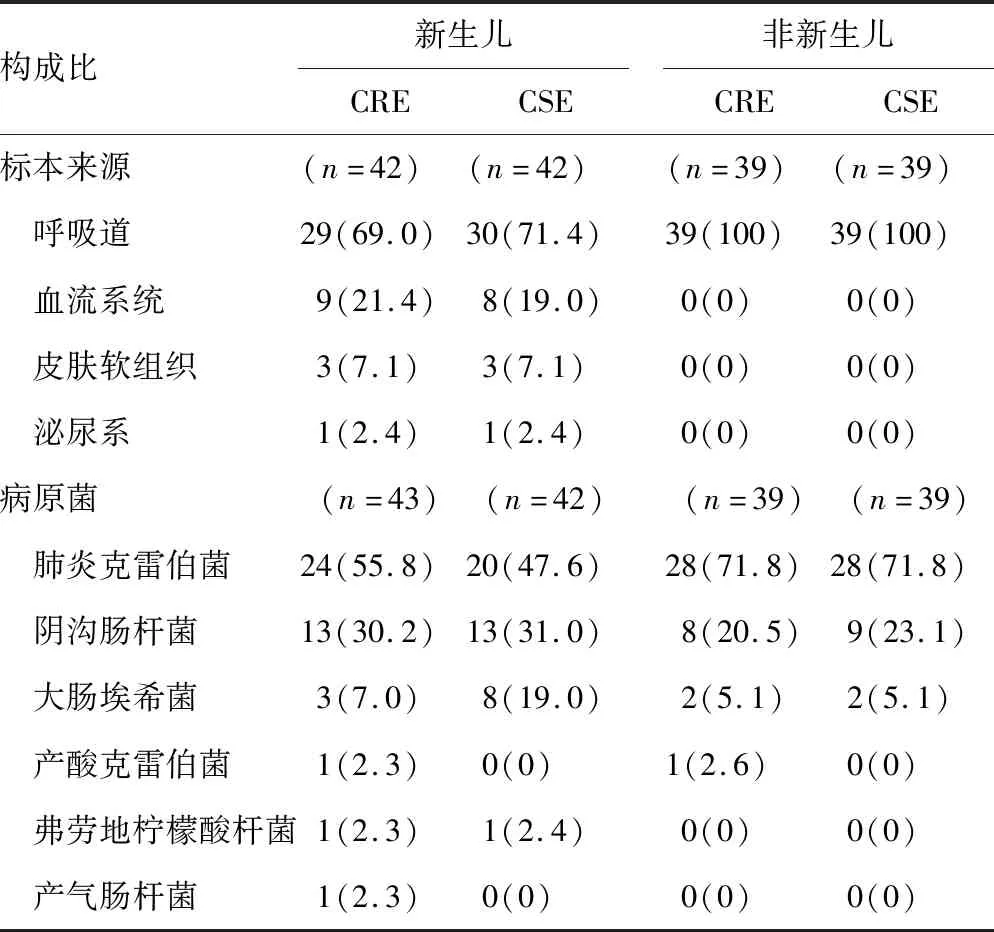
表1 标本来源与菌株的分布及构成比[n(%)]
注:新生儿42例CRE患者中有1例同时检出2种CRE
2.2CRE感染或定植的危险因素分析
2.2.1新生儿 CRE感染或定植的危险因素分析
2.2.1.1单因素分析 通过单因素对比分析,发现之前总抗菌药物使用时间、碳青霉烯类暴露时间、头孢类暴露时间、呼吸机使用时间、静脉置管、剖宫产分娩以及低出生体质量可能是新生儿CRE感染或定植的危险因素(P<0.05)。见表2~3。
2.2.1.2多因素分析 将上述因素纳入二元logistics回归模型,发现所有协变量均无统计学意义。见表4。
2.2.2非新生儿CRE感染或定植的危险因素分析
2.2.2.1单因素分析 通过单因素对比分析,发现之前总抗菌药物暴露时间、β-内酰胺酶抑制剂复合制剂暴露时间、联用头孢类与利奈唑胺时间、联用拉氧头孢与利奈唑胺时间及呼吸机使用时间可能是非新生儿CRE感染或定植的影响因素(P<0.05)。见表2~3。
2.2.2.2多因素分析 将上述因素纳入二元logistics回归模型,发现之前呼吸机使用时间是独立危险因素,而使用β-内酰胺酶抑制剂复合制剂是可能减少CRE感染或定植的独立保护因素。见表4。
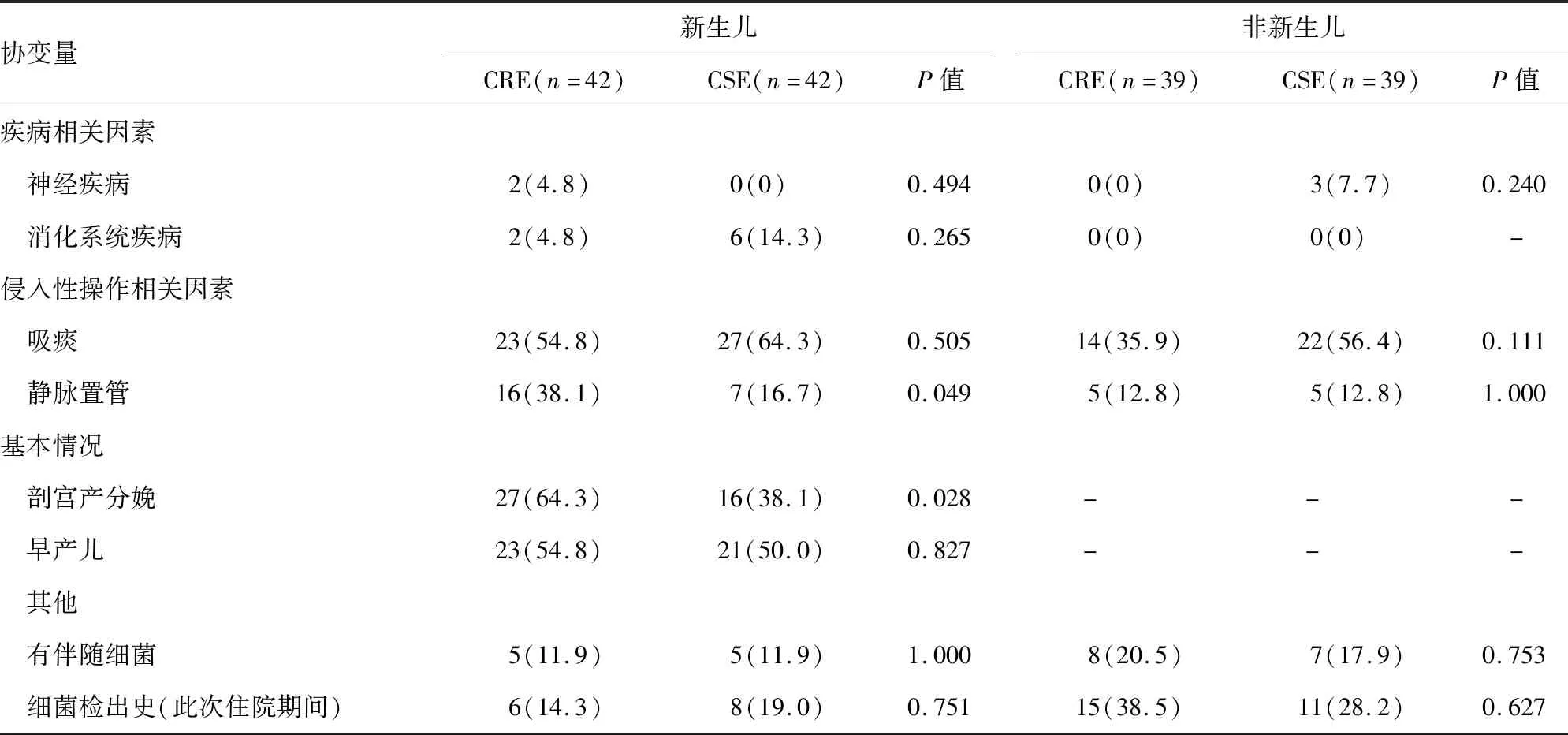
表2 CRE感染或定植的单因素分析[n(%)]
注:-表示无数据

表3 CRE感染或定植的单因素分析
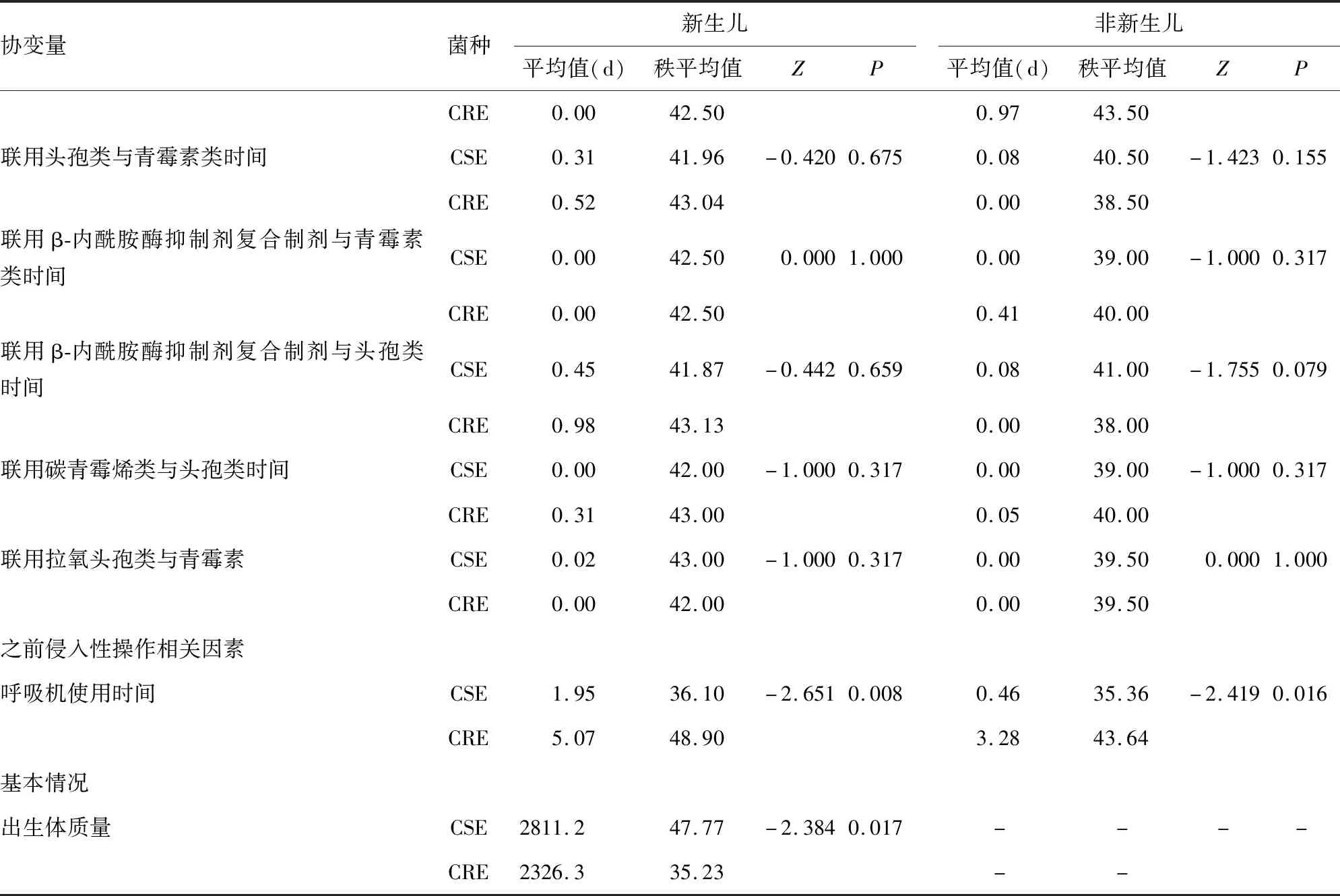
续表3 CRE感染或定植的单因素分析
注:-表示无数据
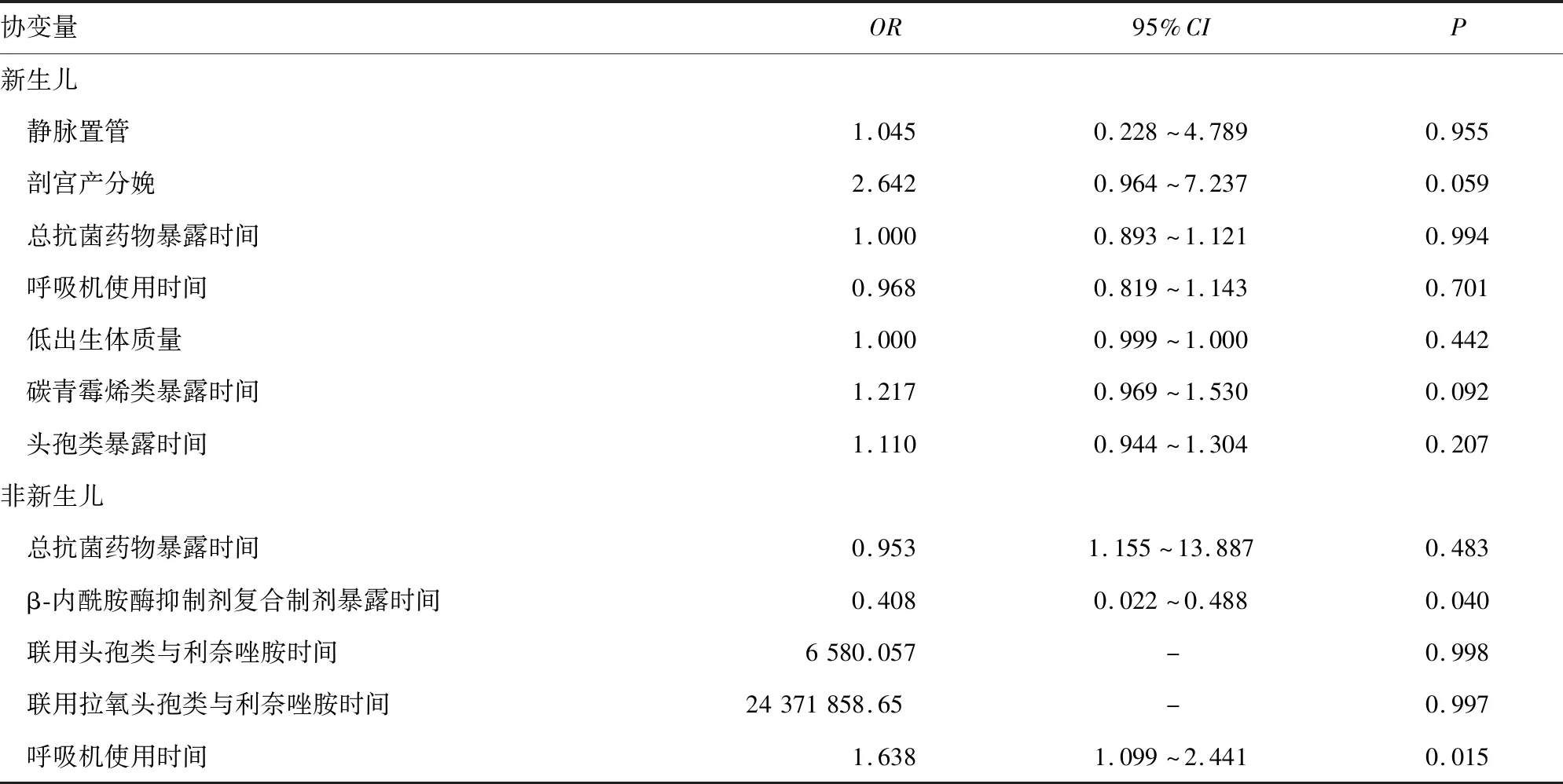
表4 新生儿与非新生儿CRE感染或定植的多因素分析
注:-表示无数据
2.3结局
2.3.1预后 新生儿CRE组放弃治疗3例,死亡2例;CSE组放弃治疗2例,死亡1例。非新生儿CRE组放弃治疗3例,CSE组放弃治疗1例。通过χ2检验,发现以上预后无明显差异(新生儿放弃治疗P=1.000,死亡P=1.000;非新生儿放弃治疗P=0.615,死亡P=1.000)。
2.3.2出院复查结果
2.3.2.1新生儿出院复查结果 CRE组有20例进行了复查,复查阴性者11例(11/20),其中使用含碳青霉烯类或氨基糖苷类治疗方案者5例(5/11),使用其他抗菌药物治疗者6例(6/11);复查阳性者9例(9/20),其中使用含碳青霉烯类或氨基糖苷类治疗方案者1例(1/9),使用其他抗菌药物治疗者8例(8/9)。
2.3.2.2非新生儿出院复查结果 CRE组有18例进行了复查,复查阴性者10例(10/18),其中使用含碳青霉烯类或氨基糖苷类治疗方案者7例(7/10),使用其他抗菌药物治疗者3例(3/10);复查阳性者8例(8/18),其中使用含碳青霉烯类或氨基糖苷类治疗方案者2例(2/8),使用其他抗菌药物治疗者5例(5/8),未使用抗菌药物者1例(1/8)。
3 讨 论
在本研究将PICU 2013年3月至2018年4月分离出CRE的病例均纳入了分析,但这些病例中实际上只有一部分为CRE感染,而其中又仅有少部分为医院内感染[5-6],其余均为CRE定植或污染,因此本研究旨在探讨CRE感染或定植的特征及危险因素。
研究结果显示,新生儿CRE标本的主要来源为呼吸道,其次为血流系统,少数为皮肤软组织及泌尿道;非新生儿标本来源均为呼吸道。新生儿呼吸道标本的构成比低于非新生儿,而血流系统构成比则较其高,可能的原因是新生儿静脉置管率明显高于非新生儿,导致其血流系统细菌定值、污染及感染机会增多。PICU新生儿与非新生儿分离的CRE的病原菌主要为肺炎克雷伯菌,其次为阴沟肠杆菌,这与DIRAJLAL-FARGO等[7]的报道相近。对于首次检出CRE距入院天数,新生儿与非新生儿CRE组天数超过7 d的构成比均高于CSE组,同时CRE组平均值均大于CSE组,提示CRE组的入院距首次检出CRE时间长于CSE组。
本研究通过单因素与多因素分析发现,之前总抗菌药物暴露时间、碳青霉烯类暴露时间、头孢类暴露时间、呼吸机使用时间、静脉置管、剖宫产分娩以及低出生体质量可能是新生儿CRE感染或定植的危险因素,但多因素分析显示以上协变量均差异无统计学意义,这可能是由于新生儿组样本量少、模型分析不稳定导致,其单因素分析结果仅作提示作用。之前总抗菌药物使用时间、β-内酰胺酶抑制剂复合制剂暴露时间、联用头孢类与利奈唑胺时间、联用拉氧头孢与利奈唑胺时间及呼吸机使用时间可能是非新生儿 CRE感染或定植的影响因素,其中之前呼吸机使用时间是独立危险因素,而β-内酰胺酶抑制剂复合制剂暴露时间则是可能减少CRE感染或定植的独立保护因素。
在其他学者的研究中[7-10],之前抗菌药物的使用是儿童CRE感染或定植的独立危险因素,表明抗菌药物使用在肠杆菌科细菌的碳青霉烯类耐药中扮演着重要角色,体现了临床工作中合理使用抗菌药物的必要性。而在本研究中,之前总抗菌药物使用时间、碳青霉烯类暴露时间、头孢类暴露时间等仅在单因素分析中有意义,其原因可能有以下几点:(1)本研究样本量较少;(2)部分病例可能存在院外治疗信息缺失从而导致统计偏差;(3)检测水平的差异;(4)在多因素分析中该协变量与其他协变量存在共线性现象。
β-内酰胺酶抑制剂复合制剂作为β-内酰胺类与β-内酰胺酶抑制剂的复合剂,其后者可以抑制β-内酰胺酶,使β-内酰胺类抗菌药物的β-内酰胺环免遭破坏,从而保护了其原有的抗菌活性[11]。而碳青霉烯酶作为CRE最常见的耐药机制,也属于β-内酰胺酶[12],其中A类碳青霉烯酶的活性中心均含丝氨酸结构,可被酶抑制剂他唑巴坦和克拉维酸抑制[13]。故β-内酰胺酶抑制剂复合制剂可能通过抑制肠杆菌科细菌的A类碳青霉烯酶活性,减少碳青霉烯类耐药的发生。但由于尚未见到其他类似研究结果,因此关于β-内酰胺酶抑制剂复合制剂能否预防CRE感染仍需进一步探讨。
在WU等[14]和蔡冰超等[15]的研究中,使用碳青霉烯类抗菌药物是成人耐碳青霉烯类肺炎克雷伯菌感染的独立危险因素,提示碳青霉烯类抗菌药物对肠杆菌科细菌可能存在诱导耐药的作用。另外在LOGAN等[8]和CHIOTOS等[10]的研究中,留置装置和机械通气也是儿童CRE定植或感染的危险因素,这与本研究结果类似。
目前,临床治疗CRE感染的抗菌药物有替加环素、多黏菌素、氨基糖苷类、磷霉素或者含碳青霉烯类的组合方案等,且普遍认为联合治疗优于单药治疗。本研究中,某些患儿虽分离出CRE,但感染症状不明显,感染相关实验室指标不高,或者后续培养再未分离出CRE,这种情况应考虑CRE定植或者污染,应慎用抗菌药物。
4 结 论
在PICU中,应尽量避免长时间使用呼吸机及其他留置装置,同时应合理使用抗菌药物,尤其是碳青霉烯类与头孢类抗菌药物。
