脐带间充质干细胞对急性卵巢缺血再灌注损伤小鼠卵巢组织内血管内皮生长因子及肿瘤坏死因子-α的影响
2019-09-17邹晓萍叶豪奕回月彤商崇智董化江
邹晓萍,叶豪奕,回月彤,商崇智,董化江,王 磊,徐 健※
(1.中国人民武装警察部队特色医学中心 a.妇产科,b.神经外科,天津 300161; 2.中国人民武装警察部队后勤学院,天津 300189;3.中国医学科学院 北京协和医学院生物医学工程研究所,天津 300192)
卵巢扭转为女性临床的常见病症,如处理不及时可出现卵巢梗死或卵巢破裂,临床可见于剧烈运动后、血管外肿瘤的压迫,肠扭转、肠套叠、嵌顿疝时肠系膜静脉和动脉受压等情况。恢复血流灌注是有效的治疗方法[1-2]。但扭转的卵巢恢复正常解剖位置后,重获血供的卵巢组织损伤程度比单纯缺血状态更为严重[3-5]。对于卵巢恢复血供后的再灌注损伤颇为棘手,尚无特效措施。通常给予患者对症支持及抗炎治疗,但往往给患者留下一定的后遗症,甚至导致不孕,因此需引起高度重视。近年来,干细胞在临床中的应用取得了长足进步,在很多疑难杂症的治疗上显示出相当优势,治疗效果明显[6-8]。不同学者对干细胞的治疗机制持有不同的态度,目前干细胞发挥治疗效用的主要作用机制有细胞替代和干细胞的分泌或代谢“副产品”的“伪旁观者效应”[9]。本研究选用细胞更为原始,且采用比骨髓间充质干细胞和脂肪干细胞分化能力更强的脐带来源的间充质干细胞(umbilical cord-matrix stem cells,UC-MSCs)作为治疗的“种子细胞”。本研究利用UC-MSCs作为“种子细胞”应用于卵巢扭转模型干预卵巢组织的再灌注损伤,以探讨UC-MSCs对为卵巢缺血再灌注的治疗作用。
1 材料与方法
1.1“种子细胞”的采集及质量控制 本研究使用的脐带来源于武装警察部队后勤学院特色医学中心收入的孕产妇。脐带的获取经产妇本人及家属同意并告知应用于相关的科学研究,孕妇本人及家属同意并了解后续用途后签订知情同意书。采集脐带干细胞后用无血清间充质干细胞培养液培养,CD73与CD105双阳性细胞数为95.5%、CD90阳性细胞数为96.2%,CD34阳性细胞数<3%,见图1;细胞活力≥95%,病原菌排查未检出细菌,培养至第3~4代时使用。

图1 脐带间充质干细胞的鉴定
1.2实验动物 30只雌性无特定病原菌级C57BL/6NCrl小鼠购自华阜康生物科技股份有限公司(北京),品系编码:213,体重18~23 g。分笼喂养,每日日光灯照射时间控制为12 h,室温控制在18.5~21.5 ℃,饲养环境湿度控制在38.8%~43.5%,整个实验过程动物自由饮食,保证充足饮水。
1.3主要仪器及药品 UC-MSCs培养基(美国Lonza公司生产,批号:YS000235),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体(美国Gibico公司生产,批号:K25772),血管内皮生长因子(vascular endothelial growth factor,VEGF)多克隆抗体(美国Gibico公司生产,批号:SP0810);thermo实验室用离心机(美国Thermo Electron公司生产,批号:75002493),细胞培养箱(德国BINDER公司,型号:BD400),4%多聚甲醛(上海樊克生物科技有限公司生产,批号:P0099),逆转录试剂盒(南京诺唯赞生物科技有限公司,批号:Q223-01),磷酸盐缓冲液(北京生东科技有限公司生产,批号:BP0002)。
1.4主要的实验方法 采用随机数字法将30只C57BL/6NCrl 小鼠分为3组:假手术组、卵巢缺血+再灌注损伤组(模型组)和卵巢缺血+再灌注损伤+UC-MSCs组(干细胞组),每组10只。假手术组:在卵巢动脉仅穿线,不阻断血液灌流,缝合肌肉、皮肤;模型组:在假手术操作的前提下结扎卵巢动脉,阻断卵巢血液供应30 min,后剪断结扎线恢复卵巢血液供应;干细胞组:结扎卵巢动脉30 min后恢复血流灌注,并于恢复血流灌注后24 h通过向尾静脉注射1.0×106UC-MSCs;模型组给予与干细胞组UC-MSCs同体积的0.9% NaCl注射液。采用实时定量聚合酶链反应、Western blot、酶联免疫吸附测定法等技术检测各组缺血卵巢组织内VEGF和TNF-α 在分子水平及蛋白水平的表达差异。术后3 d 处死动物,取手术侧C57BL/6NCrl小鼠卵巢。
1.4.1血清TNF-α的测定及卵巢组织TNF-α及VEGF mRNA检测 术后10 d眼球静脉取血,以离心半径20 cm,3 000 r/min,离心5 min,去上清,然后按照TNF-α酶联免疫吸附试剂盒相应说明书逐步操作。应用TRIZOL(Total RNA Isolation)试剂提取创伤区卵巢组织总RNA,根据试剂盒说明反转录合成逆转录NDA。反应条件:94 ℃预变性3 min,变性30 s,60 ℃ 退火30 s,72 ℃ 延伸30 s,共 29个循环,72 ℃ 再延伸10 min。聚合酶链反应产物进行琼脂糖凝胶电泳,采用快速凝胶成像系统拍摄电泳图谱条带,利用图像分析软件分析条带灰度值。TNF-α引物序列如下:TNF-Rat-F:CCCAATCTGTGTCCTTCTAACT;TNF-Rat-R:CAGCGTCTCGTGTGTTTCT(105 bp);ACTB-Rat-F:GTGTGGATTGGTGGCTCTATC;ACTB-Rat-R:CAGTCCGCCTAGAAGCATTT(122 bp)。
1.4.2手术侧卵巢组织TNF-α及VEGF变化情况 取三组小鼠手术侧卵巢组织,用磷酸盐缓冲液反复冲洗,去除表面的血液成分和覆膜。加入2 mL体积比为99∶1的细胞裂解液与蛋白磷酸酶混合物,迅速使用液氮进行研磨,然后4 ℃离心,以离心半径20 cm,15 000 r/min,离心20 min,倒弃离心后的上清剩余物质为卵巢组织总蛋白。三组总蛋白各取总蛋白样本25 μg,电泳、转模,蛋白封闭6~8 h。与相应的TNF-α及VEGF抗体孵育,与第二抗体 26 ℃孵育2 h。
1.4.3流式细胞术检测 各组实验动物到达预先设计的时间点后,采用安乐死的方法处死各组实验动物。取各组损伤侧卵巢组织,300目筛网研磨,制成单细胞悬液,然后取异硫氰酸荧光素、别藻青蛋白、多甲藻叶绿素蛋白抗体进行CD90、CD73、CD105染色,按照相关说明书进行操作,取流式抗体0.5 μL,磷酸盐缓冲液+2%血清3.5 μL染色30 s,上机检测。
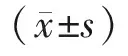
2 结 果
2.1三组实验大鼠卵巢组织中TNF-α mRNA和VEGF mRNA及其蛋白表达情况 与假手术组比较,模型组、干细胞组小鼠卵巢组织的TNF-α mRNA、TNF-α蛋白、VEGF mRNA及VEGF蛋白表达均升高(P<0.05);与模型组比较,干细胞组TNF-α mRNA、TNF-α蛋白表达水平均下降(P<0.05);VEGF mRNA及VEGF蛋白表达水平均上调(P<0.05),见表1,图2~3。

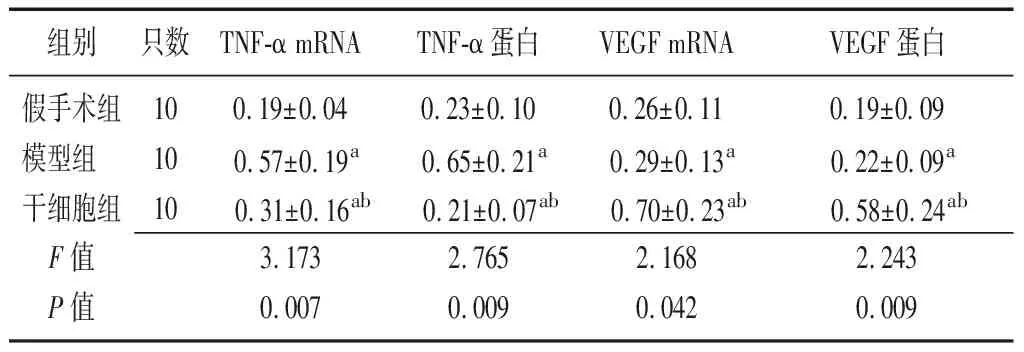
组别只数TNF-α mRNATNF-α蛋白VEGF mRNAVEGF蛋白假手术组100.19±0.040.23±0.100.26±0.110.19±0.09模型组 100.57±0.19a0.65±0.21a0.29±0.13a0.22±0.09a干细胞组100.31±0.16ab0.21±0.07ab0.70±0.23ab0.58±0.24abF值3.1732.7652.1682.243P值0.0070.0090.0420.009
TNF-α:肿瘤坏死因子-α;VEGF:血管内皮生长因子;a与假手术组比较,P<0.05;b与模型组比较,P<0.05

TNF-α:肿瘤坏死因子-α;GAPDH:磷酸甘油醛脱氢酶
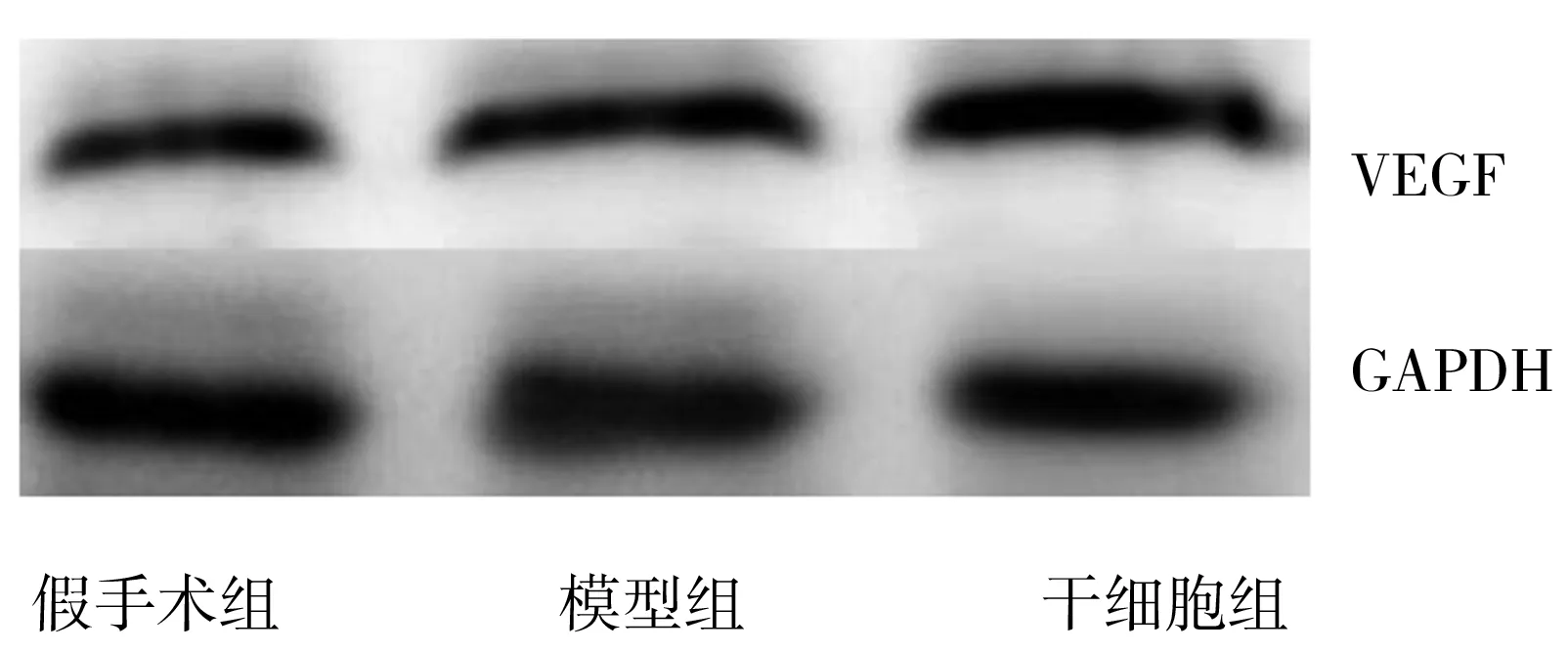
VEGF:血管内皮生长因子;GAPDH:磷酸甘油醛脱氢酶
2.2各组血清中TNF-α蛋白水平比较 假手术组、模型组、干细胞组TNF-α蛋白水平分别为(0.435±0.012) pg、(5.232±1.320) pg、(1.439±0.508) pg,三组TNF-α蛋白水平比较差异有统计学意义(F=95.886,P<0.001)。模型组、干细胞组TNF-α蛋白水平较假手术组升高(P<0.01);干细胞组TNF-α水平较模型组降低(P<0.01)。
2.3各组卵巢组织内UC-MSCs数量的比较 假手术组、模型组、干细胞组UC-MSCs的数量分别为(0.091±0.034)%、(0.134±0.081)%、(3.176±0.936)%。三组大鼠UC-MSCs的数量比较差异有统计学意义(F=105.310,P<0.001)。模型组大鼠UC-MSCs的数量与假手术组比较,差异无统计学意义(P>0.05);干细胞组UC-MSCs的数量高于假手术组和模型组(P<0.05)。
3 讨 论
卵巢扭转为女性临床的常见病症,但若处理不及时或不恰当,轻则可出现输卵管粘连、堵塞,重则可出现卵巢梗死、破裂等。卵巢扭转临床可见于剧烈运动后、外肿瘤的压迫,肠扭转、肠套叠、嵌顿疝时肠系膜静脉和动脉受压等情况[1-3]。重建血流灌注是卵巢扭转的有效治疗方法,而扭转的卵巢恢复正常的解剖位置后,虽然血液供应得到恢复,但恢复血流灌注后会出现较前期单纯缺血更为严重的损伤,因此对卵巢扭转的缺血再灌注损伤的科学处理对患者的预后转归具有重要的临床意义[3-5]。
MSCs是一类具有干细胞特征的细胞群体,有体内外扩增培养和多向分化的潜能,在再生医学领域及多种疑难杂症的治疗方面具有广阔的前景[6-9]。各种组织来源的间充质干细胞及其分泌的细胞因子和外泌体主要通过改善卵巢组织微环境、免疫调节、促进卵泡发育或分化为颗粒细胞,恢复卵巢早衰患者的卵巢功能及生育能力[10]。另有研究证实,UC-MSCs 及骨髓来源的MSCs培养上清所提取的细胞外泌体可通过调节血清中各激素水平而促进卵泡发育,有效降低顺铂对卵巢的损伤和破坏,明显修复卵巢的功能[11]。可见,MSCs可有效修复受损卵巢组织。基于此,本课题选用无伦理学争议、细胞增殖和分化能力强、扩增速度快的UC-MSCs作为种子细胞[6,8,12],探讨对卵巢扭转小鼠的治疗效果。
有文献报道,UC-MSCs免疫调节特性强,在自身免疫疾病治疗和炎症的调节方面有独特的优势,在临床上治疗自身免疫性疾病、移植物抗宿主疾病、炎症反应的调节等方面效果显著[8-9,13]。同时MSCs本身又可分泌多种具有生物活性物质、外泌体、酶类等,而这些物质本身具有良好的治疗效果[9,13]。可见,UC-MSCs的治疗作用可能既包括损伤细胞的替代作用,又包括细干细胞代谢产物的“旁观者效应”。MSCs所分泌的生物活性物质可在促进血管再生及血管生成、免疫调节方面发挥强大的作用[14-15]。MSCs外泌体在调节靶细胞功能中发挥重要作用,外泌体囊泡内含MSCs源mRNA、微RNA、酶等成分,这些物质均参与受损组织的修复[16]。UC-MSC修复损伤的作用机制主要包括损伤细胞的替代作用、MSCs的分泌作用、促进血管再生与重建等[17-19]。本研究选用C57BL/6NCrl小鼠模型,成功复制卵巢缺血再灌注模型,给予UC-MSCs进行干预,发现VEGF明显增加,对恢复受损卵巢组织功能、维持血供具有重要意义;同时,在缺血再灌注损伤发生的病理生理过程中,炎症反应级联放大进一步加重受损卵巢组织的“热反应”,需要在机体的免疫调节方面给予相应的干预,以维持内环境的稳定[5,20]。本实验结果显示,UC-MSCs治疗可降低TNF-α表达。
综上所述,UC-MSCs既可下调TNF-α的表达,又可有效加速治疗性血管再生,有效促进受损卵巢组织的功能恢复。
