补充益生菌改善运动应激及其机制研究进展
2019-09-17夏亚丽伊木清
夏亚丽 伊木清
1 上海体育学院(上海200438)
2 国家体育总局运动医学研究所(国家体育总局运动营养重点实验室,国家运动营养测试研究中心)
人体的肠道菌群(gut microbiota,GM)是由数以万亿计细菌共同构成的复杂群落,通过脑-肠轴和肌-肠轴调节宿主多种生理过程,影响机体的物质能量代谢、免疫及下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA axis)等功能[1]。肠道菌群失调将影响上述功能而导致消化吸收与代谢障碍、炎症、自主免疫性疾病以及神经内分泌功能受损等(图1)[1]。因此,人体胃肠道微生物的组成已成为评价机体健康的一个重要标志。
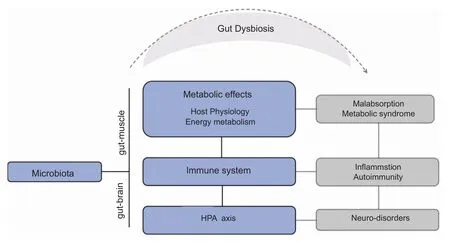
图1 肠道菌群的作用与作用机制(选自文献[2])
联合国粮食及农业组织(FAO)和世界卫生组织(WHO)将益生菌(probiotics)定义为“在适当剂量下给宿主带来健康益处的活微生物”[3]。益生菌作为一种天然、安全、方便的营养补充剂,通过调节肠道菌群稳态,对宿主产生健康有益效应。研究表明:益生菌具有改善乳糖不耐受、预防肠道感染、调节免疫机能、降低血清胆固醇、抗肿瘤和调节骨量等作用[4-9]。运动机体补充益生菌可缓解因大强度运动引发的氧化应激、炎症反应以及物质能量代谢失衡等应激反应,这可能是改善运动员整体健康水平和运动能力的一种重要“治疗”方法[10]。
本文以 endurance exercise、physical activity、gut microbiota、probiotics、metabolism、intestinal barrier、inflammation、immunity、oxidative stress、gut-muscle axis、gut-brain axis、exercise performance、mechanism 等关键词相互组合,于MEDLINE、EMBASE和SCI等数据库中进行了文献的检索及引用文献的追踪,并就补充益生菌对运动机体物质能量代谢、肠道屏障、免疫机能、氧化应激、神经内分泌系统功能和健康状态的影响及其作用机制进行了综述。
1 益生菌对运动机体物质能量代谢的影响
肠道微生物群被认为是维持人体宿主健康状态的基石,其不仅决定了从食物中获得营养和能量的有效性,而且产生大量代谢产物,调节宿主的新陈代谢。
肠道菌群作用于骨骼肌代谢,是论证肌-肠轴存在的形式之一。分析运动员和久坐人群的肠道微生物群代谢表型及功能元基因组,发现在运动员中与增强肌肉功能有关的碳水化合物、氨基酸代谢以及粪便代谢物短链脂肪酸(short chain fatty acid,SCFAs)都相对增加[11]。Zhao等[12]基于非靶向代谢组学和16S rDNA测序分析方法,对半程马拉松运动员的粪便代谢产物与微生物结构进行综合分析,结果显示,长距离耐力跑可引起肠道环境中某些微生物群(如科氏杆菌科)的丰度及40 种粪便代谢物产生显著变化,其中有机酸(主要增加代谢物)和核酸成分(主要减少代谢物)的代谢物差异最大。可见肠道微生物可以通过调节某些细菌类群对耐力运动引起的粪便代谢产物的改变做出快速反应。
益生菌直接调节肠道微生物群的组成,改善宿主的蛋白质、脂类以及碳水化合物代谢,促进维生素的产生,有助于宿主的营养吸收和能量获得,进而调节肝脏、肾脏、肌肉等器官的代谢[13]。Chen 等[14,15]的研究就显示,与对照组相比,补充植物乳杆菌TWK10 可降低大鼠运动后血乳酸和血糖浓度,提高葡萄糖利用率,改善能量供给,增加腓肠肌Ⅰ型肌纤维的数量和瘦体重,同时,降低血氨和肌酸激酶(creatine kinase,CK)水平,抵抗疲劳,从而改善运动机能。该作者认为,肠道微生物群在平衡能量和改善体成分方面参与了宿主代谢表型的形成,从而影响了机体活动,但没有解释这一结果发生的细胞与分子机制。
1.1 糖代谢和脂代谢
剧烈运动过程中,机体加快葡萄糖和脂肪酸氧化,而通过肠道菌群调节其肌肉产能物质的可用性是一种有效机制。
Nay 等[16]用广谱抗生素干预小鼠21 天以减少肠道微生物群,发现其跑步耐力下降,体外收缩实验中,指长伸肌疲劳指数增加;经过10天的肠道菌群自然恢复后,一些糖代谢标志物,例如回肠组织中的G蛋白偶联受体41(G protein coupled receptor 41,GPR41)和钠-葡萄糖协同转运蛋白1(sodium-glucose cotransporter 1,SGLT-1)基因的表达与肌糖原水平产生变化,有效地恢复了肌耐力,可见调控微生物群落能改变肌肉代谢功能,影响肌肉生物能量的产生。Houghton 的团队[17]使用可表达典型肌肉表型标志物的分化的人骨骼肌成肌细胞LHCN-M2作为模型,发现血液中的微生物群代谢物异香草酸3-O-硫酸盐(isovanillic acid 3-Osulfate,IVAS)通过葡萄糖转运因子4(glucose transporter 4,GLUT 4)和磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)依赖机制刺激葡萄糖转运的剂量依赖性增加,此外IVAS 还上调了GLUT1、GLUT4 和PI3K p85 蛋白,增加了苏氨酸激酶(protein kinase B,Akt)的磷酸化,可见微生物来源的酚类代谢物可提高人体肌细胞吸收和代谢葡萄糖的能力,为肠道微生物群与骨骼肌能量来源、利用提供了一种新的联系。微生物群通过肝肠循环和肠道代谢影响胆汁酸(bile acids,BAs)代谢,在肠道中,BAs 刺激成纤维细胞生长因子15 (fibroblast growth factors,FGF15)的分泌,活化下丘脑AgRP/NPY(agouti generelated protein/nerve peptide Y)神经元中FGF受体,抑制AgRP/NPY 神经元,以改善葡萄糖耐受性,控制葡萄糖稳态[18]。
Bäckhed等[19]的研究证实,无菌(germ-free,GF)鼠通过两种互补但独立的机制来维持持久的瘦表型,这两种机制均导致脂肪酸代谢的增加。一方面与骨骼肌和肝脏磷酸化的腺苷酸激活蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)及肉毒碱棕榈酰转移酶1(carnitine palmityl transferase-1,CPT-1)水平升高有关;另一方面,与禁食诱导脂肪因子(fasting induced adipose factor,Fiaf)含量升高,诱导了过氧化物酶体增殖活化受体γ辅激活因子1α(peroxidosome proliferation-activated receptor gamma coactivator 1,PGC-1α)和脂肪酸氧化相关酶的基因表达有关。BAs作为代谢功能的整合者,激活法尼醇X受体(farnesoid X receptor,FXR),调节类固醇反应元件结合蛋白-1c(steroid response element binding protein -1c,SREBP-1c)、碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)和可促进脂肪酸摄取和氧化的过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor-α,PPAR-α)[20]。Watanabe 等[21]用BAs 处理棕色脂肪细胞和骨骼肌细胞,发现通过增加由BAs 与TGR5(takeda G-protein receptor 5 )结合而产生的cAMP(cyclic adenosine monophosphate)的产量,提高了细胞D2(type 2 iodothyronine deiodinase)活性和耗氧量,可见BA-TGR5-cAMP-D2 信号通路是调节能量稳态的关键机制,可用于改善代谢控制。
肠道微生物群为骨骼肌线粒体提供必要的代谢产物,可调节参与线粒体生物发生的关键转录辅助激活因子、转录因子和酶,如NAD 依赖性蛋白脱乙酰基酶sirtuin-1(SIRT1),PGC-1α,AMPK 基因[22]。其中,微生物降解肠道碳水化合物的最终产物SCFAs 构成了食物、肠道微生物和宿主物质能量代谢之间的联系。一系列研究已证实SCFAs 参与宿主能量代谢,上调线粒体生物合成的调节剂SIRT1[23],以提高肌细胞能源生产效率;增加棕色脂肪组织中PGC-1α和解偶联蛋白1(uncoupling proteins 1,UCP-1)的蛋白表达,加速产热和脂肪酸氧化[24];通过直接增加AMP/ATP 比值或间接由游离脂肪酸受体2(free fatty acid receptor 2,FFAR2)-瘦素途径激活AMPK[25];激活调节UCP2-AMPK-ACC(uncoupling protein 2-adenosine monophosphate activated protein kinase-acetyl-CoA carboxylase)和PGC-1α通路,以增加ATP的产生,提高肌纤维的代谢效率[26]。
1.2 蛋白质和氨基酸代谢
肠道微生物群可提高氨基酸生物利用度,优化蛋白质的分解、吸收和代谢。使用基因表达数据和组织特异性基因组级代谢模型(genome-scale metabolic models,GEMs),比较GF 小鼠和常规小鼠代谢差异,研究人员发现后者胃肠道中游离氨基酸的分布发生改变[27]。Li等[28]采用比较基因组分析法,发现植物乳杆菌ZJ316 有34 个基因编码胞内肽酶,23 个基因编码不同特异性的蛋白酶,并编码除缬氨酸、亮氨酸和异亮氨酸以外的大多数氨基酸的完整生物合成途径,可见益生菌影响了蛋白质水解酶系统与氨基酸生物合成。
在一项涉及优秀橄榄球运动员的人体研究中发现,肠道微生物多样性指数与蛋白质摄入量和CK浓度呈正相关[29]。志愿者在进行抗阻训练的同时联合补充益生菌BC30 和慢吸收的酪蛋白,结果显示益生菌BC30提高蛋白质的吸收率,有增加受试者垂直跳跃能力的趋势(P=0.10),对体成分、运动能力和健康的自我感知均显示有益作用[30]。铁人三项运动员在进行常规训练的同时补充植物乳杆菌PS128,结果发现其血浆中支链氨基酸(branched chain amino acid,BCAAs)含量显著升高,可见益生菌有效地改善了运动时肌肉能量代谢的动态平衡,提高肌肉适应能力,维持运动能力[31]。给男性足球运动员补充干酪乳杆菌,于力竭运动后4小时和1个月后分别采集尿样,测定尿中苯乙酰谷氨酰胺和氨的含量,结果显示:以肌酐水平校正后,补充益生菌组苯乙酰谷氨酰胺含量明显增加,氨含量低于对照组,表明补充益生菌可能对控制运动产生的氨有帮助[32]。
此外,益生菌作为功能性微生物通过其酶组合物和代谢产物的释放来改善食物的营养成分,以增加游离氨基酸[33]、生物活性肽[34]、γ-氨基丁酸[35]和其他营养物质及代谢物的浓度,在宿主能量代谢中发挥作用。
1.3 维生素代谢
维生素B作为能量产生必需的辅助因子直接参与细胞的三羧酸循环,促进ATP 生成。Magnúsdóttir 等[36]利用PubSEED 平台分析256 株人肠道细菌的基因组,预测40%~65%人的肠道菌群具有8 种B 族维生素的生物合成途径。对从健康母乳中分离出的发酵乳杆菌CECT5716进行全基因组测序,发现该菌株含有核黄素和叶酸生物合成的基因簇[37]。有研究表明:转录调节因子PdxR 可激活维生素B6 的活性形式吡哆醛5’-磷酸(pyridoxal 5’-phosphate,PLP)的合成酶基因的表达,参与调节克罗氏芽孢杆菌中维生素B6的合成[38]。
综上,在大强度运动中,机体新陈代谢加速,糖原储存减少,供能不足,导致肌肉疲劳,限制运动能力,而益生菌可改善肠道菌群的组成,提高SCFAs、氨基酸、BAs、维生素等代谢产物水平,以促进宿主能量获取和储存,提高供能效率,改善肌肉健康,缓解机体疲劳,提高耐力运动能力。
2 益生菌对运动机体肠道屏障和免疫机能的影响
2.1 大强度运动对肠道屏障和免疫机能的影响
肠道微生物群和黏膜完整性受饮食、环境和体力活动等因素的影响。大强度运动时机体将血液从内脏循环重新分配到呼吸组织和肌肉组织,导致胃肠道局部血流量减少,渗透压改变,肠系膜血、氧、营养素供应不足,代谢物清除不足,而持续的肠道低灌注/缺血引起pH 降低,进而导致氧化应激,破坏肠上皮细胞紧密连接蛋白,引起肠细胞损伤,粘膜破裂,肠屏障区代谢紊乱[39];胃肠动力增加,改变神经内分泌调节,极易引起呕吐、腹痛、腹泻[40]。
此外,上皮屏障功能失调引发“肠漏症”,细菌易位,病原体/毒素被吸收到组织和血液中,导致代谢性内毒素血症,这些分子可刺激巨噬细胞膨胀,激活炎症细胞因子合成,提高机体对传染病和自身免疫性疾病的易感性,从而促进局部和全身免疫激活[41-42],如在耐力运动期间或之后会发生短暂免疫抑制,增加运动员上呼吸道和胃肠道疾病的发病率。
肌-肠轴理论还认为,细菌膜脂多糖(lipopolysaccharide,LPS)对肌肉Toll 样受体(toll-like receptors,TLRs)的激活是肌肉与微生物交互作用(cross-talk)的另一途径。Frost 等[43]用LPS 刺激C2C12 成肌细胞和小鼠骨骼肌,检测肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白介素-6(interleukin-6,IL-6)的调控,证实LPS 能刺激骨骼肌中的细胞因子表达,导致骨骼肌的代谢和收缩特性受损。
2.2 益生菌改善运动机体肠道屏障功能
马拉松运动员在比赛前28 天补充益生菌可降低其赛后胃肠道症状的发生率和严重程度,但其确切机制尚未阐明[44]。23名训练有素的男性服用14周的混合益生菌,可降低大强度运动后粪便中表明肠道通透性增强的连蛋白(zonulin)含量[45]。对铁人三项运动员进行为期12周多株益生菌联合补充剂干预,在耐力训练期间,可以通过维持肠道通透性,以降低机体内毒素水平,减少胃肠道症状[46]。在一项双盲交叉试验中,10名运动员服用益生菌胶囊,与补充安慰剂相比,其运动前后血清LPS 浓度均有中度至大幅度降低,胃肠道不适症状轻微减轻,高温运动时的跑步能力提高,但其作用机制尚不清楚[47]。
现有的研究表明:益生菌具有直接的抗菌活性和调节作用,能有效地抑制病原菌的侵袭、定植和易位[48];促进肠粘膜糖蛋白的合成,增强粘膜层的保护作用[49];产生广谱抑菌素、SCAFs等代谢物,降低pH值,或产生对致病微生物具有毒性作用的有机酸、细菌素和生物表面活性剂等物质[50];增加营养物质的吸收,优化绒毛吸收区功能,产生良性循环[51]。
研究证实:鼠李糖乳杆菌(lactobacillus rhamnosus,LGG)通过抑制核因子κB(NF-κB)信号通路,减轻促炎细胞因子对上皮屏障完整性和炎症的影响[52];在小鼠或人结肠细胞模型中,LGG 可激活抗凋亡Akt,并通过TNF-α、IL-1 或干扰素(IFN)抑制促凋亡的p38 MAPK(mitogen activated protein kinase)的激活,阻止细胞因子诱导的凋亡[53]。因此,益生菌可提高正常情况下促凋亡细胞因子环境中肠细胞的存活率,以缓解因高强度运动引发的胃肠道屏障损伤。
2.3 益生菌改善运动机体免疫机能
采用双盲、随机、安慰剂对照的交叉研究方式,对已补充短双歧杆菌BR3 和嗜热链球菌FP4 21 天的抗阻训练运动员进行一次性大强度离心运动以造成骨骼肌纤维受损,于运动前至运动后72 h 测定上臂围、肘关节活动度、主观肌肉酸痛度、屈肘等速肌力、血浆IL-6及CK浓度以评估益生菌对损伤后的运动能力及急性炎症反应的影响,结果显示补充益生菌可降低安静状态下至运动后48小时的IL-6浓度,减轻运动损伤后的肌肉功能下降症状,其潜在机制有待阐明[54]。
早期研究发现,与健康运动员相比,疲劳运动员血CD4阳性T细胞分泌IFN-γ明显减少,经4周益生菌治疗可逆转其T细胞缺陷,使IFN-γ分泌量增加到与正常人相似的水平[55]。Strasser及其团队[56]给13名训练有素的运动员补充混合益生菌制剂,服用安慰剂的运动员出现一种或多种上呼吸道感染(upper respiratory tract infection,URTI)症状的比例比益生菌组增加了2.2倍,具有显著性差异,表明补充益生菌可缓解URTI症状,预防感染,增强机体免疫功能;在随机双盲安慰剂对照试验中,虽然益生菌组和安慰剂组URTI的发生率均较低、且组间差异无统计学意义,但发现定期摄入益生菌减少EB 病毒(EBV)和巨细胞病毒(CMV)抗体的数量,显示其具有免疫调节作用[57]。
益生菌可能的作用机制包括与肠道微生物群、粘膜免疫系统相互作用以及向各种器官和系统发出免疫信号;通过修饰非特异性和体液免疫能力来增强宿主的免疫功能,如增强非特异性细胞免疫反应,活化巨噬细胞、自然杀伤细胞、抗原特异性细胞毒性T 淋巴细胞,并以特异性和剂量依赖性的应答方式释放各种细胞因子,改善肠粘膜免疫系统[58]。
综上,益生菌与肠道微生物之间相互作用,促进肠黏膜完整性,预防内毒素易位,缩短运动员胃肠道症状持续时间;与粘膜免疫系统相互作用,向各器官和系统发出免疫信号,调节宿主的免疫和炎症反应,提高机体免疫功能,降低URTI 症状的发病率、严重程度和/或持续时间,一定程度上缓解大强度运动给机体带来的应激反应,有助于改善运动机能。
3 益生菌对运动机体氧化应激的影响
大强度运动中,因体能下降、肌肉疲劳、损伤、热应激和缺血再灌注等现象,引起自由基和活性氧(ROS)的增加。因ROS 超过机体内源性抗氧化防御机制,使氧化和抗氧化水平失衡,从而导致的氧化应激,可促进蛋白质、脂质和DNA 的氧化反应,导致蛋白质变性、脂质过氧化、DNA 羟化、线粒体功能障碍和细胞凋亡,损害细胞活力[59]。
肠道菌群稳态是影响抗氧化内源性防御系统及机体运动能力的重要环境因子。Xu等[60]观察到氧化状态与肠道乳酸菌和双歧杆菌属呈负相关,与大肠杆菌呈正相关。Hsu等[61]研究了无特定病原(SPF)、无菌(GF)和脆弱拟杆菌(BF)小鼠肠道细菌与运动能力的关系,发现与GF小鼠相比,SPF和BF小鼠的耐力游泳时间更长,SPF小鼠血清谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和过氧化氢酶(catalase,CAT)水平均高于GF 小鼠,BF 小鼠血清GPx 水平高于GF 小鼠。可见肠道微生物区系的缺乏降低了抗氧化酶的活性和整体运动能力,而益生菌可调节肠道菌群稳态,减轻机体氧化应激的反应,改善运动能力。人体研究表明,运动员在剧烈运动4周期间服用的副乳杆菌和LGG可发挥较强的抗氧化活性,使血浆抗氧化水平升高,他们认为益生菌产生抗氧化作用的机制与微生物合成维生素B1、B5和B6等抗氧化物质有关[62]。
相关研究表明,益生菌的抗氧化应激机制包括以下几个方面:益生菌具有螯合金属离子的能力,干酪乳杆菌KCTC3260通过螯合Fe2+或Cu2+而具有较高的抗氧化能力[63];自身具备抗氧化酶系统,发酵乳杆菌E-3 和E-18 可表达Mn-SOD[64]、干酪乳杆菌BL23 能生产CAT[65]、发酵乳杆菌ME-3 具有完整的谷胱甘肽合成系统[66];产生具有抗氧化活性的多种代谢产物,瑞士乳杆菌CD6 可产生影响DNA 复制、修复和甲基化效率的叶酸[67];介导抗氧化信号通路,植物乳杆菌FC225 通过介导核因子NF-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)信号通路的抗氧化酶表达以达到抗氧化保护作用[68]。
因此,肠道微生物状况对运动机体抗氧化酶系统的潜在作用至关重要,补充益生菌有利于减轻氧化应激,改善运动能力。
4 益生菌对运动机体神经内分泌系统的影响
剧烈运动引发机体生理和心理应激反应,激活交感神经-肾上腺髓质和HPA 轴,改变肠道微生物群组成,导致应激激素、炎症细胞因子和微生物分子释放入循环系统,引发全身炎症和免疫反应[69]。过度训练和竞技比赛还可引起昼夜节奏扰乱、神经内分泌轴失衡、心理状态(情绪、行为和认知)变化,严重者甚至出现焦虑、抑郁等情绪障碍,影响睡眠质量,导致训练动机降低。
肠道微生物群被认为与神经内分泌免疫通路有关,产生了脑-肠轴的概念。Allen 等[70]的一项研究表明,微生物群可调节运动引起的应激反应,认为运动中的生理和情绪压力与肠道微生物组成的变化之间存在高度的相关性。Clark等[69]也认为肠道微生物群具有内分泌器官的功能(如分泌血清素、多巴胺或其他神经递质),在许多方面促进各种神经递质和激素的产生和调节,会影响运动员的情绪、动机和疲劳感。
对长期服用婴儿双歧杆菌的大鼠进行强迫游泳实验,与对照组相比,服用益生菌的大鼠血浆中色氨酸和犬尿酸浓度明显升高,额叶皮层中的5 羟基吲哚乙酸(5-hydroxyindoleacetic acid ,5-HIAA)和杏仁核皮质中的二羟苯乙酸(dihydroxy- phenyl acetic acid,DOPAC)含量降低,证明益生菌对运动应激具有潜在的抗抑郁作用[71]。在人体研究中发现,补充益生菌可降低对悲伤情绪的整体认知反应能力、焦虑样行为和应激水平[72,73]。肠道内的益生菌可通过脑-肠轴调节5-羟色胺(5-hydroxytryptamine,5-HT)水平,影响情绪障碍者的睡眠参数,达到缓解慢性疲劳综合征的目的[74]。运动人体中肠道细菌与大脑相互作用及其机制仍需更多研究,以充分证实益生菌具有改善运动员的情绪、疲劳、抑郁和整体健康的作用。
5 小结与展望
运动员在训练和比赛中普遍存在机体疲劳、肠胃不适、肌肉微损伤、免疫力低下、炎症、抗氧化功能受损、神经内分泌失衡等运动应激反应,将补充天然、安全的益生菌产品纳入其运动营养干预中是很有价值的。益生菌可优化胃肠道菌群结构,促进机体新陈代谢、能量供给,提高肌肉质量;缓解肠道屏障功能障碍,改善机体免疫机能,控制炎症反应;抑制机体氧化应激,减轻氧化损伤;缓解心理应激、情绪障碍,提高睡眠质量(图2)。因此,对大强度运动人群适量补充益生菌有利于改善应激反应和运动机能。
目前研究表明:具有上述作用的益生菌主要有植物乳杆菌、鼠李糖乳杆菌、干酪乳杆菌、嗜酸乳杆菌、双岐杆菌、嗜热链球菌等。但由于运动类型、训练强度、益生菌补充的类型和剂量以及测评方式的不同,也有很多研究未能证实益生菌的有益作用。益生菌的补充取决于菌株、微生物组成和代谢物,目前对运动员补充益生菌的菌种选择和剂量并没有明确的建议。未来,随着基因组学、转录组学、蛋白质组学和代谢组学等技术的成熟和广泛运用,应针对性研究特定菌株的定植和对肠道微生物区系的影响,选择合适的菌种以适应运动员的个体差异性;进行益生菌补充剂的剂量反应实验应结合运动、临床和免疫机能测试结果以及饮食和运动的平行变化,确定可改善运动能力和免疫机能的浓度/剂量,以充分发挥益生菌的功效。
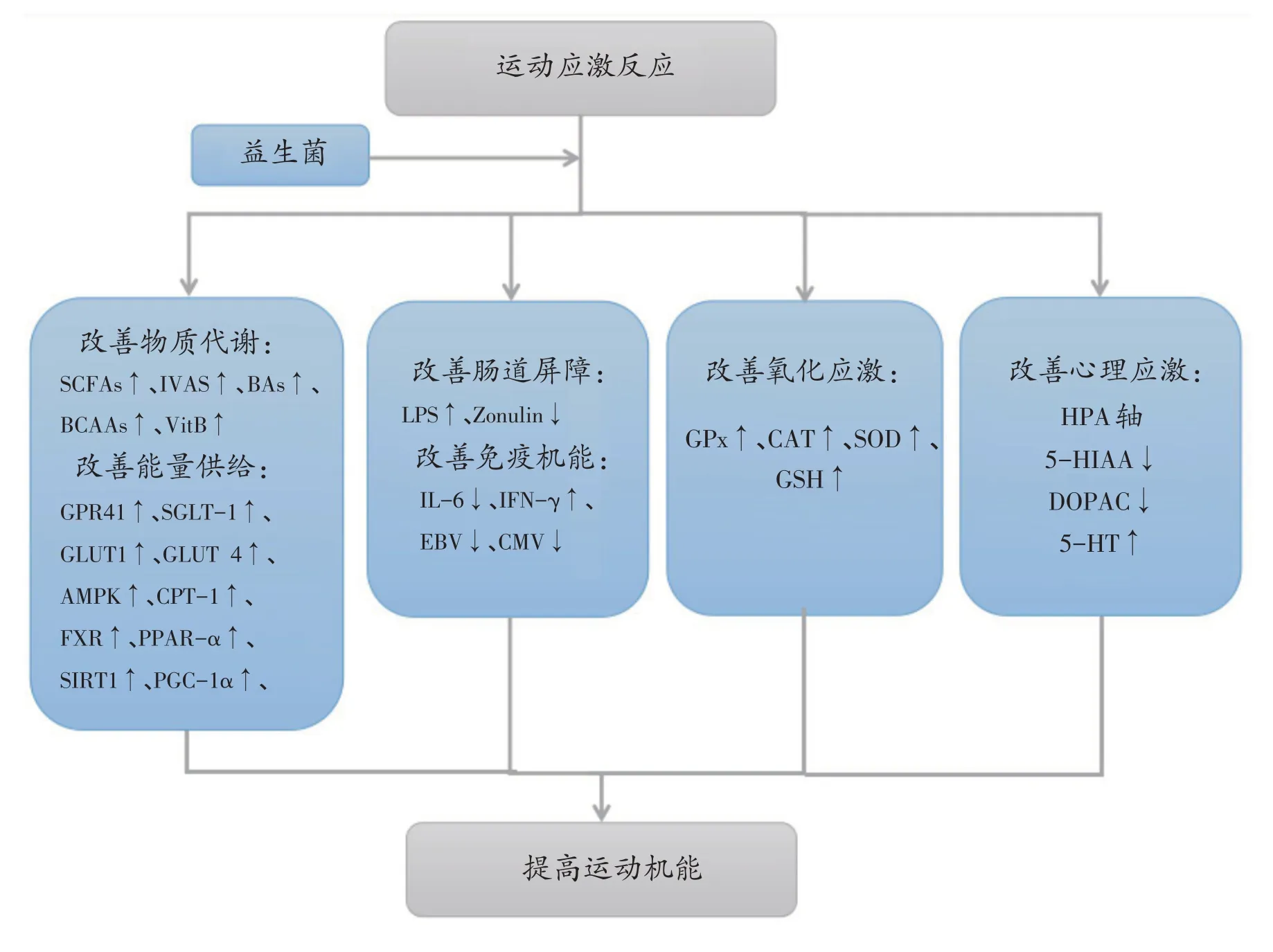
图2 补充益生菌改善运动应激反应的作用与作用机制
