Hsa-miR-139-3p靶基因预测及生物信息学分析*
2019-09-17何楚琦钟浩龙鼎新
何楚琦,钟浩,龙鼎新
(南华大学公共卫生学院,湖南 衡阳 421001)
MicroRNA(miRNA)是一类广泛存在于动植物和某些病毒内的单链非编码小RNA,其长度约20~22 个 核苷酸[1]。成熟miRNA 由原始RNA(pri-miRNA)和前体RNA(pre-miRNA)在核糖核酸酶Ⅲ(Drosha 酶和Dicer 酶)作用下逐步形成,然后通过不完全沃森- 克里克碱基配对原则与特定靶mRNA 结合,在转录后层面调控mRNA 使其降解或翻译中止,从而调节靶基因的蛋白表达水平[2-4]。miRNA 调控至少30%的基因表达,参与人类生命活动中一系列重要的生物学过程[5],不仅在细胞分化增殖、器官发育过程中起着重要作用,还在疾病的发生、发展过程中扮演重要角色,为人类疾病的诊断和治疗提供了重要的生物学标志物[6]。
Hsa-miR-139-3p 属于miR-139 基因家族,聚集于人染色体11q13.4 长度为68 bp 的位置中,具体基因位点在chr1:72615063-72615130 处。已有的研究显示,通过与靶基因NOB1 或MMP11 相互作用,hsamiR-139 在肿瘤的增殖和迁移中起抑制作用[7-8]。目前国内外对miR-139-3p 的研究尚浅,且现有文献多与肿瘤或癌症相关,其余功能仍有待研究。大数据原理下的生物信息学相对实验验证,能对靶基因及相关通路进行大量多样高速的预测。本研究运用生物信息学方法预测hsa-miR-139-3p 的靶基因,并对其靶基因集合进行功能注释(gene ontology,GO)和信号通路富集分析(kyoto encyclopedia of genes and genome pathway,KEGG pathway)(简称Pathway 分析),为后续对miR-139-3p 的靶基因鉴定及生物学功能研究提供理论基础和思路。
1 资料与方法
1.1 资料来源及工具
使用PubMed(http://www.ncbi.nlm.nih.gov/pubmed/)、NCBI(https://www.ncbi.nlm.nih.gov/)、UCSC(http://genome.ucsc.edu/)、miRbase(http://www.mirbase.org/)等在线数据库查找miR-139-3p 的碱基序列序列、染色体定位、物种保守性等基本信息,利用在线靶基因预测软件Taegetscan 7.1(http://www.Targetscan.org/)、miRDB(http://www.mirdb.org/)、miRanda(http://www.Microrna.org/)、miRTar Base(http://www.mirtarbase.mbc.nctu.edu.tw/)进行靶基因预测,应用分析软件MEGA 7.0 和带有BiNGO 插件的Cytoscape 3.6.0 软件,以及DAVID(http://david.abcc.ncifcrf.gov/)进行功能富集分析(GO 分析)和Pathway 分析[9]。
1.2 研究方法
从miRbase 数据库检索各物种已知的miR-139-3p成熟序列,用MEGA 7.0 比对分析各物种间序列的保守性和同源性。通过PubMed 查找hsa-miR-139-3p 靶基因相关文献,并取Taegetscan、miRanda 和miRDB 3 个在线数据库的hsa-miR-139-3p 靶基因预测结果交集,合并miRTarBase 数据库中经实验证实的hsa-miR-139-3p 靶基因形成靶基因集合用于后续分析。
1.3 统计学方法
用Cytoscape 3.6.0 软件中的BINGO 插件实现靶基因集合的Geneontology 功能富集分析,投射到细胞组分(cellular component,CC)、分子功能(molecular function,MF)、生物学过程(biological process,BP)3大应用功能。根据Geneontology 数据库查找的基因的GO 注释,以本物种的所有基因为背景基因,用超几何分布检验;利用DAVID 数据库进行基于KEGG 的信号转导通路富集性分析,用Fisher 确切概率法检验;P<0.05 为差异有统计学意义。
2 结果
2.1 miR-139-3p 的序列保守性分析
利用miRBase 数据库下载人(hsa)、小鼠(mmu)、大鼠(rno)、野猪(ssc)等8 个物种的miR-139-3p 的成熟序列。结果显示,miR-139-3p 成熟序列GGAGACGCGGCCCUGUUGAG 在脊椎动物中具有高度的保守性(见图1)。
2.2 Hsa-miR-139-3p 的靶基因预测结果

图1 不同物种miR-139-3p 的成熟序列
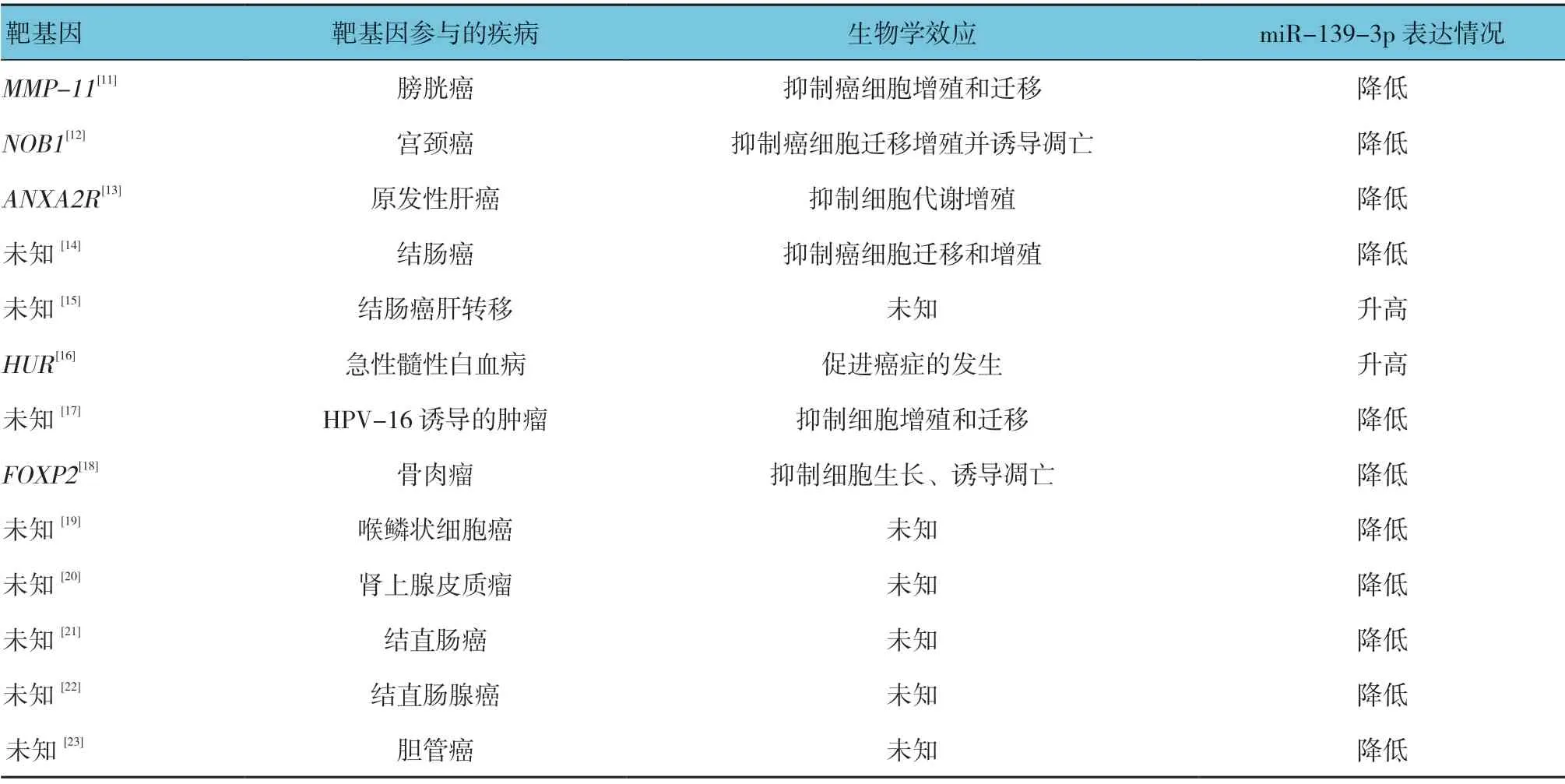
表1 miR-139-3p 调控的靶基因参与人类肿瘤
通过PubMed 检索文献显示,miR-139-3p 通过在转录后水平调控其靶基因参与多种肿瘤的发生、发展及预后(见表1)。Taeget Scan、miRanda 和miRDB 预测的靶基因个数分别为3 122、3 170 和38 个,对上述预测结果取并集后得到30 个靶基因的数据集。另外,查找miR Tar Base 数据库中记录的经双荧光素酶报告基因实验、MTT/Western blotting、qRT-PCR 等方法证实的hsa-miR-139-3p 靶基因共105 个,其中有 2 个靶基因(E2F6 和RAP1B)与上述并集重合,因此预测靶基因数据集与实验已验证靶基因取并集后得到133 个无重复靶基因,作为后续分析的基因总集合(见图2)[10]。
2.3 Hsa-miR-139-3p 预测靶基因的GO 功能注释
将3 个数据库均能预测到的靶基因133 个作GO分析,发现hsa-miR-139-3p 的靶基因主要富集在吞噬小泡膜、细胞外基质黏附、髓鞘、生长锥、核染色体、转铁蛋白受体等14 个细胞组分(P<0.05);参与交感神经系统发育、心脏右心室形态发生、心内膜形成、RNA 聚合酶启动子转录的调控、自噬体装配、去甲肾上腺素能神经元分化等23 个生物学过程(P<0.05);显著富集于转录活性激活、蛋白结合、RNA 结合、DNA 结合、酶结合等12 个分子功能(P<0.05)。见表2。
2.4 Hsa-miR-139-3p 预测靶基因的KEGG 通路分析
利用DAVID 数据库中的工具Functional Annotation对靶基因集合进行生物通路富集分析,其中55 个靶基因具有相关生物通路。以人类全基因组为背景,发现hsa-miR-139-3p 的靶基因显著富集于黏着斑信号转导通路以及转录等基因信息处理通路中(见表3)。
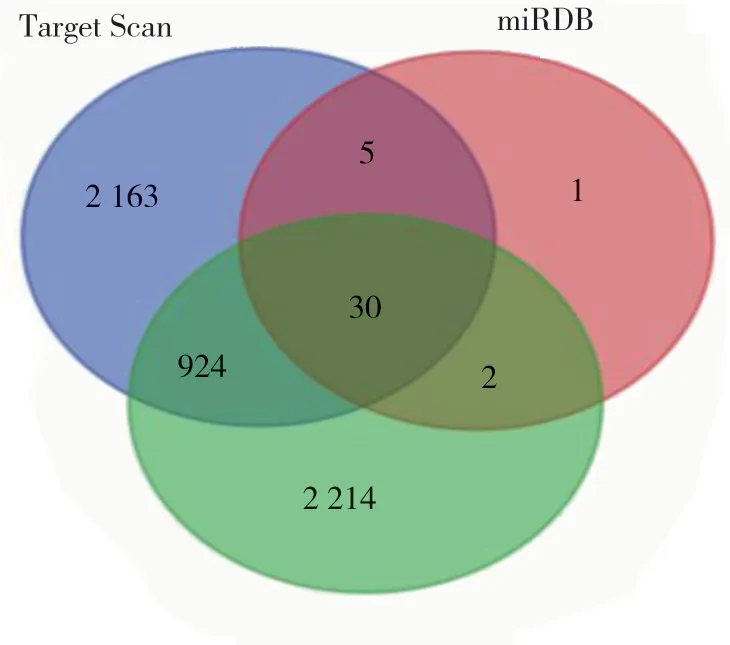
图2 Hsa-miR-139-3p 的预测靶基因个数

表2 Hsa-miR-139-3p 靶基因的GO 功能分析

续表2

续表2

表3 Hsa-miR-139-3p 靶基因KEGG 通路富集分析
3 讨论
LEE 等在1993年首次发现miRNA。紧接着第2个miRNA let-7 于线虫体内又被研究者发现从此开启了们对miRNA 的研究大门。大多数miRNA 是一种高度保守的小分子,在不同的生物中具有相同的调节机制[24-25]。通过研究植物、动物和病毒中的miRNA,发现其在物种间具有高度的保守性、时序性和组织特异性,表明miRNA 在基因表达调控中有着广泛的作用。本研究证实miR-139-3p 序列在多个物种间高度保守,提示其对生物体有着极其重要甚至不可替代的功能。同时,其序列的保守性使小鼠等模式生物成为研究miR-139-3p 生物学作用的有力工具[26]。
研究者们还发现,miRNA 在生物体内不参与蛋白质合成,但在编码蛋白的基因表达方面有着非常重要的调控作用[27]。miRNA 主要通过与靶mRNA 分子3’端非编码区域进行不完全或完全配对,在转录后水平调控靶mRNA,降低其翻译效率。而每个miRNA 都能作用于多个目标mRNA,调控约1/3 的蛋白基因序列[28]。因此,miRNA 及其靶基因形成一个严密、有序的调控网络,在生物发育的不同时期,miRNA 通过作用于不同的基因片段,调节相应功能蛋白的表达,从而调节细胞的发育、增殖、凋亡以及肿瘤、感染等多种病理生理过程[24]。
尽管最近几年有数百种miRNA 被陆续发现,但是只有少量miRNA 被阐明其作用,许多miRNA 的功能还是未知。因此,预测miRNA 靶基因和认识它们的相互作用,是了解miRNA 在不同的生理过程中的功能的关键。
本研究采用生物信息学方法,共预测得到133 个hsa-miR-139-3p 的靶基因,靶基因存在细胞的各个组分中,具有转录调控、基因表达调控和蛋白连接等分子功能,并显著富集于发育生物学过程;信号通路显著富集于黏着斑及基因信息处理相关通路,控制细胞生长及分化的信号。大量研究发现,miR-139-3p 在细胞增殖和分化过程中发挥着重要的调控作用,有学者发现,经过神经生长因子处理后的PC12 细胞中miR-139-3p 含量下降,推测miR-139-3p 能负调控神经元分化[29]。miR-139 还能通过调节MCPIP1/IL-6 的表达,诱导人退行性关节病软骨细胞凋亡[30]。有研究也证明miR-139-3p 在左心室肥大和细胞凋亡中发挥信号转导的作用[31]。
大量研究表明,hsa-miR-139-3p 在多种恶性肿瘤中异常表达。如hsa-miR-139-3p 在结肠癌肝转移以及希佩尔·林道综合征引起的嗜铬细胞瘤中呈现高表达[15,32]。然而有研究发现,hsa-miR-139-3p 在膀胱癌、结肠癌、宫颈癌等多种癌细胞内呈现低表达[7-8]。且近年来已有部分研究证实hsa-miR-139-3p 是通过调控其靶基因的方式,在抑制肿瘤细胞的增殖和转移发挥重要作用,如hsa-miR-139-3p 可通过抑制NOB1的表达,进而抑制HL 细胞的增殖和迁移[33]。在细胞凋亡和其他肿瘤过程中,miRNA 表达的双相模式(上下调节)已经确定,因此hsa-miR-139-3p 或许可考虑作为肿瘤的早期诊断和预后的分子生物标志物[34-36]。
综上所述,本研究采用生物信息学方法对hsamiR-139-3p 的GO 功能富集分析和Pathway 通路富集分析等数据进行系统挖掘,结果显示hsa-miR-139-3p在生长发育及肿瘤发生、发展中的作用不容忽视,且本研究结果与现有对miR-139-3p 调控作用的研究报道基本相符,说明生物信息学分析具有可靠性。这些分析为有关miR-139-3p 在各生物学过程中的调控机制后续探索提供一定的数据支持和研究思路。但在原始数据方面尚存在靶基因数据假阳性率较高、基因数据尚不全面等不足,因此,本试验筛选出的靶基因还需验证,其功能和相关信号通路也有待进一步研究[37]。
