FAM134B介导的内质网自噬对脓毒症的影响
2019-09-17杨勇高甜甜吴狄凌伍国宝黄佳李金秀
杨勇,高甜甜,吴狄凌,伍国宝,黄佳,李金秀
(中南大学湘雅二医院 重症医学科,湖南 长沙 410011)
脓毒症是全身性炎症反应综合征,是急危重患者严重的并发症之一,其发生的主要因素包括大的手术,感染及严重烧伤等[1]。脓毒症病程发展迅速,其发病率及病死率居高不下,是重症医学所面临的一个巨大挑战[2]。早期的研究显示,脓毒症的发生主要是由于过度炎症反应从而导致体内炎症反应失衡,大量炎症介质如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白细胞介素-6(Interleukin 6,IL-6)等释放,导致组织及器官的损害[3-4]。随着研究的进一步深入,发现脓毒症的发病过程十分复杂,涉及机体炎症、免疫和凝血功能障碍等多个方面,同时,其对细胞功能代谢的影响也越来越受到关注[5]。脓毒症致死率较高,临床表现缺乏特异性,近年来,其发病机制的研究具有一定的临床参考价值,深入且全面了解脓毒症的发病机制对临床诊断治疗及预后具有重要意义[6]。
内质网(endoplasmic reticulum,ER)是最大的细胞内膜系统,在蛋白质及脂质合成,离子稳态,细胞器之间通讯中发挥重要功能[7]。为满足细胞在不同应激下的功能,内质网稳态的维持至关重要,其中自噬在这个过程中发挥重要作用[8-9]。2015年研究发现,在真核细胞中存在的某些特殊蛋白可以介导内质网选择性程序性降解,其中FAM134B 作为内质网中的蛋白,可以通过与LC3 Ⅱ相互作用,帮助内质网碎裂,形成小的片段从而被自噬体包裹,并与溶酶体融合降解[10-11]。早期对FAM134B基因的研究中发现,其在感觉神经疾病患者中存在突变,FAM134B敲除小鼠同样可以表现出这种感觉缺陷。在这些小鼠中,内质网在痛觉感知神经元细胞体中累积无法有序降解,导致内质网自噬受损[10-11]。现在越来越多的研究显示,内质网自噬在很多疾病的发生发展中发挥重要的功能,本研究利用脓毒症大鼠及细胞模型,探讨内质网自噬在脓毒症发病的中的功能及相关机制。通过检测脓毒症大鼠脑组织及相关细胞模型中内质网蛋白FAM134B表达及分布,自噬及凋亡相关蛋白的表达及细胞凋亡情况,进一步了解FAM134B 介导的内质网自噬在脓毒症发生中的作用。
1 材料与方法
1.1 材料
雄性SD 大鼠,体重250~300 g,购自湖南斯莱克景达实验动物有限公司,N2a 细胞系来源于ATCC(美国典型培养物保藏中心),LC3 抗体、Activated-Caspase-3 抗体、Caspase-3 抗体、LC3 抗体、Beclein1抗体及FAM134B 抗体购自美国Cell Signaling Technology公司,β-actin 抗体、脂多糖(LPS)购自美国Sigma-Aldrich 公司,BSA 蛋白定量试剂盒、DMEM 培养基、胎牛血清(FBS)及胰蛋白酶购自美国Thermo Fisher Scientific 公司,引物购自宝生物工程(大连)有限公司,其他相关生化试剂为国产分析纯。
1.2 方法
1.2.1 脓毒症大鼠模型的复制 采用盲肠结扎穿孔术(CLP)方法诱发SD 大鼠脓毒症,使用4 ml/kg 水合氯醛通过腹腔注射麻醉,打开腹腔,在离盲肠4 cm处结扎,CLP 6 h 后注射抗生素,同时观察大鼠相关改变,确定为脓毒症大鼠模型[12]。动物实验完成于中南大学湘雅二医院实验动物中心[行政许可决定书文号:SYXK(湘)2017-0002]。
1.2.2 脓毒症大鼠模型中脑部组织总RNA 及总蛋白的提取 SD 大鼠分为两组,正常大鼠组(对照组)及CLP 诱发脓毒症大鼠组(CLP组),每组8 只。在不同处理后,对大鼠进行麻醉和灌注固定,剥取鼠脑。将大鼠的头部剪下,用剪刀剥取皮肤,再用镊子和剪刀将大鼠脑外坚硬的外膜剥除,小心地取出完整的脑部,加入1 ml 的Trizol,匀浆研碎,室温5 min。加入200 μl 氯仿,剧烈摇荡离心管,4℃、11 600 r/min 离心10 min;转移水相于一新EP 管,加0.7 倍体积异丙醇,4℃、11 600 r/min 离心10 min;弃上清液,加入1 ml 75%酒精,混匀,4℃、11 600 r/min 离心2 min,重复2 遍;弃上清,室温干燥5 min,溶于DEPC 水中,测光密度(OD)值。同时取一部分脑部于匀浆器中,加入适量的蛋白酶抑制剂的SDS 裂解缓冲液中,冰上匀浆后静置20 min,转移至EP 管中,4℃、11 600 r/min离心5 min,取上清液即得到脑组织的总蛋白。
1.2.3 实时荧光定量聚合酶链反应(qRT-PCR)检测FAM134B mRNA 的表达 Trizol 法提取组织总RNA,紫外分光光度计进行定量检测,逆转录合成cDNA,qRT-PCR 检测FAM134B、β-actin mRNA 的Ct 值,扩增条件:94℃预变性5 min;94℃变性30 s,60℃退火34 s,40 个循环;做熔解曲线。以各基因Ct值与β-actin mRNA Ct 值的差值为△△Ct,计算各基因mRNA 的相对表达水平,并以正常组为参照做归一处理,其他各组与其做比较。
1.2.4 N2a 细胞培养及处理 N2a 细胞培养于10% FBS 加DMEM 细胞培养基中,37℃、5%二氧化碳CO2,当细胞汇合度达到约80%时使用0.05%胰蛋白酶进行消化传代。研究LPS 诱导脓毒症细胞模型中内质网自噬及细胞凋亡实验中,将细胞分为3组,分别为对照组、10 mg/L LPS 处理组及20 mg/L LPS 处理组;研究过表达FAM134B 对自噬及凋亡相关蛋白表达的影响实验中,将细胞分为3组,分别为对照组、20 mg/L LPS 处理组及FAM134B 过表达+20 mg/L LPS处理组[FAM134B OE+ LPS(20 mg/L)组]。
1.2.5 Western blotting 检测FAM134B、LC3、Beclin1及Caspase-3 蛋白相对表达 利用BSA 蛋白定量试剂盒进行定量,并不同样品取等量的蛋白质(20 μg);12% SDS-Page 变性胶电泳,条件为80 V,20 min 后,将电压调至120 V,继续电泳90 min;恒流290 mA 转移至PVDF 膜,5%脱脂牛奶封闭1 h 后,孵育使用相关一抗,4℃振摇过夜;次日5% PBST 洗膜,10 min,4 次;孵育对应的二抗,振摇1 h,5% PBST 洗膜,10 min,3 次;暗房曝光显影,并进行相应的定量分析。
1.2.6 免疫荧光检测FAM134B 亚细胞分布 培养的N2a 细胞胰蛋白酶消化后接种至24 孔板爬片中,经不同处理后,使用4%多聚甲醛固定,0.1% Triton/PBS进行渗透打孔后;5% BSA/PBS 进行封闭;一抗室温孵育1 h;PBS 洗5 次,5 min/次;孵育相对应二抗,室温孵育1 h;PBS 洗5 次,5 min/次;Dapi 染细胞核3 min,转移反扣至载玻片上,封片,激光共聚焦显微镜下观察及拍照。
1.3 统计学方法
采用SPSS 13.0 统计软件进行分析,计量资料以均数±标准差(±s)表示,两组比较采用t检验,多组间比较用方差分析,进一步两两比较使用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 脓毒症大鼠脑组织中内质网蛋白FAM134B的表达情况
采用CLP 方法成功复制脓毒症大鼠模型,对照组FAM134B mRNA 表达水平为(1.000±0.223),CLP组为(0.430±0.251),两组比较,差异有统计学意义(t=3.229,P=0.032),CLP组FAM134B mRNA表达水平低于对照组。对照组和CLP组FAM134B FAM134B 蛋白表达水平分别为(0.398±0.112)和(1.000±0.185),两组比较,差异有统计学意义(t= 5.021,P=0.019),CLP组中FAM134B 蛋白表达水平低于对照组,见图1。
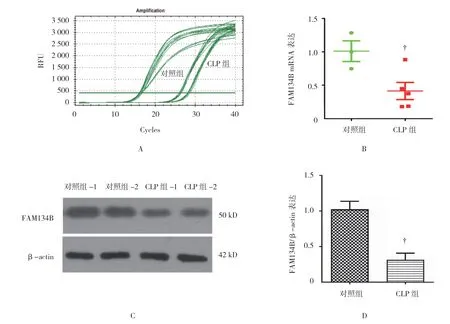
图1 脓毒症大鼠脑组织中内质网蛋白FAM134B 的表达情况
2.2 LPS 诱导脓毒症细胞模型中内质网自噬及细胞凋亡
免疫荧光结果显示,对照组中,FAM134B 主要呈现内质网分布,同时,在20mg/L LPS 处理组中,可以看到在细胞质中FAM134B 呈现很多点状分布,在LPS 处理后,细胞内质网合成及降解稳态被破坏,大量不能降解的内质网聚集在细胞中。Western blotting检测结果显示,各组FAM134B、LC3-Ⅱ、Beclin1、Activated Caspase-3 表达水平比较,经方差分析,差异有统计学意义(P<0.05)。LPS 处理组FAM134B蛋白总量下降,10mg/L LPS 处理组、20mg/L LPS 处理组FAM134B 蛋白总量与对照组比较,差异有统计学意义(P<0.05),LPS 处理组FAM134B 蛋白总量下降。同时,10mg/L LPS 处理组、20mg/L LPS 处理组中自噬相关蛋白LC3-Ⅱ及Beclin1 表达量与对照组比较,差异有统计学意义(P<0.05),LPS 处理组增加。10mg/L LPS 处理组、20mg/L LPS 处理组凋亡相关蛋白Activated Caspase-3 表达与对照组比较,差异有统计学意义(P<0.05),LPS 处理组高于对照组。利用Annexin V-FITC/PI 双染流式细胞仪分析各组细胞凋亡率,对照组、10mg/L LPS 处理组、20mg/L LPS 处理组细胞凋亡率分别为(4.87±1.24)%、(11.12±1.33)%及(20.85±3.72)%,经单因素方差分析,差异有统计学意义(F=61.400,P =0.000),10mg/L LPS 处理组、20mg/L LPS 处理组细胞凋亡率高于对照组(P<0.05),见图2和表1。
2.3 过表达FAM134B 对自噬及凋亡相关蛋白表达的影响

图2 LPS 诱导脓毒症细胞模型中内质网自噬及细胞凋亡
表1 不同浓度LPS 处理N2a 细胞后LC3-Ⅱ、Beclin1、Activated Caspase-3 蛋白表达水平比较(±s)

表1 不同浓度LPS 处理N2a 细胞后LC3-Ⅱ、Beclin1、Activated Caspase-3 蛋白表达水平比较(±s)
注:†与对照组比较,P <0.05。
组别 LC3-Ⅱ Beclin1 Activated Caspase-3对照组 1.00±0.134 1.00±0.183 1.00±0.153 10 mg/L LPS 处理组 1.88±0.244† 1.92±0.252† 2.21±0.312†20 mg/L LPS 处理组 3.95±0.449† 3.87±0.321† 4.56±0.572†F 值 69.220 95.422 88.635 P 值 0.000 0.000 0.000
过表达FAM134B 后LPS 处理,各组LC3-Ⅱ、Beclin1、Activated Caspase-3 相对表达水平比较,经方差分析,差异有统计学意义(P<0.05)。过表达FAM134B 后处理LPS,FAM134B OE+LPS(20mg/L)组自噬相关蛋白LC3-Ⅱ及Beclin1 及凋亡相关蛋白Activated Caspase-3 与20mg/L LPS 处理组比较,差异有统计学意义(P<0.05),FAM134B OE+LPS(20mg/L)组的表达量减少。利用Annexin V-FITC/PI 双染流式细胞仪分析,对照组、20mg/L LPS 处理组、FAM134B OE+LPS(20 mg/L)组凋亡率分别为(4.87±1.24)%、(20.85±3.72)%及(9.65±2.67)%,经单因素方差析,差异有统计学意义(F=59.180,P =0.000);FAM134B OE+LPS(20mg/L)组细胞凋亡与20 mg/L LPS 处理组比较,差异有统计学意义(P<0.05),FAM134B OE+LPS(20 mg/L)组较20 mg/L LPS 处理组细胞凋亡率减少,FAM134B 对LPS 对细胞损害具有一定保护作用,见图3和表2。

图3 过表达FAM134B 减少LPS 对细胞的损害
表2 过表达FAM134B 后各组LC3-Ⅱ、Beclin1、Activated Caspase-3 蛋白表达水平比较(±s)
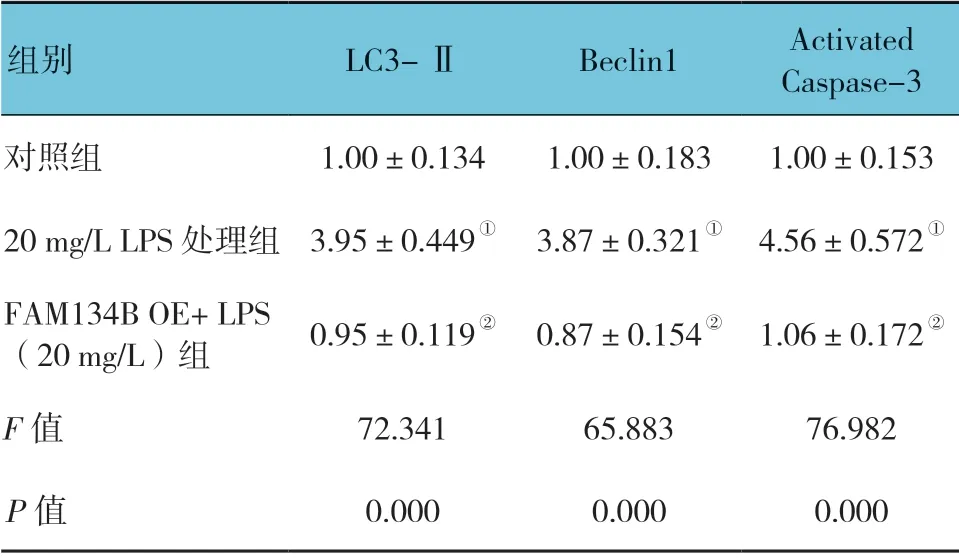
表2 过表达FAM134B 后各组LC3-Ⅱ、Beclin1、Activated Caspase-3 蛋白表达水平比较(±s)
注:①与对照组比较,P <0.05;②与20 mg/L LPS 处理组比较,P <0.05。
组别 LC3-Ⅱ Beclin1 Activated Caspase-3对照组 1.00±0.134 1.00±0.183 1.00±0.153 20 mg/L LPS 处理组 3.95±0.449① 3.87±0.321① 4.56±0.572①FAM134B OE+ LPS(20 mg/L)组 0.95±0.119② 0.87±0.154② 1.06±0.172②F 值 72.341 65.883 76.982 P 值 0.000 0.000 0.000
3 讨论
炎症反应和氧化应激在脓毒症发病中起到重要作用[13]。脓毒症发生时,中性粒细胞和单核细胞等炎症细胞释放IL-lα、IL-1β、IL-6 以及TNF-α 等促炎症因子[14]。该炎症因子可诱发过量的氧化应激反应,导致细胞代谢紊乱,促使细胞损伤。研究发现LPS 和促炎因子诱导细胞激活iNOS 活性,增加过氧化物水平,可直接或间接诱导细胞凋亡等病理生理损害[15-16]。
之前的脓毒症发病机制研究较多的关注炎症反应,氧化应激及线粒体损伤在脓毒症发病中的作用,较少考虑到内质网自噬在脓毒症发病中的功能[17-18]。内质网作为细胞生命中一个重要的细胞器,在蛋白质及脂质的合成和转运中发挥至关重要的作用,且其参与细胞中膜结构的转运等,参与线粒体功能的维持[19-20]。FAM134B 作为内质网上的一个重要蛋白,2015年研究发现,其可以通过与LC3B 相互作用,帮助将内质网碎裂,形成小片段从而被自噬体包裹,并与溶酶体融合降解,从而维持内质网稳态。本研究发现脓毒症大鼠脑组织中内质网蛋白FAM134B 表达下降;LPS 诱导脓毒症细胞模型中内质网自噬及细胞凋亡且过表达FAM134B减少LPS 对细胞的损害[10]。内质网应激在细胞凋亡及功能维持等生命过程中发挥重要作用,其与多种疾病相关,包括神经退行性疾病,缺血再灌注损伤,糖尿病等[9]。阿尔兹海默相关基因PS-1突变可以促进内质网应激从而导致神经元退行性死亡[21]。内质网应激也可以降低帕金森病相关基因Parkin 的表达,影响其对错误折叠蛋白如α-synuclein 等的清除,α-synuclein 蛋白的异常聚集是导致帕金森病发生的重要特征[22]。缺氧缺血可以导致异常折叠蛋白的聚集从而产生内质网应激,在灌注后使受损组织发生氧化应激,NO 和其他活性氧生成增加,钙离子通道受损,从而导致细胞损伤[23]。胰岛B 细胞具有成熟发达的内质网合成系统,其可分泌大量的胰岛素及其他糖蛋白,婴儿型糖尿病相关基因PERK 缺失,其可影响胰岛B 细胞内质网结构,增加内质网应激,促使JNK 信号通路的异常活化,导致胰岛素合成障碍[24]。
自噬是是细胞维持自身稳态的一个重要反应,过度自噬可诱导细胞凋亡,细胞死亡[25]。研究显示LPS诱导的脓毒症细胞模型自噬水平增加,细胞凋亡增多,其主要可以通过IL-lα、IL-1β、IL-6 以及TNF-α等促炎症因子发挥功能,也可诱导线粒体自噬,细胞能量代谢异常导致[26-27]。本研究同时发现,LPS 处理中,FAM134B 在内质网中的分布发生异常,成聚集点状分布,其可能诱导内质网自噬而聚集无法降解相关,进一步检测发现自噬及凋亡相关蛋白表达发生改变,且在过表达FAM134B 后此现象得到改善,说明FAM134B能减少LPS 对细胞的损害,进一步证实FAM134B 介导的内质网自噬影响脓毒症的发生,为深入了解脓毒症的发病机制具有重要意义。
