降糖藏药康珠甘露总黄酮口服前体脂质体的制备及质量评价
2019-09-17
西南民族大学,四川 成都 610041
前藏药降糖复方(康珠甘露)是本课题组在传统民族药方剂基础上化裁而来,用于二型糖尿病治疗及心脑血管保护。康珠甘露以传统藏药俄色作为君药, 麦冬、黄芪、枸杞等为臣药,前期研究表明,俄色中的黄酮类化合物有明显的降脂降糖作用,麦冬、黄芪、枸杞等是常用的中药材,其中的多糖、皂苷、黄酮等有提高人体免疫力, 降低血脂血糖等多种作用[1-3]。康珠甘露总黄酮提取物(ZYZH)为其主要药效成分,ZYH为其中一种主要黄酮苷成分,为其指标和主要有效成分。其作用机制为对胰岛β细胞的保护作用[4-6];增加胰岛素的敏感性,改善胰岛素抵抗及相关代谢紊乱[7-8]。
降糖藏药康珠甘露总黄酮水溶性差,口服具有首过效应,如何提高黄酮苷类天然药物的生物利用度,一直是药剂学领域的一个难题,为了提高其口服生物利用度,故本实验采用前体脂质体技术制备了一种新型的口服ZYZH固体前体脂质体给药系统,以提高ZYZH的生物利用度。前体脂质体在运输,储存的过程中比起普通脂质体有更好的稳定性,减少聚集、融合及药物渗漏。但不同制备方法制备的前体脂质体质量不同。
本实验针对ZYZH溶解度低,首过效应明显,口服生物利用度差的特点,将其制备成一种新型的前体脂质体制剂,以期不但具备脂质体的优点,并克服传统脂质体剂型贮存稳定性差的缺点。一方面可以提高药物的溶出;另一方面最终增加ZYZH总黄酮在胃肠道的跨膜吸收和口服生物利用度。因此, 采用载体沉积法[9]制备藏药康珠甘露总黄酮(ZYZH)前体脂质体 , 并对ZYZH前体脂质体的质量进行评价。
1 材料
1.1 仪器 AL104电子分析天平,英国malvern公司;JSM-7500F 扫描电镜,日本电子株式会社;MS-2000激光粒度分析仪,英国malvern公司;SENCO-R系列旋转蒸发仪,上海申申科技有限公司;Waters2695高效液相色谱仪,美国Waters;KQ250B超声波清洗器,昆山市超声仪器有限公司;PHS-2C,上海罗素科技有限公司。
1.2 药品及试剂 ZYZH原料药,由西南民族大学少数民族药物研究所提供,含量≥60%;ZYH对照品,由西南民族大学少数民族药物研究所提供,批号20150508,经核磁和质谱鉴定,采用HPLC法测定,经面积归一化法计算纯度大于98%;山梨醇,氯化钠,乳糖,无水乙醇,磷酸缓冲盐溶液(PBS),胆固醇,氯仿,卵磷脂,SephadexG-50,以上试剂均为分析纯,甲醇(色谱纯),均由成都市科龙化工试剂厂提供。
2 方法与结果
2.1 ZYZH脂质体包封率测定
2.1.1 供试品溶液的制备
2.1.1.1 对照品溶液的制备 精密称取ZYH对照品0.5260 g,用甲醇溶解并定容至100 mL,再取1 mL于10 mL容量瓶中,加甲醇定容至刻度,配置成浓度为0.5260 mg·mL-1的储备液。
2.1.1.2 空白脂质体溶液的制备 取1.000 g制得的空白前体脂质体用5 mL PBS(pH 7.0)水合后,取水合后脂质体超声破膜后,取用甲醇稀释定容至25 mL过滤取滤液即得。
2.1.1.3 ZYZH脂质体溶液的制备 取1.000 g制得的ZYZH前体脂质体用5 mL PBS(pH7.0)水合后,取水合后脂质体超声破膜后,用甲醇稀释定容至25 mL过滤取滤液即得。
2.1.1.4 脂质体包封率测定 按照本实验前期所建立的SephadexG-50柱分离法,测定方法简述如下:称取一定量的SapHadexG-50(100~200 μm),用缓冲溶液室温浸泡24 h后装柱,精密吸取一定量脂质体样品上样,控制流速在0.8~1 mL/min,用PBS洗脱,收集前10 mL含脂质体的初洗脱液(a),另取与上样量同体积的脂质体混悬液,用10 mL PBS稀释,得未分离溶液(b)。分别取a、b溶液用无水乙醇稀释至澄明,超声破膜,进样,测定其峰面积,根据标准曲线计算浓度和含药量。a溶液测得的药物浓度记作C包裹,b溶液测得的药物浓度记作C总。
包封率EE%=脂质体分离比(%)=C包裹/C总×100%
2.1.2 HPLC 法的建立及验证
2.1.2.1 紫外检测波长的选择 取适量ZYH对照品,用乙醇溶解,配制成对照品溶液。以无水乙醇为空白对照,用紫外分光光度计200~800 nm范围扫描测定对照品中ZYH的吸光度。可知ZYH在285 nm附近有最大吸收值,将 HPLC 的检测波长定位285 nm。
2.1.2.2 色谱条件 色谱柱:Dikama Dimonsil C18(2), (250 mm×4.6 mm,5 μm);紫外检测波长:285 nm;流动相:甲醇∶水=2∶3;流速:0.8 mL·min-1;柱温:30 ℃;进样量:10 μL。
2.1.2.3 专属性实验 空白脂质体溶液、含药脂质体溶液、ZYH对照品溶液各进样10 μL,记录色谱图,观察辅料对ZYH检测的影响。
2.1.2.4 标准曲线的绘制 取上述浓度为0.5260 mg·mL-1的对照品溶液,以2.0、4.0、6.0、8.0、10.0、12.0、14.0 μL进样体积精密进样,按“2.1.2.2”项色谱条件对峰面积进行测定,以峰面积作为纵坐标,进样量作为横坐标进行线性回归,得其标准曲线为y=2E+06x-102884(R2=0.999),在1.064~7.448 μg范围内,ZYH进样量与峰面积线性关系良好。
2.1.2.5 精密度实验取ZYH(0.5260 mg·mL-1)对照品溶液,以每次10 μL的量,分别连续进样6次,按“2.1.2.2”项色谱条件对峰面积进行测定。连续进样6次的RSD值为1.6%(n=6),表明仪器精密度良好。
2.1.2.6 稳定性实验 取ZYZH脂质体溶液,按“2.1.2.2”项色谱条件以进样量为10 μL,分别在0、2、4、8、14、24 h进样分析,测定ZYH峰面积。计算得到RSD=0.5%(n=6),这说明了脂质体样品溶液在24 h内稳定。
2.1.2.8 加样回收实验 取含有量已知的脂质体溶液6份,分别精密加入ZYZH标准品100 mg,按“2.1.1”项下方法制备供试品溶液,在“2.1.2.2 ”项色谱条件下测定,ZYH平均加样回收率为98.04%,RSD值为1.1%(n=6)。说明测定方法可靠、结果准确。
2.2 载体沉积法制备ZYZH前体脂质体 取处方量载体粉末置于1000 mL茄形瓶中,在旋转蒸发仪上以80~90 rpm转速、水浴恒温40 ℃的条件,减压预热30 min。取处方量ZYZH原料药、大豆卵磷脂,胆固醇适当超声和温热使溶于适量有机溶剂(氯仿:甲醇)中,以1.0 mL/min加入上述有机混合液,真空旋转蒸发。有机混合液全部加入后,继续旋转蒸发30~40 min,将粉末置于真空干燥器中12 h后过筛(40目)。即得ZYZH前体脂质体。
2.3 影响前体脂质体制备因素的考察 包封率是脂质体质量评价的最重要指标,经过预试验发现载体种类、载体与卵磷脂的比例、药物与卵磷脂的比例、卵磷脂与胆固醇的比例、水浴温度和进样量是影响 ZYZH 前脂质体包封率的主要因素。通过单因素实验考察各因素对ZYZH前体脂质体粒径分布、Zeta电位及包封率的影响。
2.3.1 不同载体对包封率的影响 固定处方及工艺中的其他因素不变:分别选用氯化钠、山梨醇、乳糖为载体,制备ZYZH前体脂质体,测定其包封率分别为60.3%,62.1%,59.3%。结果表明载体为山梨醇时,制备的脂质体包封率高、稳定性好,且三种载体对粒径和Zeta电位的影响较小。
2.3.2 载体与卵磷脂比对包封率的影响 固定处方及工艺中的其他因素不变:改变卵磷脂:载体(w/w)的比例,使之分别为 1∶3、1∶4、1∶5、1∶6、1∶7,制备ZYZH前体脂质体,测定其包封率分别为55.1%、61.2%、62.8%、60.6%、59.9%。结果表明载体与卵磷脂比为5∶1时,制得的ZYZH前体脂质体包封率最高。
2.3.3 药物与卵磷脂比对包封率的影响 固定处方及工艺中的其他因素不变,改变卵磷脂∶药物(w/w)的比例,使之分别为6∶1、8∶1、10∶1、12∶1、14∶1制备ZYZH前体脂质体,测定其包封率分别为 59.3%、60.5%、62.8%、 58.5%、58.4%。结果表明药物与卵磷脂的比例(w/w)为 1∶4 时,所制得的ZYZH前体脂质体包封率最高。
2.3.4 卵磷脂与胆固醇比例对包封率的影响 固定处方及工艺中的其他因素不变,使处方中卵磷脂∶胆固醇(w/w)的比例分别为2∶1、3∶1、4∶1、5∶1、6∶1,制备ZYZH前体脂质体,测定其包封率分别为55.7%、57.2%、60.6%、58.6%、55.4%。结果表明,卵磷脂:胆固醇(w/w)的比为4∶1时制备的ZYZH前体脂质体包封率最高。
2.3.5 水浴温度对包封率的影响 固定处方及工艺中的其他因素不变,考察水浴温度分别为 30、35、40、45、50 ℃,制备ZYZH前体脂质体,制备ZYZH前体脂质体,测定其包封率分别为 56.8%、57.5%、61.3%、60.2%、59.5%。结果表明,水浴温度为40℃时,制得的ZYZH前体脂质体包封率最高。
2.3.6 进样速度对包封率的影响 固定处方及工艺中的其他因素不变,考察进样速度分别为 0.6、0.8、1.0、1.2、1.4 mL/min,测定其包封率分别为59.3%、60.5%、61.7%、58.2%、58.4%。结果表明,进样速度为1.0 mL/min时,制得的ZYZH前体脂质体包封率最高。
2.3.7 正交试验优化 以包封率作为主要指标,结合单因素试验结果,对水浴温度(A);载脂比(w/w)(B);胆固醇与卵磷脂比例(w/w) (C);药物与卵磷脂比例(w/w)(D);4个因素进行4因素3水平实验,选用 L9(34) 正交表安排试验,制备ZYZH前体脂质体,测定包封率。结果见表1。

表1 正交试验结果
从表中可按极差R值大小排序,D>B>A > C,即药物与卵磷脂的质量比是影响包封率的主要因素。且按照A2B1C3D2组合制备的ZYZH前体脂质体,复水后的包封率为67.7%,较优于其他组合的包封率。因此水浴温度为40 ℃,进样速度为1.0 mL/min、卵磷脂与载体的质量比为1∶4,卵磷脂与胆固醇的比例为5∶1,药物与卵磷脂质量比为1∶10为最优处方。
2.4 验证试验 按最优处方制备 3 批ZYZH前体脂质体,测定其包封率分别为67.1%、67.5%、67.2%。由测定结果可知该处方和制备条件稳定可行。
2.5 ZYZH前体脂质体的质量评价
2.5.1 ZYZH前体脂质体外观形态、包封率的测定 依照“2.1.1.4”项方法测定ZYZH前体脂质体的包封率。
取样品少量,用去离子水稀释100倍,超声5 min,使其均匀分散;用毛细管将样品滴于导电胶上,置于烤灯下烘干(温度低于50 ℃);将导电胶粘到载物台上,固定好,喷金;将制作好的样品用JSM-7500F型扫描电镜进行形态观察。结果见表2。

表2 ZYZH前体脂质体质量参数 (n=3)
实验结果表明,载体沉积法制备的ZYZH前体脂质体容易复水,粒径均一,包封率较高,水合后性质稳定。

2.5.2 粒径分布 取载体沉积法ZYZH前体脂质体粉末,加PBS振摇 5 min 复溶,得ZYZH脂质体复溶液,稀释,采用激光粒度分析仪测定复溶所得ZYZH脂质体的以粒子体积为权重的重量平均粒径分布。结果如图2所示。
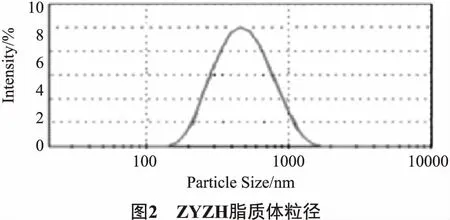
由图2可以看出对ZYZH前体脂质体水合后粒度分布测定,脂质体的平均粒径为(442.5±3.5)nm(PDI=0.177),粒度分布比较均匀。
2.5.3 Zeta电位的测定 对载体沉积法ZYZH前体脂质体水合后Zeta电位测定,结果如图3所示。
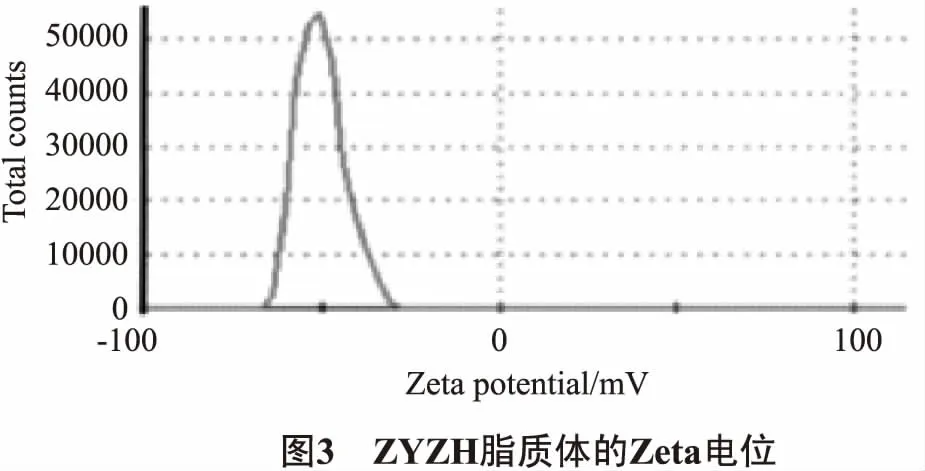
由图3可以看出,3批脂质体的Zeta电位为(-47.2±3.4)mV,表明ZYZH前体脂质体在水中较为稳定。
2.5.4 ZYH含量测定 取本品适量,加甲醇30 mL,超声提取1 h后,放冷,滤过,滤液蒸干,残渣加2 mL甲醇使溶解,作为供试品储备液。精密量取10 μL注入液相色谱仪,记录色谱图;以峰面积计算,即得ZYH含量。结果见表3。

表3 ZYH含量测定
2.6 前体脂质体稳定性考察 稳定性研究目的是考察原料药或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药安全有效。由于天然磷脂中含有不饱和脂肪酸链,在高温和光照条件下易于氧化和水解,生成过氧化物、游离脂肪酸,丙二醛、溶血卵磷脂和甘油磷酸复合物等,使制剂的外观、色泽、包封率以及ZYZH的含量发生变化。进而影响ZYZH前体脂质体的再分散后的均匀性,导致包封率下降,ZYZH的含量降低。
2.6.1 高温试验 将制备的前体脂质体密封于西林瓶中60 ℃ 恒温条件下保存,分别于第0、5、10、20、30天取样,对其外观、粒径分布、Zeta电位值、脂质体包封率、水化再分散性和 pH 值进行考察。在30 d的高温验中,ZYZH前体脂质体外观发生了轻微变化,从浅黄色固体无结块到粒子颜色变深且有少许结块,水合难度增加,平均粒径升高,pH值,包封率,Zeta电位轻微下降但幅度不大,结果见表4。说明ZYZH前体脂质体在强光条件下具有一定的稳定性。

表4 高温实验结果 (n=3)
表4~7备注:药物及磷脂在高温、高湿及光照条件下,色泽会变化,粉末粘稠结小块,引起流动性的变化。评定标准为:浅黄色,无结块“-”; 颜色变深,无结块“-+”;深黄色,结块,粒子变粘“+”。以水化完全的难易程度进行分类:加水轻微振摇(-),加水振摇(-+),加水强烈振摇(+)。
2.6.2 强光实验 将制备的前体脂质体密封于西林瓶中,于光照度为(4500±500)Lx、的光照箱中放置, 分别于第0、5、10、20、30天取样,对其外观、粒径分布、Zeta电位值、脂质体包封率、水化再分散性和pH值进行考察。在30天的强光验中,ZYZH前体脂质体外观无变化,水合难度少许增加,平均粒径,pH值,包封率,Zeta电位基本不变,结果见表5。说明ZYZH前体脂质体在强光条件下具有一定的稳定性。
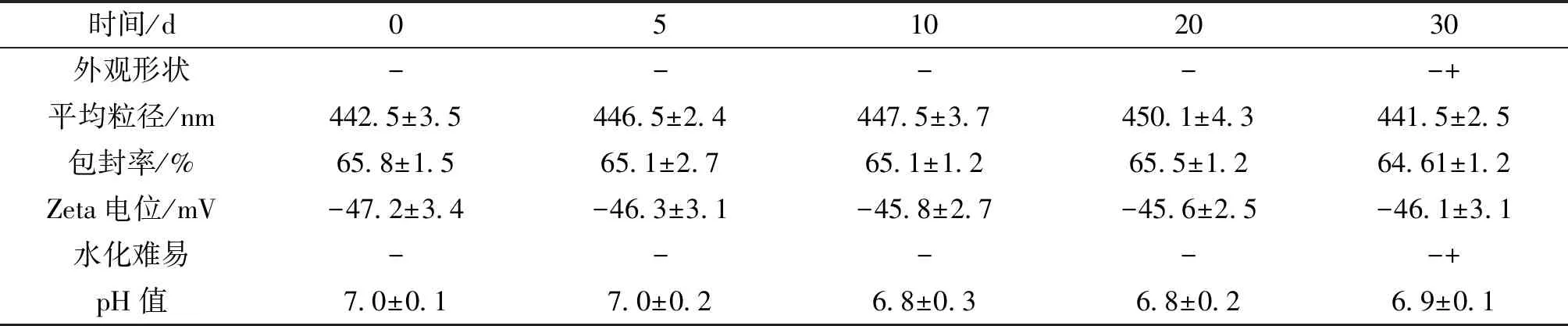
表5 强光实验结果 (n=3)
2.6.3 室温避光留样 将制备的前体脂质体密封于西林瓶中25 ℃ 室温条件下避光保存,分别于 0、1、2、4、6 月取样, 对其外观、粒径分布、Zeta电位值、脂质体包封率、水化再分散性和pH值进行考察。在6个月的25 ℃避光留样实验中,ZYZH前体脂质体外观基本无变化为浅黄色固体且无结块的形成,平均Zeta电位、粒径及pH值基本不变,说明ZYZH前体脂质体在25 ℃条件下6个月内稳定。结果见表6。
2.6.4 4℃避光留样 将制备的前体脂质体密封于西林瓶中,密封于西林瓶中4 ℃ 条件下避光保存,分别于 0、1、2、4、6 月取样, 对其外观、粒径分布、Zeta电位值、脂质体包封率水化再分散性和 pH 值进行考察。在6个月的4℃避光留样实验中,ZYZH前体脂质体外观基本无变化为浅黄色固体且无结块的形成,平均Zeta电位、粒径及pH值基本不变,说明ZYZH前体脂质体在4℃条件下6个月内稳定,结果见表7。
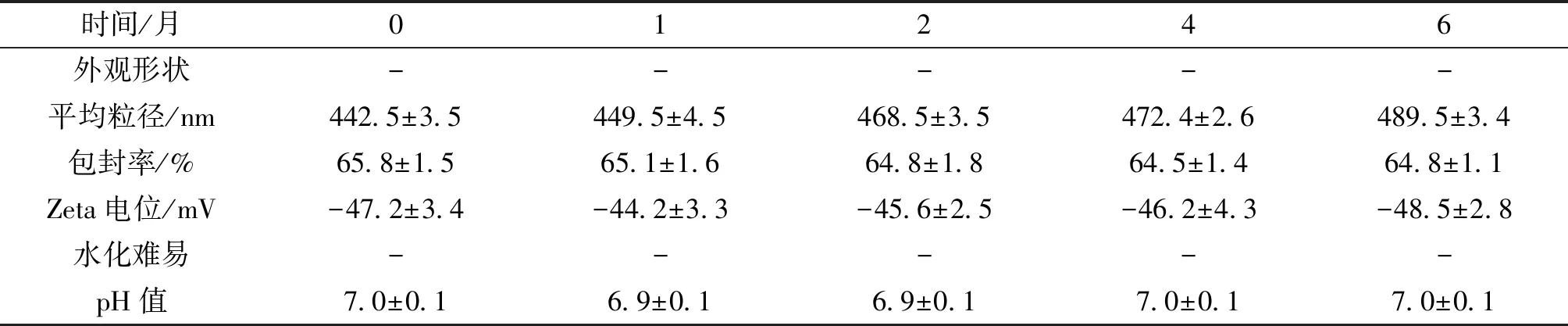
表6 25 ℃留样考察结果 (n=3)
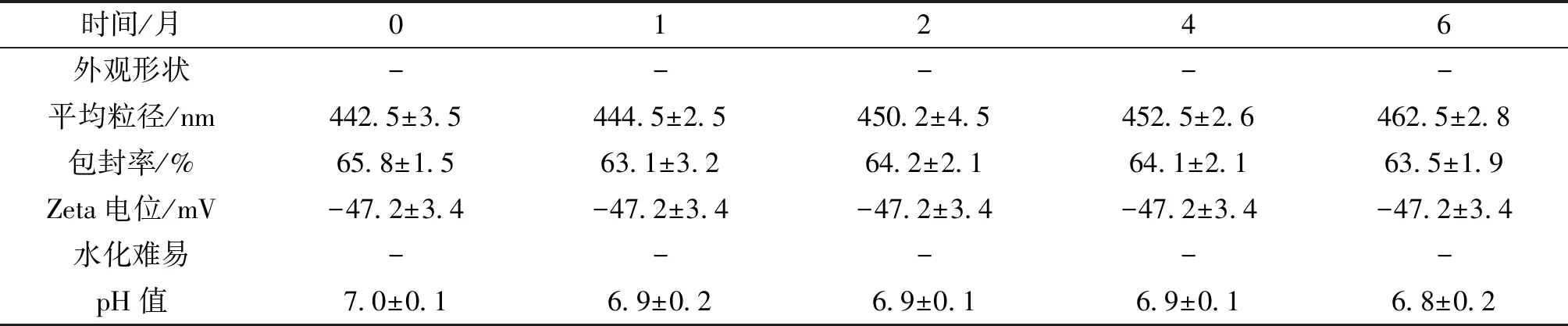
表7 4℃避光留样结果 (n=3)
3 结论和讨论
本实验采用常用的两种前体脂质体的制备方法:载体沉积法成功制备了ZYZH前体脂质体,并分别用单因素实验考察了各种因素对两种方法制备的前体脂质体成品的影响。在单因素实验的基础上用正交试验对两种方法进行了处方优化。考察了载体种类、水浴温度、磷脂与胆固醇的比例(w/w)、卵磷脂与载体的比例(w/w)、结果显示载体沉积法制备的前体脂质体总体结果较好。通过正交试验确立了载体沉积法的最佳处方为卵磷脂与载体的质量比(w/w)为1∶4,卵磷脂与胆固醇的质量比(w/w)为5∶1,药物与卵磷脂质量比(w/w)为1∶10,PBS的 pH 值为7.0。并确定了相应最佳制备工艺为,取处方量载体粉末置于1000 mL茄形瓶中,于旋转蒸发仪上以80~90 rpm转速、水浴恒温40 ℃的条件,减压预热30 min。取处方量ZYZH原料药、大豆卵磷脂,胆固醇适当超声和温热使溶于适量有机溶剂(氯仿:甲醇)中,以1.0 mL/min加入上述有机混合液,真空旋转蒸发。有机混合液全部加入后,继续旋转蒸发30~40 min,将粉末置于真空干燥器中12h后过筛(40目)。即得ZYZH前体脂质体。终产品为浅黄色具一定流动性的粉末。
经过三批次验证试验证明制备工艺可行,并制备得到了ZYZH前体脂质体制剂。制备的前体脂质体平均包封率为67.7%。
在ZYZH前体脂质体初步稳定性考察中,通过60℃高温试验、4000 LX强光照射试验、4 ℃留样考察以及25 ℃室温留样考察来研究ZYZH前体脂质体对温度和光照强度的敏感性,来确保ZYZH前体脂质体的稳定性和用药安全性、有效性。结果显示脂质体在4 ℃低温条件下及25 ℃常温条件有良好的稳定性;60 ℃高温条件及强光照射会使脂质体少许结块,水合难度相应增加。本实验说明ZYZH前体脂质体在室温和低温条件下具有良好的稳定性稳定,建议室温(25 ℃)或低温,避光保存。
在体外分析方法的建立过程中,本文选用其中一种主要药效成分ZYH为指标并对其建立了有效,可行的含量测定方法。但中药复方的药效作用是由多种有效成分相互影响而体现的,选用一种指标成分进行测定并不能全面反映所制备的制剂质量可控性。后续工作应对处方中其他有效成分进行系统分析,建立多指标成分的体外分析方法。
