血清TSH比值用于库欣综合征诊断的初步分析
2019-09-17柳华平冯安萍陈亚琴
柳华平 冯安萍 陈亚琴
库欣综合征(CS)是由长期慢性的糖皮质激素过量引起的临床症候群[1]。按病因可分为促肾上腺皮质激素(ACTH)依赖性CS和非ACTH依赖性CS。除典型的CS,近年来新发现两种温和形式的CS:亚临床库欣综合征(SCS)[2]和亚临床库欣病(SCD)[3]。目前,推荐过夜低剂量地塞米松抑制试验(LDDST)、午夜唾液和血液皮质醇和尿液游离皮质醇(UFC)作为皮质醇过量的筛查试验[4]。促甲状腺激素(TSH)分泌具有昼夜节律,在傍晚或清晨时出现峰值[5]。无论是否依赖ACTH,CS患者TSH的昼夜节律均消失[6]。提示除了皮质醇水平之外,TSH可能成为CS新的诊断标志物。本资料拟通过检查血清TSH的昼夜节律来评估其诊断CS及鉴别诊断SCS的效能。
1 资料和方法
1.1 一般资料 自2017年1月至2018年12月共纳入受试者178例,CS 12例和SCS 10例。余135例住院患者用于CS鉴别诊断,其中,垂体瘤患者49例,肾上腺肿瘤患者68例,其他患者(糖尿病和肥胖)18例。另外,纳入同时期该院精神科抑郁症患者21例。排除年龄<18岁、怀孕、恶性肿瘤、原发性甲状腺疾病或者使用GC或甲状腺激素治疗者及未签署知情同意者,最终纳入受试者142例。
1.2 CS和SCS诊断标准 库欣病(CD)和SCD的诊断标准:(1)典型CS临床表现(满月脸、向心性肥胖、背部颈部脂肪垫、皮肤紫纹、皮肤薄、近端肌病)是诊断CD的必要条件,而SCD的先决条件是无典型的CS临床表现。(2)ACTH和皮质醇的自主或异常分泌,如①血浆ACTH和血清皮质醇水平升高;②LDDST试验中,皮质醇的不完全抑制(CD>5.0μg/dl,SCD>3.0μg/dl);③夜间睡眠期间高皮质醇水平(>5.0μg/dl);④血浆ACTH水平对去氨加压素(DDAVP)有反应。(3)CD和异位ACTH综合征之间的鉴别诊断:①血浆ACTH水平对促肾上腺皮质激素释放激素(CRH)反应正常或增加;②大剂量(8mg)过夜抑制试验,皮质醇受抑制(与基础水平相比降低);③磁共振成像(MRI)提示存在垂体腺瘤;④手术切除组织病理学检查诊断为CD和SCD。肾上腺CS和SCS诊断标准:(1)典型的CS的临床表现是诊断肾上腺CS的先决条件,而SCS缺乏典型的库欣特征。(2)皮质醇的自主或异常分泌,如①血清皮质醇水平升高,ACTH抑制;②LDDST试验,皮质醇不完全抑制(CS>5.0μg/dl,SCS>3.0μg/dl);③大剂量(8mg)过夜抑制实验,皮质醇的不完全抑制(>1.0μg/dl);④夜间睡眠时高皮质醇水平(>5.0μg/dl);⑤低DHEA-S水平;⑥肾上腺皮质闪烁扫描显示受影响的肾上腺侧摄取增加,未受影响侧摄取减少。此外,肾上腺切除术后出现肾上腺皮质功能不全和/或粘连皮质组织萎缩可诊断为肾上腺CS。
1.3 CS的其他筛查试验 通过检测早晨(8∶00~10∶00)和午夜(23∶00~24∶00)的血清TSH和皮质醇水平评估昼夜节律。TSH比值(午夜TSH/早晨TSH)≤1.0提示午夜血清TSH水平分泌峰可能消失。在LDDST中,在23∶00~24∶00之间给予0.5mg(ACTH依赖性)或1mg(ACTH非依赖性)地塞米松,并且在第2天早晨8∶00和9∶00之间测量皮质醇。检测24h UFC。
1.4 实验室检查 血清TSH,皮质醇水平采用电化学发 光 法(Cobas E601,Roche Inc.,Switzerland)。24h尿游离皮质醇水平检测采用电化学发光法(Cobas E601,Roche Inc.,Switzerland)。
1.5 统计学分析 采用SPSS 19.0统计软件。TSH水平总体分布为正偏态。早晨和午夜TSH水平的组间差异比较采用Wilcoxon秩和检验。ROC曲线评估TSH比值诊断灵敏度和特异度。双侧P<0.05为差异有统计学意义。
2 结果
本资料最终纳入受试者142例。其中,22例患者诊断为CS(12例典型CS和10例SCS)。根据CS和SCS的诊断标准,将剩余的120例患者(43例垂体肿瘤患者,48例肾上腺肿瘤患者,13例肥胖患者,3例糖尿病患者和13例抑郁症患者)用于CS的鉴别诊断。2.1 糖皮质激素自主分泌对TSH比值的影响 早晨和午夜血清TSH水平如图1所示。午夜血清TSH水平CS组患者低于非CS组,差异有统计学意义(P<0.001),早晨TSH水平在两组之间差异无统计学意义(P=0.980)。此外,非CS组的早晨TSH水平相对于午夜TSH水平降低,差异有统计学意义(P<0.001)。CS组的早晨TSH水平相对于午夜TSH水平升高,差异有统计学意义(P<0.001)。不同疾病TSH比值如图2所示。CS组患者TSH比值<1.0,非CS组患者TSH比值>1.0,同时,所有抑郁症患者TSH比值均>1.0。提示在非CS组患者中午夜TSH水平出现激增,而CS组患者午夜TSH分泌峰消失。

图1 早晨和午夜血清TSH水平
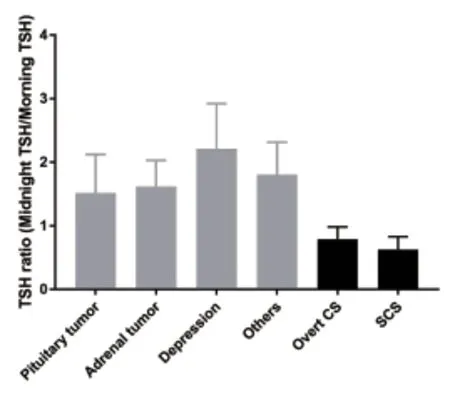
图2 不同疾病TSH比值(午夜TSH/早晨TSH)
2.2 TSH比值与CS筛查经典试验的比较 TSH比值与经典CS筛查试验诊断效能评估如图3所示。TSH比值诊断CS的最佳cutoff值为1.01(灵敏度95.2%,特异性94.2%),但是为方便临床作者选用1.0(灵敏度90.9%,特异性95.0%)为诊断cutoff值。LDDST cutoff值为5.0μg/dl时诊断的灵敏度95.5%,特异性87.2%。LDDST cutoff值为3.0μg/dl时诊断的灵敏度100.0%,特异性80.3%。LDDST cutoff值为1.8μg/dl时诊断的灵敏度100.0%,特异性65.0%。午夜血清皮质醇cutoff值为5.0μg/dl时诊断的灵敏度90.9%,特异性86.7%。24h尿游离皮质醇cutoff值为100μg/24h时诊断的灵敏度34.6%,特异性94.6%。TSH比值诊断的特异性高于LDDST(P<0.05),灵敏度高于24hUFC(P<0.05)。在13例抑郁症患者中,2例患者LDDST为假阳性,1例患者午夜血清皮质醇水平为假阳性。但是,所有TSH比值均为阴性。

图3 ROC曲线对TSH比值和LDDST诊断效能评估
2.3 CYP3A4诱导剂对TSH比值的影响 本资料中,22例患者(CS 5例,非CS 17例)接受了CYP3A4诱导剂药物治疗(12例阿托伐他汀,2例辛伐他汀,2例吡格列酮,3例丙戊酸钠,2例氯硝西泮,1例特比萘芬和1例雌激素)以抑制地塞米松代谢。在非CS患者中,CYP3A4诱导剂药物治疗后LDDST假阳性率高于无CYP3A4诱导剂药物治疗的患者(35.3% VS 17.0%)。但是TSH比值在17例使用CYP3A4诱导剂药物治疗的非CS患者中均为阴性。
3 讨论
本研究目的在于评估血清TSH昼夜节律鉴别诊断CS和SCS的效能。结果提示,TSH昼夜比值对CS和SCS的诊断特异性优于午夜血清皮质醇水平,并与LDDST相当,并且TSH比值的诊断敏感性显著高于UFC。另外,作者发现即使在抑郁症患者和未使用CYP3A4诱导剂的患者中TSH比值也具有较高的诊断准确性和鉴别诊断价值。所以,TSH比值可作为一种新的支持CS诊断方法,与目前CS的诊断方法相比具有更高的特异性。
LDDST,深夜唾液和血液皮质醇和UFC是目前用作CS的初筛项目[4]。目前,现有初筛实验在CS和SCS的诊断中缺乏标准化皮质醇测量方法,同一患者的皮质醇水平在不同的皮质醇检测试剂盒中不同。因此,医生在评估常用的皮质醇水平检测方法时必须注意假阳性的可能性。另一方面,随着现代TSH检测方法的发展,每一代检测方法对TSH功能检测的灵敏度可提高10倍左右[7]。因此,即使TSH在低浓度范围内,也能检测到更可靠的结果。另外,因为TSH比值(午夜TSH/早晨TSH)是一个相对值而不是绝对值,因此,不受TSH检测试剂盒类型的影响。对于假性CS(抑郁症、酗酒、肥胖症、血糖控制不佳糖尿病和极端的身体压力等)采用TSH比值比以往排除CD诊断的方法更简单。
血清TSH浓度存在夜间激增的昼夜节律[5]。TSH的夜间激增在一出生即已存在,与年龄性别无关[8]。TSH夜间激增是随着BMI的增加而延迟释放,随着年龄增加促进释放,但几乎每个人均存在TSH的夜间激增。有研究报道显示,无论是否ACTH依赖性CS患者均不会出现激增的TSH[6],或者高剂量的GC输注(氢化可的松100mg/24h)可完全抑制健康对照组中夜间TSH激增的情况。但本资料结果显示,在有显著临床表现的CS患者和轻度皮质醇增加SCS患者中均未出现夜间TSH激增。原发性甲状腺功能亢进患者和严重的原发性甲状腺功能减退症患者也不存在夜间血清TSH激增。
Yamakita等[9]研究发现特发性孤立性垂体瘤患者中,血清TSH不出现夜间激增,TSH缺乏症患者血清TSH水平<0.20mIU/L。本资料中,6例垂体疾病(2个非功能性腺瘤,2个PRL分泌腺瘤和脊索瘤)中5例患者TSH比值<1。由此,TSH比值可能不适用于严重的TSH缺乏症。癫痫和抑郁症患者夜间TSH水平检测尚存在争议。本研究评估了13例抑郁症的TSH比值与CS组不同且均>1.0。因此,TSH比值有助于CS和假性CS(如抑郁症)的鉴别诊断。
