射干的开花特性及繁育系统研究
2019-09-13蔡兴坤谢国勇秦民坚
许 娜, 蔡兴坤, 田 梅, 谢国勇, 秦民坚
(中国药科大学中药学院 中药资源系, 江苏 南京 211198)
射干〔Belamcandachinensis(Linn.) Redouté〕隶属于鸢尾科(Iridaceae)射干属(BelamcandaAdans.),为多年生草本植物,广泛分布于中国各地,生于林缘或山坡草地,大部分生于海拔较低的地方,但在西南山区可生长于海拔2 000~2 200 m区域。射干具有良好的观赏价值[1]和明确的药理作用(如抗炎、镇痛和抗肿瘤等)[2-5]。近年来,关于射干化学成分分析[6-7]、药理作用[8]和临床应用[9]等方面的研究报道较多,而关于其生物学方面的研究报道却相对较少[10-12],尤其是关于其开花和传粉生物学特性方面的研究报道更少[10,13]。明确射干的开花特性和繁育系统,不但有助于深入了解射干的个体发育规律,而且能够为射干的可持续利用和资源保护等工作提供可靠的数据资料和理论依据,对射干杂交育种工作的开展以及提高射干的繁殖效率、药材产量和质量具有重要意义。
鉴于此,作者对射干的花部特征、开花进程、花粉活力、柱头可授性、繁育系统类型、泌蜜日节律及访花昆虫的传粉行为进行了研究,以期揭示射干花器官对虫媒异花传粉的适应机制,为射干的人工栽培管理和新品种繁育等提供基础资料。
1 材料和方法
1.1 材料
以中国药科大学药用植物园种质资源圃内人工种植5 a的射干居群为研究对象,居群面积约150 m2,共有射干植株850余株。该种质资源圃地理坐标为北纬32°54′37″、东经118°54′39″,海拔12 m,属亚热带季风气候,年平均气温15.7 ℃,年平均降水量1 072.9 mm,年平均日照时数2 017.2 h;土壤类型主要为红棕壤。
1.2 方法
1.2.1 花部特征及开花进程观测 在2018年6月10日,采用五点取样法划分5个面积3 m×3 m的样方,对样方内所有射干植株的花进行仔细观察,记录该居群的花期、单株花期(从第1朵花开放至最后1朵花闭合的天数)和单花花期(从花瓣开始展开至卷曲闭合的时长)。按照以下标准确定开花进程,以样方内10%的射干植株同时开花为始花期,样方内超过50%的射干植株同时开花为盛花期,样方内仅10%以内的射干植株仍在开花为末花期。随机选取20株射干植株,每株选取3枚花,使用游标卡尺(精度0.02 mm)测量花冠直径、外轮花被片的长度和宽度、内轮花被片的长度和宽度、子房长度、雌蕊长度及雄蕊长度。
选取3个即将开放的花蕾,采用常规石蜡切片法[14]54-63制片,分别对石蜡包埋块进行横切和纵切,切片厚度8 μm,经PAS法[14]85-86染色后,使用Eclipse E200光学显微镜(日本尼康公司)观察蜜腺的位置。取射干花瓣基部的蜜腺组织,取样面积1 mm×1 mm,参照李和平[15]的方法依次进行戊二醛固定、锇酸固定、乙醇脱水、乙酸异戊酯替换和干燥,使用导电胶带将干燥后的样品固定在扫描电子显微镜的载物台上,使用SU8010型扫描电子显微镜(日本日立公司)对样品进行观察和拍照。
1.2.2 花粉活力及柱头可授性检测 采用MTT染色法[16]检测花粉活力。在2018年6月11日,随机选取21个次日开放的花蕾,套袋;在开花当天7:00至19:00,每2 h采集1次花粉,每次选取3枚花,经MTT溶液染色5 min后观察花粉粒的着色状况,根据花粉粒着色状况判断花粉活力,花粉粒变为蓝紫色表示有活力。每枚花视为1个重复,每个重复观察3个视野。根据上述实验结果计算花粉活力,计算公式为花粉活力=(视野内染色花粉粒数/视野内花粉粒总数)×100%。
采用联苯胺-过氧化氢法[17]检测柱头可授性。在2018年6月12日7:00至19:00,每2 h取1次柱头,每次选取5枚盛开的花,共选取35枚花。先使用NSZ-608T体视显微镜(南京江南永新光学有限公司)对柱头上腺毛的发育状况进行观察和拍照,再将柱头浸入联苯胺-过氧化氢溶液〔V(质量分数1%联苯胺)∶V(体积分数3%过氧化氢)∶V(蒸馏水)=4∶11∶22〕中,根据柱头染色程度及气泡产生速率判断柱头的可授性。
1.2.3 杂交指数计算 在2018年6月23日11:00至15:00,随机选取30枚盛开的花,测量其花冠直径,按照Dafni[18]的方法计算杂交指数(OCI),并判断射干的繁育系统类型。花冠直径小于等于1.00 mm,记为“0”;花冠直径大于1.00 mm、小于等于2.00 mm,记为“1”;花冠直径大于2.00 mm、小于等于6.00 mm,记为“2”;花冠直径大于6.00 mm,记为“3”。雄蕊与雌蕊同时成熟或雌蕊先熟,记为“0”;雄蕊先熟,记为“1”。柱头与花药等高,记为“0”;柱头与花药在空间上分离,记为“1”。上述3个指标之和即为OCI值。OCI值为0,表示繁育系统为闭花受精;OCI值为1,表示繁育系统为专性自交;OCI值为2,表示繁育系统为兼性自交;OCI值为3,表示繁育系统为自交亲和,有时需要传粉者;OCI值大于等于4,表示繁育系统以异交为主,需要传粉者,并存在部分自交亲和。
1.2.4 花粉/胚珠比统计 在2018年6月24日,随机选取30个次日开放且蕾长基本一致的花蕾,每个花蕾随机选取1枚雄蕊,置于1 mol·L-1HCl溶液中,于60 ℃水浴水解1 h;用蒸馏水将花粉悬浮液定容至10 mL,置于XW-80A旋涡混合器(江苏海门市其林贝尔仪器制造有限公司)中振荡均匀;取10 μL均匀的花粉悬浮液,置于洁净的载玻片上,在Eclipse E200光学显微镜下进行观察,统计10 μL花粉悬浮液中的花粉粒数,计算平均花粉粒数(P),计算公式为P=〔(∑n)/30〕×100,其中,n为10 μL花粉悬浮液中的花粉粒数。
用解剖刀剖开上述花的子房,统计子房内的胚珠数,计算平均胚珠数(O),计算公式为O=(∑m)/30,其中,m为子房内的胚珠数。
根据花粉粒数和胚珠数计算花粉/胚珠比(P/O),计算公式为P/O=平均花粉粒数/平均胚珠数。根据Cruden[19]的标准进行分析,P/O值为2.7~5.4,表示繁育系统为闭花受精;P/O值为18.1~39.0,表示繁育系统为专性自交;P/O值为31.9~396.0,表示繁育系统为兼性自交;P/O值为244.7~2 588.0,表示繁育系统为兼性异交;P/O值为2 108.0~195 525.0,表示繁育系统为专性异交。
1.2.5 授粉试验 在2018年6月28日至7月2日,随机选取270个即将开放且发育正常的花蕾,平均分成9组,分别挂牌并做好标记。在开花前一天17:00至19:00分别对9组花蕾进行不同的授粉试验。其中,T1组花蕾直接套袋;T2组花蕾去雄蕊后套袋;T3组花蕾剥去3枚完整的外轮花被片后套袋,次日除袋后自然授粉;T4组花蕾剥去3枚外轮花被片但保留蜜道后套袋,次日除袋后自然授粉;T5组花蕾剥去全部花被片后套袋,次日除袋后自然授粉;T6组花蕾剥去雄蕊后套袋,次日9:00至11:00自花授粉;T7组花蕾剥去雄蕊后套袋,次日9:00至11:00同株异花授粉;T8组花蕾剥去雄蕊后套袋,次日9:00至11:00异株授粉;T9组花蕾直接套袋,次日除袋后自然授粉,以此组为对照组(CK)。在授粉14 d统计各组的坐果率、种子数和结籽率,计算公式分别为坐果率=(某组的结果总数/30)×100%;种子数=某组所有果实的种子总数/该组结果总数;结籽率=某组所有果实结籽率的总和/该组的结果总数。
1.2.6 泌蜜量和花蜜含糖量测定 在2018年6月27日,随机选取30个次日开放且蕾长基本一致的花蕾,分别挂牌并做好标记,使用40目网袋套袋。在开花当天7:00至19:00,每2 h用内径0.2 mm硬质毛细玻璃管吸取并测定泌蜜量,用游标卡尺测量毛细玻璃管中蜜柱高度(h),计算单花日泌蜜量(v),计算公式为v=πr2h,式中,r为毛细玻璃管的内半径。使用MASTER-500手持式旋光测糖仪(ATAGO中国分公司)测定花蜜含糖量,并记录测量时地表的温度和湿度。
1.2.7 访花昆虫及传粉行为观察 在2018年7月13日至15日,参考Totland等[20]的方法连续3 d观察昆虫的访花情况。在居群中划分面积5 m×5 m的样方,在每天7:00至17:00,每2 h观察并记录1次样方内访花昆虫的种类、数量、单次访花时间和单花访问频率,每次观察10 min。拍照记录不同昆虫的访花行为,并捕捉传粉昆虫制作标本。
在2018年7月13日,随机选取30个次日开放且蕾长基本一致的花蕾,套袋,待开花后除袋,当花被传粉昆虫第1次访问后,立即将柱头置于体积分数50%FAA溶液中固定,使用Eclipse E200光学显微镜统计柱头上的花粉数量(即柱头花粉落置数),每种传粉昆虫重复统计30次。
1.3 数据计算和统计分析
采用SPSS 22.0统计分析软件对实验数据进行统计分析;采用One-way ANOVA法对相关数据进行方差分析,采用Duncan’s新复极差法对相关数据进行多重比较,并对花蜜含糖量与地表温度和地表空气相对湿度的关系进行Pearson相关性分析。
2 结果和分析
2.1 射干的花部特征及开花进程
观察结果显示:射干具顶生复蝎尾状聚伞形花序,花茎呈叉状分枝,顶端聚生数朵花,并沿花序自上而下开放。射干的花被片呈橙至橙红色,散生红褐色斑点;花被管呈圆柱形且极短;花被片6枚,分为2轮,交互排列。花冠呈辐射对称状,直径54.80±4.46 mm;外轮花被片3枚,呈长椭圆形,长31.22±3.16 mm,宽11.60±1.31 mm,花被片距基部约1/3区域为蜜道,呈红褐色;内轮花被片3枚,较外轮花被片略短狭,长28.00±2.56 mm,宽10.46±0.97 mm;雌蕊长22.22±1.60 mm,位于3枚雄蕊的中央位置,花柱分枝稍扁,呈橙色,柱头顶端三裂,裂片边缘略向外反卷,密生短腺毛;雄蕊长20.32±1.68 mm,着生于外轮花被片基部,花药为基生药,位于柱头下方,呈黄色,向外纵裂;子房长9.00±1.16 mm,呈倒卵形,中轴胎座,具3室。
观察和统计结果显示:射干的花期为6月至8月,单株花期为10~30 d,单花花期为12 h,始花期为6月12日至6月21日,盛花期为6月22日至7月15日,末花期为7月16日至8月3日。花冠在7:00左右初开(图1-1),此时花药尚未开裂,柱头已分化出密集的短腺毛;花冠在8:00左右盛开(图1-2),此时花药开裂并开始散粉,雌蕊偏向一侧,距雄蕊约1.5 cm;花冠在16:30至17:00初闭合(图1-3),内轮花被片较外轮花被片先合拢;花冠在18:30至19:00完全闭合(图1-4),柱头萎蔫变软;花冠在次日呈螺旋状卷曲(图1-5)。

1. 初开 Initial opening; 2. 盛开 Blossoming; 3. 初闭合 Initial closing; 4. 完全闭合 Complete closing; 5. 螺旋状卷曲Spiraling.图1 射干的开花进程Fig. 1 Flowering process of Belamcanda chinensis (Linn.) Redouté
观察发现,射干的花具3枚蜜腺,分别位于3枚外轮花被片蜜道的基部,且在蜜道表面可见蜜汁。蜜腺的解剖结构和表面微形态特征观察结果(图2)显示:成熟的蜜腺由分泌表皮、泌蜜组织和维管束组成,其中,泌蜜组织由5~7层薄壁细胞组成,内侧与外轮花被片中的维管束相邻,并且,可见维管束中的筛管分子和导管分子伸入泌蜜组织,说明射干花的蜜腺属于结构型蜜腺;蜜腺的表皮细胞呈柱状,排列紧密,表皮均匀覆盖着1层角质层,经PAS法染色后呈红色,并且,分泌表皮上未见气孔分布;泌蜜组织细胞呈多角状,大小不一,排列较紧密,细胞核明显,原生质浓厚,细胞壁较薄,表面有角质层包被,但在盛花期部分角质层有破损。观察还发现,蜜腺的表皮细胞呈长条状,表面无特殊纹饰。

OP: 外轮花被片 Outer perianth; Ne: 蜜腺 Nectary; An: 花药 Anther; St: 柱头 Stigma; IP: 内轮花被片 Inner perianth; VB: 维管束 Vascular bundle; Cu: 角质层 Cuticula; SG: 淀粉粒 Strach grain; SE: 分泌表皮 Secretory epidermis; NT: 泌蜜组织 Nectariferous tissue; VM: 导管分子 Vessel member; STM: 筛管分子Sieve tube member; NP: 蜜道 Nectar passage; Ho: 蜜汁 Honeydew.1-4. 蜜腺的解剖结构Anatomical structure of nectary: 1. 花蕾横切面 Transverse section of flower bud; 2. 花蕾基部纵切面 Longitudinal section of the bottom of flower bud; 3. 蜜腺横切面 Transverse section of nectary; 4. 蜜腺内维管组织 Vascular tissue in nectary. 5-6. 蜜腺表面微形态特征Surface micro-morphological characteristics of netary: 5. 蜜道 Nectar passage; 6. 蜜腺表面 Nectary surface.图2 射干花蜜腺的解剖结构及表面微形态特征Fig. 2 Anatomical structure and surface micro-morphological characteristics of flower nectary of Belamcanda chinensis (Linn.) Redouté
2.2 射干的花粉活力及柱头可授性
实验结果(表1、图3和图4)表明:射干的花粉在花药尚未散粉时就具有一定的活力,在初开2 h左右(9:00)活力最强,此后活力逐渐下降。射干柱头在花药开裂前(7:00)就具有一定的可授性;在开花后2~4 h(9:00至11:00),柱头的可授性较强,此时,柱头腺毛由疏变密,分泌的粘液也逐渐增多;在开花后6~8 h(13:00至15:00),柱头的可授性最强,此时,柱头腺毛密集,布满粘液;此后柱头可授性随时间推移逐渐下降。比较发现,射干的花粉活力与柱头可授性的变化趋势相似,均随着开花进程先升高后降低,但变化不完全同步,柱头可授性变化滞后于花粉活力变化。
2.3 射干繁育系统类型分析
实验测得射干花冠的平均直径为54.80 mm,远大于6 mm,此项值为3;开花时,柱头与花药空间位置分离,柱头偏向一侧,此项值为1;雄蕊先于雌蕊成熟,此项值为1。根据上述3项值计算得到射干的杂交指数(OCI)为5,根据Dafni[18]的标准,确定射干的繁育系统以异交为主,需要传粉者,并存在部分自交亲和。

时间Time花粉活力/%Pollen viability柱头可授性Stigma receptivity7:0063.5±1.9具一定可授性 A certain receptivity9:0094.9±8.6可授性较强 Stronger receptivity11:0091.3±4.4可授性较强 Stronger receptivity13:0081.7±2.7可授性最强 The strongest receptivity15:0065.3±4.3可授性最强 The strongest receptivity17:0035.8±1.5可授性较强 Stronger receptivity19:0026.6±2.1部分具可授性 Some with receptivity
统计结果显示:射干的平均花粉粒数为47 530.0,平均胚珠数为29.8,花粉/胚珠比(P/O)为1 595.0,根据Cruden[19]的标准,确定射干的繁育系统为兼性异交。

1-3. 解剖观察 Anatomical observation: 1. 尚未成熟的柱头 Immature stigma; 2. 成熟的柱头 Mature stigma; 3. 萎蔫的柱头 Wilting stigma. 4-6. 肉眼观察 Visual inspection: 4. 尚未成熟的柱头 Immature stigma; 5. 成熟的柱头 Mature stigma; 6. 萎蔫的柱头 Wilting stigma.图3 射干开花过程中柱头的形态变化Fig. 3 Morphological changes of stigma of Belamcanda chinensis (Linn.) Redouté during flowering process

1. 具一定可授性的柱头 Stigma with a certain receptivity; 2. 可授性较强的柱头 Stigma with stronger receptivity; 3. 可授性最强的柱头 Stigma with the strongest receptivity; 4. 无可授性的柱头 Stigma without receptivity.图4 射干不同可授性柱头的形态特征Fig. 4 Morphological characteristics of stigma of Belamcanda chinensis (Linn.) Redouté with different receptivities
授粉试验结果(表2)表明:T1组(花蕾直接套袋)和T2组(花蕾去雄蕊后套袋)的坐果率和结籽率均为0.0%,种子数也为0.0,说明若没有传粉昆虫射干无法完成授粉过程,并且实验过程中未发现无融合生殖现象。T3组(花蕾剥去完整外轮花被片后套袋,次日自然授粉)、T4组(花蕾剥去外轮花被片但保留蜜道后套袋,次日自然授粉)和T5组(花蕾剥去全部花被片后套袋,次日自然授粉)的坐果率、种子数和结籽率均无显著差异,但与T9组(花蕾直接套袋,次日自然授粉)相比,坐果率变化不显著,种子数和结籽率则显著下降,说明花被片和蜜道是射干吸引传粉昆虫的重要花部特征。T6组(花蕾剥去雄蕊后套袋,次日自花授粉)、T7组(花蕾剥去雄蕊后套袋,次日同株异花授粉)和T8组(花蕾剥去雄蕊后套袋,次日异株授粉)间的种子数存在显著差异,坐果率分别为36.7%、56.7%和73.3%,种子数分别为15.4、21.8和26.8,结籽率分别为51.7%、73.2%和89.9%;其中,T7组和T8组与T9组的种子数存在显著差异,而T6组与T9组的种子数无显著差异,说明射干的繁育系统以异交为主,并具有一定的自交亲和性。
2.4 射干的泌蜜节律及其访花昆虫的传粉行为分析
统计结果(表3)显示:射干的单花日泌蜜总量为19.2~31.6 μL。射干花的泌蜜量随时间推移呈先升高后降低的日变化趋势,花蜜含糖量在7:00至13:00随时间推移逐渐升高。射干花在7:00已分泌出少量花蜜,但花蜜含糖量较低(18%);在9:00泌蜜量最大(10.3 μL),为泌蜜高峰期;在13:00花蜜含糖量最高(56%);在15:00蜜腺陆续停止泌蜜,花被片上可见蜜痕但无法采集到花蜜;17:00以后彻底停止泌蜜。相关性分析结果显示:射干花蜜含糖量与地表温度呈极显著(P<0.01)正相关,与地表空气相对湿度呈极显著负相关,相关系数分别为0.993和-0.995。


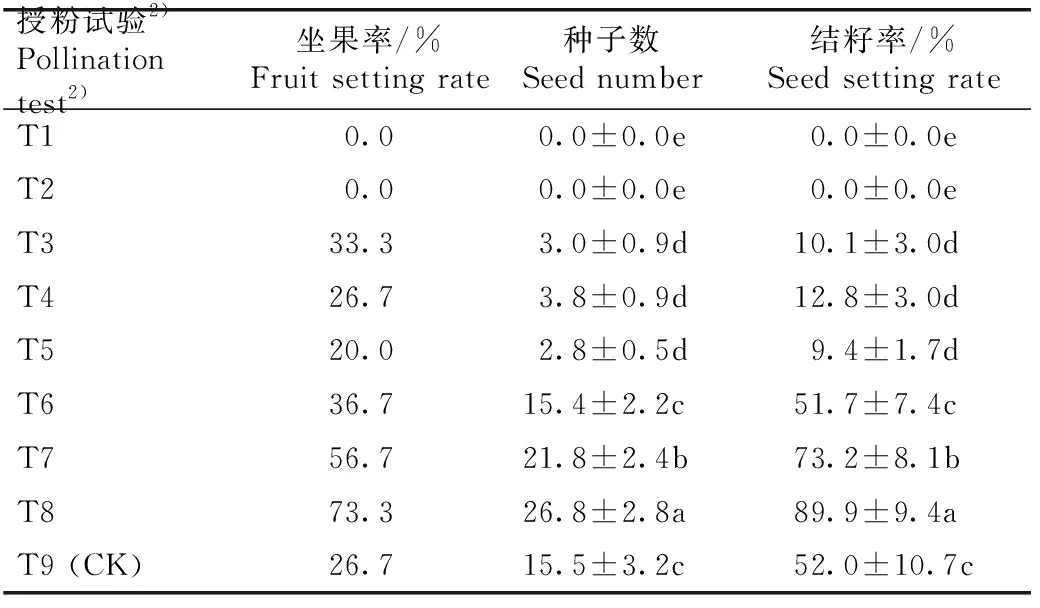
授粉试验2)Pollination test2)坐果率/%Fruit setting rate种子数Seed number结籽率/%Seed setting rateT10.00.0±0.0e0.0±0.0eT20.00.0±0.0e0.0±0.0eT333.33.0±0.9d10.1±3.0dT426.73.8±0.9d12.8±3.0dT520.02.8±0.5d9.4±1.7dT636.715.4±2.2c51.7±7.4cT756.721.8±2.4b73.2±8.1bT873.326.8±2.8a89.9±9.4aT9 (CK)26.715.5±3.2c52.0±10.7c
1)同列中不同小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
2)T1: 花蕾直接套袋 Bagging flower buds directly; T2: 花蕾去雄蕊后套袋 Bagging flower buds after emasculation; T3: 花蕾剥去完整外轮花被片后套袋,次日自然授粉 Bagging flower buds after stripping complete outer perianths, and natural pollination on the next day; T4: 花蕾剥去外轮花被片但保留蜜道后套袋,次日自然授粉 Bagging flower buds after stripping outer perianths but keeping nectar passage, and natural pollination on the next day; T5: 花蕾剥去全部花被片后套袋,次日自然授粉 Bagging flower buds after stripping all perianths, and natural pollination on the next day; T6: 花蕾剥去雄蕊后套袋,次日自花授粉 Bagging flower buds after emasculation, and self-pollination on the next day; T7: 花蕾剥去雄蕊后套袋,次日同株异花授粉 Bagging flower buds after emasculation, and geitonogamy on the next day; T8: 花蕾剥去雄蕊后套袋,次日异株授粉 Bagging flower buds after emasculation, and xenogamy on the next day; T9: 花蕾直接套袋,次日自然授粉 Bagging flower buds directly, and natural pollination on the next day.
观察和统计结果显示:射干的访花昆虫有17种,其中传粉昆虫有5种,隶属于膜翅目(Hymenoptera)和鳞翅目(Lepidoptera)。由表3可见:蜂类的访花次数总体上明显高于蝶类,昆虫日访花总次数呈“双峰型”变化,2个峰值分别出现在9:00和15:00。观察发现,射干花开放后不久(7:00)墨胸胡蜂(VespavelutinanigrithoraxBuysson)和黑带食蚜蝇(EpisyrphusbalteatusDe Geer)首先访花,此时花药尚未开裂,二者的访花报酬仅为含糖量较低的花蜜;9:00,蜂类的访花次数最多,蝶类尚未开始访花;11:00至13:00,由于气温较高(达40 ℃以上),大部分昆虫的活动减少,但开始出现盗蜜类昆虫(如蓟马和蚂蚁等);15:00,传粉昆虫以蝶类为主;17:00以后,随着地表温度的下降,昆虫开始回巢,访花行为逐渐停止。



时间Time泌蜜量/μLNectar volume花蜜含糖量/%2)Sugar content of honey2)访花次数 Flower-visiting times蝶类Butterflies蜂类Bees总计Total7:005.7±1.9b180.0±0.0d11.3±0.5c26.0±2.9c9:0010.3±2.4a310.0±0.0d26.0±2.1a57.0±3.6a11:006.3±1.9b480.0±0.0d14.7±2.0b26.7±4.5c13:002.9±0.6c568.3±0.5b4.0±1.6d23.7±3.7c15:000.2±0.0c—12.3±1.9a0.0±0.0e37.3±9.0b17:000.0±0.0d—1.7±0.5c0.0±0.0e12.6±2.0d19:000.0±0.0d—0.0±0.0d0.0±0.0e0.0±0.0e
1)同列中不同小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
2)—: 花蜜太少,无法测定含糖量 Nectar is not enough for determination of sugar content.
观察和统计结果(表4)表明:中华蜜蜂(ApisceranaceranaFabricius)和意大利蜜蜂(ApismelliferaligusticaSpinola)的单花访问频率和被访花柱头的花粉落置数显著高于其他昆虫,说明二者为射干的高效传粉昆虫,其中,中华蜜蜂和意大利蜜蜂的单次访花时间分别为11.6和10.1 s,单花访问频率分别为2.5和3.8 min-1。东方菜粉蝶(PieriscanidiaSparrman)、丝带凤蝶(SericinusmontelusGrey)和金凤蝶(PapiliomachaonLinn.)的单次访花时间分别为3.5、26.8和24.8 s,单花访问频率分别为0.6、0.2和0.3 min-1,说明这3种昆虫为间断式访花,传粉效率较低。此外,虽然墨胸胡蜂的访花时间较长(7:00至15:00),且单次访花时间长达30.3 s,但虫体不携带射干花粉,因此,墨胸胡蜂是射干的盗蜜者。



传粉昆虫Pollination insect单次访花时间/sSingle flower-visiting time单花访问频率/min-1Visiting frequency of single flower柱头花粉落置数Pollen setting number on stigma中华蜜蜂 Apis cerana cerana11.6±3.7b2.5±0.7b44.2±6.8b意大利蜜蜂 Apis mellifera ligus-tica10.1±2.3b3.8±0.8a62.5±15.3a东方菜粉蝶 Pieris canidia3.5±0.9c0.6±0.1c6.9±1.1d丝带凤蝶 Sericinus montelus26.8±7.0a0.2±0.0d12.1±3.2c金凤蝶 Papilio machaon24.8±3.9a0.3±0.0d15.8±4.8c
1)同列中不同小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference.
3 讨论和结论
植物的花部特征受传粉者、植食性动物及环境因子等多种因子的影响[21],其中传粉者的影响最重要。按照“最有效传粉者原则”[22],植物的花部结构常与其最频繁访问者且最有效传粉者相适应,例如,鸢尾(IristectorumMaxim.)的花药隐藏于花柱之下,并具有垂瓣等花部结构特征,适应于黄胸木蜂(XylocopaappendiculataSmith)等大型昆虫传粉[23]。射干花在早晨开放,颜色艳丽,具有较大的花冠和极短的花被管,花器官结构特化程度较低,花粉量较大,具蜜腺且花被片上具有明显的指向蜜腺的斑点,这些花部特征说明射干为典型的虫媒花。
实验观察发现,射干花具3枚蜜腺,分别位于射干外轮花被片蜜道的基部,与Rudall等[24]的研究结论(射干花的蜜腺位于花被管基部,极有可能位于雄蕊间)不完全一致。但射干的子房心皮完全愈合,说明其蜜腺不属于隔膜蜜腺。Fahn[25]提出蜜腺位置演化的“向心向顶”原则,邓彦斌等[26]提出蜜腺演化方向为维管束从无到有,根据上述观点,认为射干花的蜜腺是一个较为进化的特征。本研究发现,射干花的蜜腺表皮无蜜腺毛等纹饰,结构较为简单,与鸢尾属其他植物的蜜腺[24]相比,射干花的蜜腺属于较原始的类型。另外,根据射干花的蜜腺结构,推测在其泌蜜期间,蜜汁由维管束送至泌蜜组织中,并且,泌蜜组织细胞的角质层突起形成角质层下腔,当压力达到一定程度时,蜜汁经泌蜜组织细胞角质层上的小孔泌出体外。
植物的繁育系统有自交、异交和混交等多种类型,但是大自然中绝对的自交或异交植物很少,多数植物的繁育系统为混交(同时具备自交和异交)[27]。综合P/O值、OCI值及授粉试验结果,认为射干的繁育系统以异交为主,需要传粉者,并存在部分自交亲和;射干可通过雄蕊先熟和柱头探出式雌雄异位等机制,避免自花授粉和性别干扰,增强花粉传递的精确性,从而提高异交的概率。
黄双全等[28]认为,自然界中两性花植物结实率低通常是因为花粉限制、资源限制、传粉昆虫限制等原因。本研究中,T9组(花蕾套袋,次日自然授粉)的结籽率(52.0%)远低于T7组(花蕾去雄蕊后套袋,次日同株异花授粉)和T8组(花蕾去雄蕊后套袋,次日异株授粉)的结籽率(分别为73.2%和89.9%),与T6组(花蕾去雄蕊后套袋,次日自花授粉)的结籽率(51.7%)相近,说明自然状态下射干结籽率与花粉限制及自交不亲和障碍无关。相关研究结果[29-30]表明:鸢尾属植物花部的垂瓣(即特化的外轮花被片)结构能够吸引并引导传粉昆虫进行传粉活动,并保护花粉和蜜腺免遭盗蜜和盗粉昆虫的抢食及雨水的冲刷;并且,鸢尾在剥去垂瓣后无法完成传粉过程,出现生殖隔离现象。本研究中,T3组(花蕾剥去完整外轮花被片后套袋,次日自然授粉)的坐果率为33.3%,说明射干外轮花被片的结构和功能尚未完全特化。T5组(花蕾剥去全部花被片后套袋,次日自然授粉)的坐果率为20.0%,与T9组坐果率(26.7%)接近,但其结籽率(9.4%)却远低于T9组;而T4组(花蕾剥去外轮花被片但保留蜜道后套袋,次日自然授粉)的结籽率(12.8%)与T3组(10.1%)无显著差异,但显著低于T9组,说明射干的花被片和蜜腺能显著影响传粉昆虫的传粉效率,据此推测射干的结籽率可能受传粉者限制,例如,传粉者数量不足以及泛化传粉者带来的其他植物花粉导致胚珠受精率降低等。
根据射干的泌蜜日节律和访花昆虫日活动节律,发现在9:00访花昆虫的访花次数最多,蜂类昆虫的访花次数达到日峰值,此时泌蜜量也最大;而在15:00蜜腺陆续停止泌蜜,因此,无法采集到足够的花蜜用于测量花蜜含糖量,但花蜜含糖量与地表温度呈极显著正相关,与地表空气相对湿度呈极显著负相关;15:00,地表温度为全天最高(44.9 ℃),地表空气相对湿度为全天最低(31%),推测此时花蜜含糖量最高,蝶类传粉活动频繁,说明射干花的泌蜜特征是对不同传粉昆虫活动节律的适应性结果。一般情况下,传粉昆虫的传粉效率不仅取决于柱头花粉落置数,还取决于访花频率等因子,传粉者访问的花越多,植物的结籽率越高。射干的传粉昆虫有5种,分别是中华蜜蜂、意大利蜜蜂、东方菜粉蝶、丝带凤蝶和金凤蝶,根据这些传粉昆虫的单花访问频率和被访花柱头的花粉落置数,判定中华蜜蜂和意大利蜜蜂为射干的高效传粉昆虫。
综上所述,射干花为典型的虫媒花,结籽率受传粉者限制,其花部特征、泌蜜节律和繁育系统等均对传粉昆虫有良好适应性;其繁育系统以异交为主,需要传粉者,并存在部分自交亲和,但未观察到无融合生殖现象。
