与植物抗逆相关的miR-398-3p基因家族进化分析及靶基因预测
2019-09-12薛巨坤王博王莲萍
薛巨坤 王博 王莲萍


摘要:通过生物信息学方法对miR-398-3p基因家族进行序列分析和靶基因预测。结果表明,大部分miR-398-3p基因分布在不同的染色体上,miR-398-3p序列在不同物种间具有高度的保守性。进化分析结果表明,miR-398-3p基因家族的成员呈现为7个分支,个别物种miR-398-3p的不同成员具有较远的亲缘关系;miR-398-3p的靶基因具有超氧化物歧化酶[Cu-Zn]、花粉特异性蛋白质SF3、锌指蛋白WIP2、C2H2型锌指家族蛋白等功能,参与植物的生物和非生物胁迫及生长发育调控过程。
关键词:miR-398-3p;生物信息学;靶基因;植物抗逆
中图分类号:Q7 文献标识码:A
文章编号:0439-8114(2019)14-0141-07
Abstract: In this paper, the miR-398-3p gene family were analyzed by bioinformatics method and the target genes were predicted. The results showed that most miR-398-3p genes were scattered on different chromosomes, and the miR-398-3p sequence was highly conserved among different species. The miR-398-3p gene family showed that the miR-398-3p gene was composed of seven branches, and the different members of miR-398-3p had a distant genetic relationship. The miR-398-3p family regulated superoxide dismutase[Cu-Zn], pollen-specific protein SF3, zinc finger protein WIP2, C2H2 type zinc finger family protein and other respects, were involved in plant biological and abiotic stress and growth and development control process.
Key words: MiR-398-3p; bioinformatics; target gene; plant resistance
微小RNA(miRNA)是一類内源性小RNA(21~24个核苷酸),通过在转录后水平调控基因表达,在植物和动物的发育中起关键作用[1]。成熟的miRNA衍生自单链RNA转录,其含有不完全的茎-环二级结构,其形成并加工成细胞核中的miRNA双链体的发夹结构,然后被转运到细胞质起到一定的作用[2]。成熟的miRNA通过形成miRNA诱导的沉默复合物(miRNA-induced silencing complex,miRISC)与靶标mRNA互补配对结合,并对其进行剪切或抑制翻译,实现对靶标基因的负调控[3]。研究表明,miRNA具有调控生物体生长发育、激素分泌与信号传导以及对外界环境胁迫的应答能力[4]。
近年来,关于miRNA在植物胁迫中的作用机理有一定的研究。陆生植物在生长过程中会遭遇诸多不可预知的环境胁迫,如盐碱、干旱、虫害及病害的侵扰。植物需要启动自身特殊机制来应对这些胁迫,已进化出极为精细复杂的生理和分子调控机制。例如植物自身会调控某些miRNA的生成与表达,通过miRNA作用靶基因在转录和翻译水平调控基因的表达,并通过基因之间的作用,最终抵抗逆境[5]。在已知的众多参与植物抗逆过程的miRNA中,miR398是第一个被发现受逆境胁迫负调控的miRNA,直接与胁迫应答网络相关。miR398在调节植物铜代谢平衡、应答过量的铜、铁、镉等重金属胁迫、蔗糖、臭氧、盐害等其他非生物胁迫,以及病原菌生物胁迫中均扮演重要角色[6]。有研究表明,人参(Panax ginseng C.A.Mey)中miR398在环境胁迫响应中发挥重要作用,通过miR398的表达水平逐步降低,进而提高靶基因CSD的表达水平,可以提高人参应对高盐和高铜环境胁迫的能力[7]。杜驰等[8]研究发现花花柴[Karelinia caspia(Pall.)Less]在盐胁迫过程中,短时间内盐胁迫会导致KcmiR398下降,致使KcCSD1表达量升高以应对盐胁迫。Raja等[9]发现小麦(Triticum
aestivum L.)miRNA的表达水平分别受紫外线辐射、连续光和热的影响,约55%miRNA,包括控制参与信号转导途径和开花活化的miR398、miR528和miR156等下调表达,通过转录后调控,使小麦能够抵抗非生物胁迫,尤其是高温胁迫。Valdés-López等[10]在对菜豆(Phaseolus vulgaris)的研究中发现,由于缺氮或缺铁并且铜的含量增加使得miR398与miR408表达下调,对植物抗逆起调控作用。有研究表明,miR398表达水平降低,而铜锌超氧化物歧化酶水平升高,使葡萄风信子(Muscari botryoides Mill.)和小麦能够抵抗干旱胁迫[11,12];冬小麦的抗寒性是由miR398调控其靶基因CSD而发挥作用[13]。贺晓丽等[14]发现在miR398过表达烟草(Nicotiana tabacum L.)植株中,PR5的表达受到明显的抑制,初步判断二者之间存在负调控关系。由于PR5和CSD均属于抗性基因,会应对各种胁迫,因此番茄(Lycopersicon esculentum Mill)中的miR398下调表达起到抗逆作用。Lu等[15]发现高温可以诱导拟南芥[Arabidopsis thaliana(L.)Heynh]miR398表达,使其靶基因CSD2下调表达,通过热诱导型miR398对CSD2的下调是拟南芥热应激反应基因表达和耐热性所必需的,使拟南芥更加耐高温。颜秦峰等[16]通过构建miR398过表达的转基因烟草,在分子水平上对其抗旱性进行研究,通过转miR398b T1代植株,在干旱条件下发现烟草的抗旱性增加,说明了miR398的表达促进了植物的抗旱作用。Guo等[17]研究发现了椪柑(Citrus reticulata Blanco cv.Ponkan)cre-miR398b和cre-CSD的表达呈现负相关,表明miR398b对CSD的调控在体外保护椪柑中起重要作用。植物通过miR398的上调表达或下调表达对其抗逆进行调控。研究不同植物中miR398的表达情况与抗逆的关系,对于植物抗逆调控机理研究具有重要的意义。
本研究利用生物信息学方法检测了miR-398-3p在不同物种中的基因组定位情况并对其基因家族成员进行同源性和靶基因预测分析,为进一步研究miR-398-3p靶基因的功能和相关抗逆机制提供了重要的理论基础。
1 材料与方法
1.1 miR-398-3p序列检索及分析
从miRBase(http://www.mirbase.org/)网站获取31种植物的58条miR-398-3p基因成熟序列。
1.2 miR-398-3p基因家族成员的多序列比对及保守位点分析
利用在线工具Clustalw(http://www.genome.jp/tools/clustalw/)对miR-398-3p基因家族的成熟序列进行多序列比对和分析。
1.3 miR-398-3p基因家族成员系统进化树的构建
利用MEGA5.1软件构建miR-398-3p基因家族成员的成熟序列系统进化树。
1.4 miR-398-3p靶基因的预测
以gma-miR-398(双子叶植物大豆)和ghr-miR-398(双子叶植物陆地棉)为研究对象利用psRNATarget(http://plantgrn.noble.org/v1_psRNATarget/)和BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)软件在线预测miR-398-3p靶基因。
2 结果与分析
2.1 miR-398-3p基因家族及在基因组中的定位分析
利用生物信息学方法,在miRBase数据库中在线检索所有物种中的miR-398-3p,结果见表1。由表1可知,31个植物物种中存在miR-398-3p,大部分miR-398-3p基因分散在不同的染色體上,也有少部分miR-398-3p基因位于同一染色体上,如ath-miR398b、ath-miR398c、mtr-miR398a-3p、mtr-miR398b成熟序列分别位于拟南芥和蒺藜苜蓿的5号染色体上,vvi-miR398b和vvi-miR398c成熟序列都位于葡萄6号染色体上。此外,火炬松、南欧丹参、刺菜蓟、无油樟、白菜、花生、小麦、陆地棉、甜橙、向日葵、烟草、高粱、甘蓝miR-398-3p基因家族成员都只有1个拷贝,其余的都是多拷贝,如拟南芥miR-398-3p基因家族成员有3个拷贝、水稻miR-398-3p基因家族成员有2个拷贝。
2.2 miR-398-3p基因家族序列分析
利用在线工具Clustalw对miR-398-3p家族进行成熟序列的比对,结果见图1。由图1可知,31个物种miR-398-3p成熟序列的相似度较高,保守序列为UGUUCAGGUCCCCC。在碱基方面,仅有ssl-miR-398、lus-miR398d、lus-miR398e、ppe-miR398b的一个碱基由U变成了C,火炬松的两个碱基由UC变成了CA,ahy-miR398、lus-miR398c缺失了一个碱基U,这些可能由于进化过程中的基因突变问题导致。在位置方面,白菜、节节麦的miR-398-3p基因保守序列均位于35个碱基处;向日葵和陆地棉的miR-398-3p基因保守序列位于68~84位的14个碱基处,其余的物种miR-398-3p基因保守序列位于100~150个碱基处,表明miR-398-3p在不同物种间具有高度的保守性,但碱基的位置有一定差异。
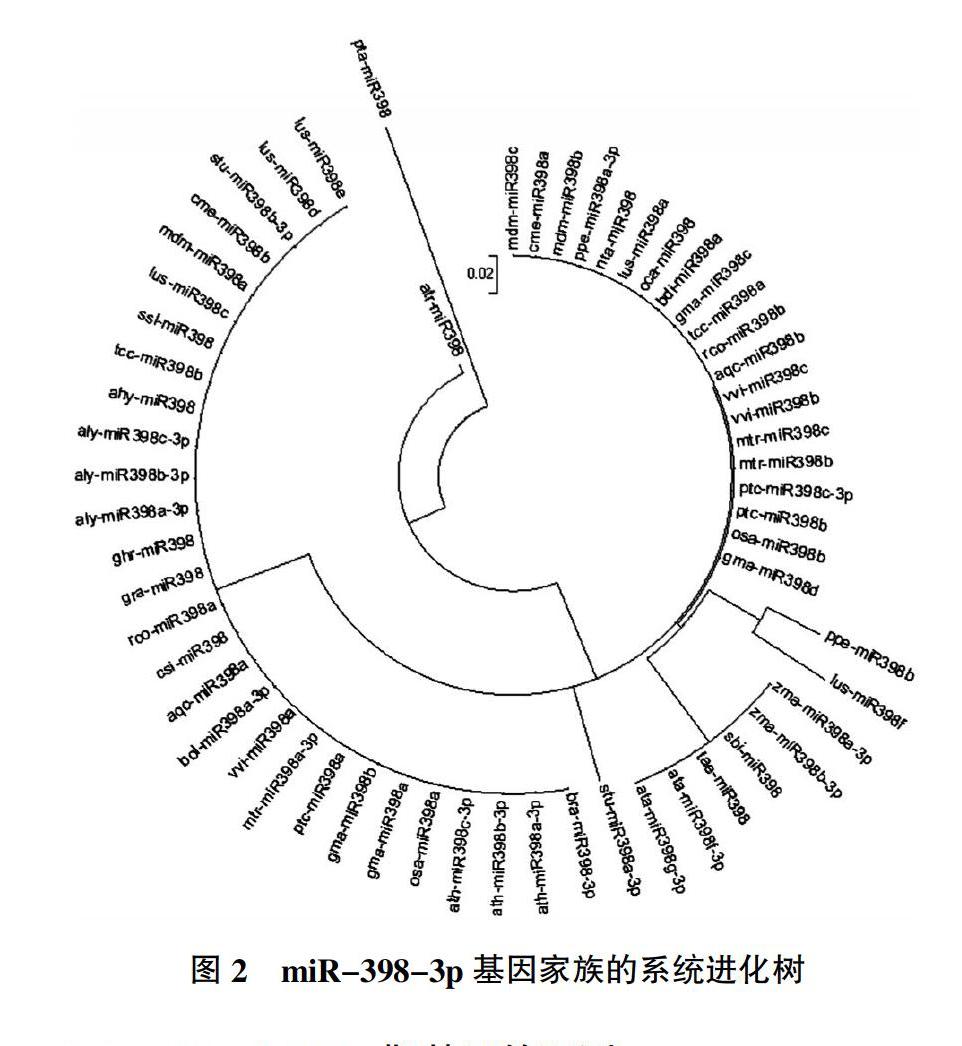
2.3 miR-398-3p基因家族系统进化树的分析
利用MEGA5.1软件采用邻接法对miR-398-3p基因家族成员构建系统进化树,进行分子进化规律的研究,结果见图2。由图2可知,miR-398-3p基因家族的成员呈现7个分支。31个物种先由火炬松pta-miR398产生为两大分支,无油樟atr-miR398单独分支,而剩下的物种进一步分为5个分支。无油樟的成熟序列miR-398-3p与其他物种的成熟序列miR-398-3p存在一个碱基的差异,导致了无油樟在进化方面也与其他物种属于不同的分支。而马铃薯stu-miR398a基因,不是聚在某几个分支,而是分散在整个进化树中,是一个单独的分支,与其他stu-miR398基因家族成员的亲缘关系较远。这说明miRNA基因可能存在特殊的进化机制,需要进一步研究。
2.4 miR-398-3p靶基因的预测
大豆含miR-398-3p基因拷贝数比较多,陆地棉miR-398-3p是单拷贝,二者是比较常见的物种。两种植物都属于双子叶植物,利用这两个物种的miR-398-3p进行靶基因预测,有利于对miR-398-3p基因家族的靶基因进行较详细全面的分析。利用在线软件psRNATarget和BLAST进行miR-398-3p的靶基因预测,结果见表2。从表2可以看出,miR-398-3p基因家族靶基因的功能涉及范围较广,有zf-C2H2_4结构域蛋白、C2H2型锌指家族蛋白、超氧化物歧化酶[Cu-Zn]、花粉特异性蛋白质SF3、锌指蛋白WIP2、GATA型锌指转录因子家族等。在同一物种中,不同种类的miR-398-3p靶基因具有相同的功能,如大豆中靶基因TC421780和TC423529都具有花粉特异性蛋白SF3的功能;在不同物种中miR-398-3p的靶基因也具有相同的功能,如大豆的靶基因TC452415,陆地棉的靶基因TC267083,都具有Cu-Zn超氧化物歧化酶和超氧化物歧化酶的功能,说明miR-398-3p基因家族不仅序列在物种间高度保守, 有些靶基因功能也较保守。也有少数miR-398-3p的靶基因功能表现出物种特异性, 如GATA型锌指转录因子家族即为miR-398-3p在陆地棉中特有的靶基因。miR-398-3p的靶基因具有花粉特异性蛋白SF3、超氧化物歧化酶、铜锌超氧化物歧化酶等功能,这些基因影响植物的生长发育,并在植物应对在非生物和生物胁迫中产生氧化应激作用,说明miR-398-3p在植物中有广泛的调控功能。
3 讨论
miR398可以参与植物的抗逆过程,在盐碱、干旱、重金属等环境下参与相关的调控,在不同植物的抗逆过程中起到了不同的作用。如Guan等[18]通过研究发现在拟南芥中成熟的miR398表达受热胁迫诱导,通过靶基因(CSD1、CSD2和CCS)下调表达,抵御热胁迫。研究发现在N缺乏时,拟南芥中的miR398被抑制来抵抗缺N的胁迫[19]。超氧化物歧化酶(SOD)在几乎所有细胞中的抗氧化防御中起重要作用,并且被推测与植物对生物和非生物胁迫(如干旱、盐、重金属和病原体攻击)的抗性密切相关[20]。在木薯(Manihot esculenta crantz)中,由于氧化损伤造成的环境胁迫,转基因木薯显示细胞溶质Cu/Zn SOD和过氧化物酶体CAT1表达增加,表现出抗其他非生物胁迫的抗性[21]。此外还发现一些miRNA受胁迫上调或下调,意味着它们可以在植物对非生物和生物胁迫的抗性中起重要作用,如在缺水的条件下,豌豆(Pisum sativum Linn)根和芽中miR398a/b表达下调,其潜在的靶基因超氧化物歧化酶(CSD1)的上调表达,在豌豆抵抗缺水胁迫反应中起作用[22]。并且miR398在一些豆类植物中也能够起到抗逆的作用,如miR398b介导的CSD和Nod19的上调表达与常见的豆类植物在对在非生物和生物胁迫中产生的氧化应激反应相关[23]。Chen等[24]研究发现,在转基因拟南芥中miR398下调表达,两个靶基因CSD1和CSD2分别上调表达,提高了拟南芥冷冻耐受性。此外miR398可以调控PetE2基因将3种主要叶绿体铜蛋白、质体蛋白、CCS1和Csd2的表达与拟南芥体内铜水平联系起来[25]。植物在某种矿物质营养物质缺乏时,其他营养物质的代谢将被调整以保持适当的生长发育。研究表明,在拟南芥中,铜(Cu)缺乏诱导miR397、miR398、miR408和miR857表達并调控铜蛋白的下调表达来抵御营养素不平衡的胁迫[26]。上述研究均表明,miR398大多通过调控其靶基因CSD1、CSD、CCS1等的表达对植物抗逆起重要作用。通过软件也预测到了miR-398-3p的靶基因具有铜锌超氧化物歧化酶、SOD等的功能,与植物抗逆相关。此外,Chen等[27]研究发现在玉米种子萌发过程中miR398上调表达,说明miR398在种子萌发和植物生命周期中起关键作用;也预测到了miR-398-3p的靶基因也具有花粉特异性蛋白SF3的功能,说明miR-398-3p可能参与植物的生长发育调控过程,关于发育相关的miR-398-3p靶基因功能还需要进一步研究。
4 结论
本研究通过生物信息学方法发现31种植物中存在miR-398-3p序列,大部分miR-398-3p基因分散在不同的染色体上,也有少部分miR-398-3p基因位于同一染色体上,miR-398-3p序列在不同物种间具有高度的保守性,但碱基位置有一定差异。进化分析表明,miR-398-3p基因家族的成员呈现7个分支,个别物种miR-398-3p的不同成员具有较远的亲缘关系;靶基因预测表明,miR-398-3p的靶基因具有超氧化物歧化酶[Cu-Zn]、锌指蛋白WIP2、C2H2型锌指家族蛋白、花粉特异性蛋白质SF3等功能。
参考文献:
[1] BOUCH? N.New insights into miR398 functions in Arabidopsis[J].Plant signaling & behavior,2010,5(6):684-686.
[2] EAMENS A L,AGIUS C,SMITH N A,et al. Efficient silencing of endogenous microRNAs using artificial microRNAs in Arabidopsis thaliana[J].Mol Plant,2011,4(1):157-170.
[3] 刘 萌,周晓阳.miRNA在调节植物抗逆等生理功能中的作用[J].山东林业科技,2011(2):102-105.
[4] 马圣运,白 玉,韩 凝,等.miRNA生物合成及其功能研究的新发现[J].遗传,2012,34(4):383-388.
[5] 曾幼玲,杨瑞瑞.植物miRNA的生物学特性及在环境胁迫中的作用[J].中国农业科学,2016,49(19):3671-3682.
[6] 丁艳菲,王光钺,傅亚萍,等.miR398在植物逆境胁迫应答中的作用[J].遗传,2010,32(2):129-134.
[7] 李躬军.MiR398在人参高盐、高铜胁迫中的调控作用[D].长春:吉林大学,2016.
[8] 杜 驰,廖茂森,张 霞,等.盐胁迫下花花柴miR398对Cu/Zn超氧化物歧化酶基因的调控研究[J].西北植物学报,2014,34(4):682-688.
[9] RAJA R,SRIDHAR M D,SAFIUR R M,et al.Deep sequencing of wheat sRNA transcriptome reveals distinct temporal expression pattern of miRNAs in response to heat,light and UV[J].Scientific reports,2016,6(39373):1-15.
[10] VALD?S-L?PEZ O,YANG S S,APARICIO-FABRE R,et al. MicroRNA expression profile in common bean(Phaseolus vulgaris) undernutrient deficiency stresses and manganese toxicity[J].New phytologist,2010,187(3):805-818.
[11] VALLABHI G,KETAN P,NGLE S,et al.Analysis of biochemical variations and microRNA expression in wild (Ipomoea campanulata) and cultivated (Jacquemontia pentantha) species exposed to in vivo water stress[J].Physiol Mol Biol Plants,2014,20(1):57-67.
[12] AMANDEEP K,OM PRAKESH G,NAND L M,et al. Comparative temporal expression analysis of MicroRNAs and their target genes in contrasting wheat genotypes during osmotic stress[J].Appl Biochem Biotechnol,2017,181(2):613-626.
[13] 梅 琳.冬小麥抗寒相关4种miRNAs的克隆及表达特征分析[D].哈尔滨:东北农业大学,2016.
[14] 贺晓丽,刘 萍,栾雨时.番茄MIR398基因的克隆及其在烟草中的表达分析[J].植物生理学报,2015, 51(12):2163-2168.
[15] LU X,GUAN Q,ZHU J. Downregulation of CSD2 by a heat-inducible miR398 is required for thertnotolerance in Arabidopsis[J].Plant signaling & behavior,2013,8(8):e24952.
[16] 颜秦峰,李科友,石振楠,等.过表达miR398对烟草抗旱性的影响[J].北方园艺,2013(13):111-116.
[17] GUO R,CHEN X,LIN Y,et al.Identification of novel and conserved miRNAs in leaves of in vitro grown citrus reticulata "Lugan" plantlets by solexa sequencing[J].Front Plant Sci,2015,6:1212.
[18] GUAN Q,LU X,ZENG H,et al.Heat stress induction of miR398 triggers a regulatory loop that iscritical for thermo tolerance in Arabidopsis[J].The plant journal,2013,74(5):840-851.
[19] LIANG G,HE H,YU D Q.Identification of nitrogen starvation-responsive MicroRNAs in Arabidopsis thaliana[J].PLoS One,2012,7(11):e48951.
[20] WANG X,ZHANG H,GAO Y,et al.Characterization of Cu/Zn-SOD enzyme activities and gene expression in soybean under low nitrogen stress[J].J Sci Food Agric,2016,96(8):2692-2697.
[21] XU J,DUAN X G,YANG J,et al.Coupled expression of Cu/Zn-superoxide dismutase and catalase in cassava improves tolerance against cold and drought stresses[J].Plant signaling & behavior,2013,8(6):e24525.
[22] JOVANOVI [C] ?,STANISAVLJEVI [C] N,MIKI [C] A,et al.Water deficit down-regulates miR398 and miR408 in pea (Pisum sativum L.)[J].Physiol Biochem,2014,83:26-31.
[23] NAYA L,PAUL S,VALD?S-L?PEZ O,et al.Regulation of copper homeostasis and biotic interactions by MicroRNA 398b in common bean[J].PLoS One,2014,9(1):e84416.
[24] CHEN Y,JIANG J,SONG A,et al.Ambient temperature enhanced freezing tolerance of Chrysanthemum dichrum CdICE1 Arabidopsis via miR398[J].BMC biology,2013,11:121.
[25] JUSZCZAK I,BAIER M.The strength of the miR398-Csd2-CCS1 regulon is subject to naturalvariation in Arabidopsis thaliana[J].FEBS letters,2012,586(19):3385-3390.
[26] LIANG G,AI Q,YU D q.Uncovering miRNAs involved in crosstalk between nutrient deficiencies in Arabidopsis[J].Scientific reports,2015,5:11813.
[27] CHEN T T,ZHANG H,JIANG C,et al.Deep sequencing of maize small RNAs reveals a diverse set of MicroRNA in dry and imbibed seeds[J].PLoS One,2013,8(1):e55107.
