烤烟根际土壤微生物对根系酚酸类物质的响应
2019-09-12刘艳霞江小龙石俊雄
刘艳霞,李 雨,李 想*,江小龙,张 恒,石俊雄
(1 贵州省烟草科学研究院,贵阳 550000;2 江苏中烟工业有限责任公司,南京 210019;3 云南农业大学,昆明 650000)
酚酸类物质是根系分泌物中最主要的功能物质,对植物的自毒作用也是导致连作障碍发生的重要因素[1]。烟草连作导致根系分泌物在土壤中不断积累,对烟株和土壤微生物产生化感作用[2],烤烟连作土壤细菌群落丰富度指数等均低于轮作土壤,变异系数高于轮作,说明连作降低了土壤细菌群落丰富度和多样性[3],根系分泌物中主要物质对土壤微生物区系的影响同样需要进一步摸索研究。以往对土壤微生物区系的研究采用平板培养和变性凝胶梯度电泳(DGGE) 方法,平板培养法能够培养的土壤微生物只占微生物总量的0.1%~1%,因此常规分离培养方法难以全面评估其中微生物群体多样性[4],而DGGE方法仅能分析有限的优势微生物类群,存在高估物种丰度以及低估微生物群落大小和多样性的可能[5]。随着DNA测序技术的进步,新一代高通量测序技术由于具有灵敏度高、可靠性强等优点,可以对土壤微生物群落的数量和种类进行测定,成为研究土壤微生物的重要手段[6]。随着MiSeq平台双端PE250和PE300测序策略的发展,读长不断增长,使得基于MiSeq测序研究物种多样性的准确性大幅度提高[7]。利用MiSeq平台对16S rDNA 的一个或多个高变区测序,具有测序深度高、利于鉴定低丰度群落物种以及费用低的特点,已成为研究微生物群落多样性的首选之策[8]。
荧光定量PCR技术为快速、准确和灵敏地定量监测土壤微生物提供了一种有效手段[9]。Leonardo 等应用荧光定量PCR建立了土传真菌Phytophthora nicotianae,Phytophthora citrophthora,Rosellinia necatrix及Verticillium dahliae的定量监测体系用于土传病害的预防与治理[10]。张鹏等[11]利用实时荧光定量PCR方法定量研究根际土壤微生物中青枯病原菌和功能菌群的数量,探索田间条件下连作番茄和辣椒施用生物有机肥和常规施肥间土壤微生物差异。前期试验分离、鉴定出的烟草根系分泌物中主要酚酸类物质苯甲酸和3-苯丙酸,当土壤外源添加3 μg/kg土的苯甲酸或8 μg/kg土的3-苯丙酸时,土壤微生物功能多样性降低[13]。本研究通过向植烟土壤中添加外源酚酸类物质模拟烟草连作土壤,探讨烟草连作土壤根际微生物区系的变化,为寻找克服烟草连作障碍的有效方法提供理论依据。
1 材料与方法
1.1 试剂与仪器
荧光定量PCR试剂盒SYBR®Premix Ex TaqTM、DNA Marker DL2000均购自Takara生物技术公司。DNA凝胶回收试剂盒购自中国杭州爱思进生物技术有限公司,土壤DNA提取试剂盒购自OMEGA生物技术公司。其它试剂均为进口或国产分析纯。
所用主要仪器:荧光定量PCR仪 (美国Applied Biosystems StepOneTMReal-Time PCR System)、N a n o D r o p 2 0 0 0超微量分光光度计 (美国NanoDrop公司)、台式离心机 (SANYO Co.)、THZC恒温振荡器 (江苏太仓实验设备厂)、Centrifuge 5804R冷冻离心机 (Eppendorf Co.)、S1000TMThermal Cycler(Bio-Rad Laboratories Co.)、成像系统 (Bio-Rad Laboratories Co.)。
1.2 外源酚酸类物质的土壤培育
将超高压液相色谱-飞行时间质谱仪UPLC-QTOF/MS中分离、鉴定的主要酚酸类物质,通过外源添加的方式研究其对烟草根际微生物区系的影响。土壤取自贵州省福泉市龙昌镇青枯病发病烟田,海拔1034 m,总碳20.03 g/kg、总氮2.20 g/kg、速效钾0.25 g/kg、速效磷54.37 mg/kg、pH 5.38,茄科劳尔氏菌经检测为3.33 × 106cfu/g土。将实验室分离、筛选的短短芽孢杆菌接种于牛肉膏蛋白胨培养基中[12],30℃、170 r/m振荡培养48 h。将发酵液6000 g离心10 min,收集菌体重悬于灭菌水中,以1.00 ×107cfu/g土 浓度接种于病土中。共设置4个处理:以向土壤中加入等量灭菌去离子水为对照 (T0);苯甲酸浓度调整至3 μg/kg土处理[13](T1);3-苯丙酸浓度调整至8 μg/kg土处理 (T2);同时向土壤中添加苯甲酸和3-苯丙酸,且苯甲酸浓度为3 μg/kg土,3-苯丙酸浓度为8 μg/kg土处理 (T3)。每盆装10 kg土,每处理5次重复。将土壤置于恒温培养箱中在28℃和60 % 相对湿度下培养30 d。
1.3 土壤样品采集及DNA提取
将上述盆栽中培育的土壤混匀,获得5个平行土样,土壤DNA采用Soil DNA Isolation Kit (Omega)提取,用琼脂糖凝胶电泳检测DNA的纯度和浓度,无菌水稀释样品至1 ng/μL。
1.4 土壤微生物区系的高通量测序
以515F-806R引物扩增16S rRNA基因的V4区,使用 NEB Next®UltraTMDNA Library Prep Kit for Illumina建库试剂盒进行文库的构建,经过Qubit定量和文库检测合格后,使用MiSeq进行上机测序。
对测序原始数据进行拼接、过滤,得到有效数据。然后基于有效数据进行Operational Taxonomic Units (OTUs)(97%一致性) 聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析,计算unweighted unifra得到的矩阵,进一步用于PCoA统计比较分析。
1.5 功能微生物荧光定量PCR方法建立与数量监测
茄科劳尔氏菌和短短芽孢杆菌由本实验室分离来自贵州省植烟土壤。采用SMSA选择性培养基[14]分离茄科劳尔氏菌。对拮抗菌短短芽孢杆菌的离体分离、筛选根据Liu 等[15]的实验方法进行,根据其拮抗能力 (平板拮抗圈11 mm) 和拮抗稳定性等特性筛选到高效拮抗菌短短芽孢杆菌备用。
固氮菌、无机磷细菌、硅酸盐细菌、细菌,真菌的基因片段由特异性引物从土壤DNA中扩增获得。以样品DNA作为扩增模板,分别用茄科劳尔氏菌、短短芽孢杆菌、固氮菌、无机磷细菌、硅酸盐细菌、细菌和真菌等的特异性引物 (表1) 在荧光定量PCR仪上进行扩增反应。
NanoDrop 2000超微量分光光度计检测质粒浓度和纯度,将阳性质粒依次稀释10倍,形成8个浓度梯度,每个梯度3次重复,最后选取扩增效率高的5~6个梯度用于标准曲线的制备。阴性对照以无菌超纯水代替。
茄科劳尔氏菌采用TaKaRa公司的实时荧光PCR试剂盒SYBR®Premix Ex TaqTM在ABI StepOneTM实时荧光定量PCR检测仪上运行,扩增反应体系为20 μL,SYBR®PremixEx TaqTM(2 ×)10 μL,ROX Reference Dye(50 ×)0.4 μL,上下游引物 (10 mmol/L)各 0.4 μL,DNA 模板 2 μL,双蒸水 6.8 μL。

表1 功能微生物特异性引物Table 1 List of specific primers of functional microorganisms
固氮菌、无机磷细菌、硅酸盐细菌、细菌、真菌以及短短芽孢杆菌采用TaKaRa公司的实时荧光PCR 试剂盒 SYBR®Premix Ex TaqTM在 ABI 7500TM实时荧光定量PCR检测仪上运行,扩增反应体系为50 μL,SYBR®Premix Ex TaqTM(2 ×)25 μL,ROX Reference Dye II(50 ×)1 μL,上下游引物 (10 mmol/L)各 1 μL,DNA 模板 4 μL,双蒸水 18 μL。
反应程序:95℃ 10 s,95℃ 5 s,60℃(根据各自引物最佳退火温度设定)30 s,72℃ 30 s,40个循环。最后添加熔解曲线步骤:95℃ 15 s,60℃ 1 min,95℃ 15 s,反应结束后确认扩增曲线和熔解曲线。
经构建,劳尔氏菌标准曲线方程为Y = -3.564X +38.744,短短芽孢杆菌标准曲线方程为Y = -3.322X +37.209,固氮菌标准曲线方程为Y = -3.359X +43.219,无机磷细菌标准曲线方程为Y = -3.396X +43.604,硅酸盐细菌标准曲线方程为Y = -1.113X +39.461,细菌标准曲线方程为Y = -3.308X +40.029,真菌标准曲线方程为Y = -3.268 X + 39.562。样品DNA采用与标准曲线建立时相同程序,记录每个样品的Ct值,并将Ct值代入标准曲线方程,计算出样品模板的初始基因拷贝数,最终换算出每克干土的功能微生物的基因拷贝数。其中,短短芽孢杆菌在土壤中的数量为接种后土壤与未接种短短芽孢杆菌土壤扩增后的差值。
1.6 数据分析
试验数据采用Excel 2003、SPSS 13.0和Design-Expert 8.0软件进行统计分析,土壤中功能微生物数量采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 添加外源苯甲酸和3-苯丙酸后根际病原菌与拮抗菌的动态变化
添加外源酚酸后,茄科劳尔氏菌的数量显著增加,而短短芽孢杆菌数量显著降低 (表2)。移栽10、20和30 d时土壤中添加3 μg/kg苯甲酸,茄科劳尔氏菌数量分别为对照的2.08、5.40和2.26倍,而短短芽孢杆菌数量分别为对照的78.32%、63.04%和62.55%;土壤中添加3-苯丙酸8 μg/kg ,茄科劳尔氏菌数量分别比对照增加0.35、0.71和0.90倍,而短短芽孢杆菌数量分别比对照降低42.46%、50.47%和59.29%;土壤同时添加苯甲酸和3-苯丙酸对茄科劳尔氏菌数量的增加程度或对拮抗菌数量的降低程度都显著高于单独添加某一种酚酸。
2.2 添加外源苯甲酸和3-苯丙酸对根际功能微生物数量影响
添加外源酚酸后,固氮菌、无机磷细菌、硅酸盐细菌的数量都呈下降趋势。其中,当土壤中添加苯甲酸3 μg/kg土时,无机磷细菌和细菌数量下降一个数量级;当土壤中添加 3-苯丙酸8 μg/kg土的时,除无机磷细菌,其它菌株数量与土壤中添加苯甲酸3 μg/kg土的处理间无显著差异。当土壤中同时添加苯甲酸和3-苯丙酸后,细菌、真菌、固氮菌、无机磷细菌和硅酸盐细菌的数量的降低程度都显著高于单独添加某一种酚酸的处理,固氮菌、无机磷细菌、硅酸盐细菌分别比对照减少48.1%、85.6%和82.5%(表 3)。
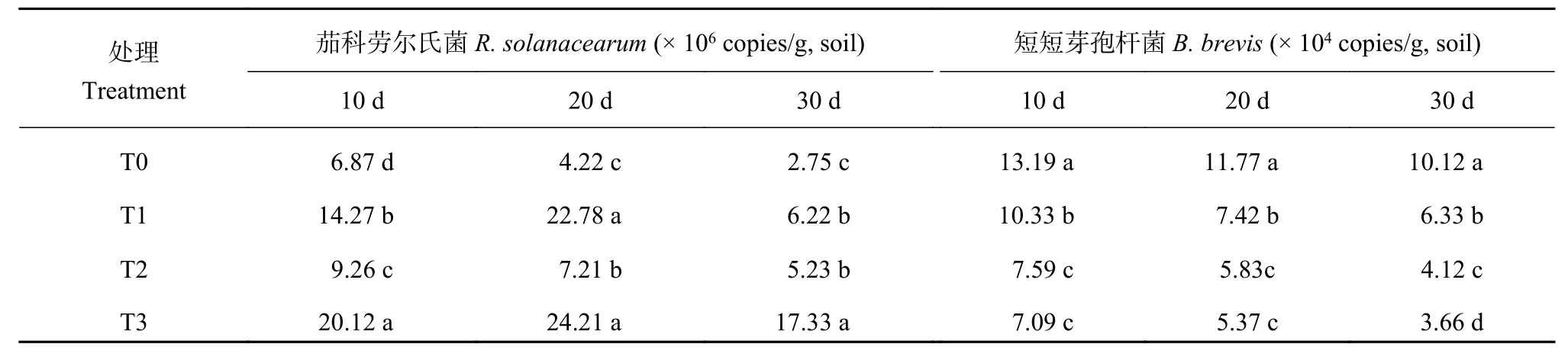
表2 处理10、20和30天土壤病原菌与拮抗菌数量Table 2 Population of pathogen and antagonist in soils treated for 10, 20 and 30 days with different phenolic acids treatments
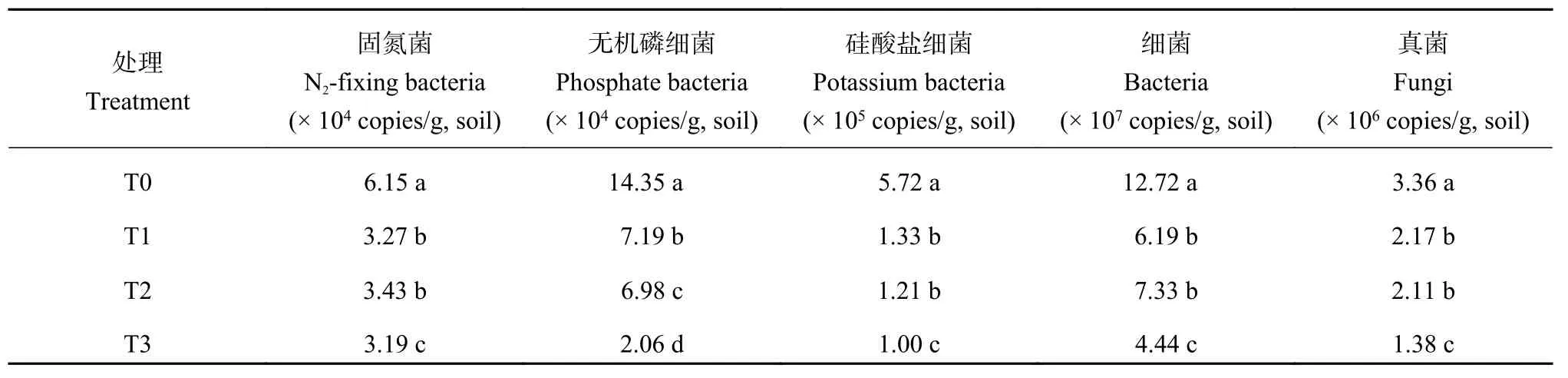
表3 不同处理土壤功能微生物基因拷贝数 (copies/g, soil)Table 3 Gene copies of functional microorganisms in soils added with different phenolic acids
2.3 添加外源苯甲酸和3-苯丙酸对根际微生物区系的影响
2.3.1 OTUs (operational taxonomic units) 从图1可以看出,当土壤中外源添加酚酸时,根际反映菌群多样性的OTUs显著少于对照。使用3 μg/kg土的苯甲酸和8 μg/kg土浓度的3-苯丙酸后,土壤中OTUs分别比对照土壤降低21.5%和17.0%。同时添加两种酚酸处理的T3中OTUs值低于单独添加,比T1和T2分别减少44和324。
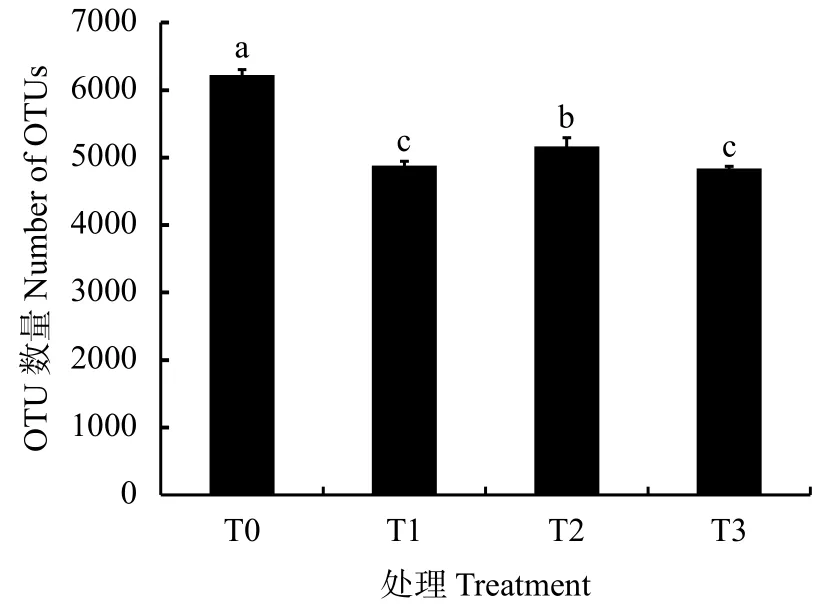
图 1 不同处理的OTU数量Fig. 1 Operational taxonomic units (OTU) in different treatments
2.3.2 物种丰度水平 从不同处理土壤微生物物种丰度水平上看 (图2),不同处理间的微生物属水平分布差异显著。T1处理的Flavisolibacter、Candidatus_Koribacter、Candidatus_Nitrososphaera、Chitinophaga和Burkholderia、DA101等六个属为丰度水平较高的种群,而Steroidobacter和Candidatus Solibacter等属相对丰度水平较低。T2处理中Opitutus、Phenylobacterium和Rhodanobacter等属于相对优势种群,Rhodoplanes和Candidatus_Koribacter等属相对丰度较低。而同时添加苯甲酸和3-苯丙酸的 T3处理Pirellula、Gemmata、Planctomyces、Luteolibacter、Flavobacterium和Bradyrhizobium等明显增多,丰度水平较高的种群明显多于单独添加的处理T1和T2,在所有处理中优势种群最多。对照T0相对丰度水平高的种属较少,只有Janthinobacterium、Agrobacterium和Niastella三个属显著高于其它处理,微生物种属之间丰度差异较小,分布水平相近,整体微生物群落处于平衡、均匀的状态。
2.3.3 分类水平构成 由图3可以看出,不同处理的土壤中微生物门水平物种丰度差异显著。T0处理的酸杆菌门 (Acidobacteria) 和芽单胞菌门(Gemmatimonadetes) 的微生物相对丰度最高,变形菌门 (Proteobacteria) 相对丰度最低,放线菌门(Actinobacteria) 相对丰度明显高于其它处理。T3处理泉古菌门 (Crenarchaeota) 相对丰度明显小于其它处理,而拟杆菌门 (Bacteroidetes) 在所有处理中最高。T2 处理的酸杆菌门 (Acidobacteria) 和变形菌门(Proteobacteria) 相对丰度在所有处理中最高,而拟杆菌门 (Bacteroidetes) 最低。T1、T2和T3处理的硝化螺旋菌门 (Nitrospira) 均高于对照T0。
2.3.4 主坐标分析 对Beta多样性进行主坐标分析PCoA (Primcipal co-ordinates analysis) 后,四个处理间土壤微生物群落组成都不同 (图4),置于四个区间。T2和T3处理均处在上半部,T0和T1处理处于下半部,但T0与T1、T2和T3处理之间关系较为疏远。
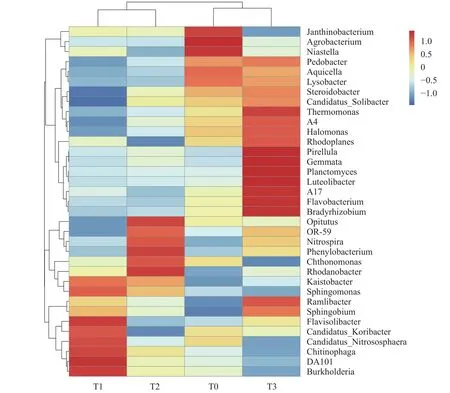
图 2 不同处理微生物种丰度分布树图Fig. 2 Cluster tree of genus abundance in different treatments
2.3.5 处理间聚类分析 以UPGMA(Unweighted Pair Group Method with Arithmetic Mean,算术平均无权重对群法) 为聚类方法,通过对样品门水平物种相对丰度整合进行聚类分析,研究物种组成的相似性。T2和T3的聚类关系较近,而T1与各处理的聚类关系最远 (图5)。
3 讨论
根系分泌物的有机物中,可溶性物质主要包括碳水化合物、氨基酸和有机酸,其可供植物吸收利用和促进土壤中难溶物质活化为有效态。天然化合物中的肽、维生素、核苷、脂肪酸和酶类等,可为根际微区中的土壤微生物提供能源。根系还能分泌对植物有抑制作用的物质,如酚类化合物、苯甲酸和阿魏酸等[23]。根系分泌物通过分泌多种多样的物质对根际周围的微生物群落进行调控[24],因此不同种类的微生物对根系分泌物表现出不同的根际效应,例如,西瓜根系分泌物能够显著增加枯萎病病原菌孢子萌发的数量并增强其繁殖能力[25],大豆连作土壤中的酚酸类物质能够显著促进尖孢镰刀菌等三种病原菌的生长繁殖[26],番茄根系分泌物中主要成分柠檬酸和苹果酸能够诱导根际促生菌荧光假单胞杆菌(Pseudomonas fluorescens) 定殖,增加其在根际的数量[27]。同时,根系分泌物通过改变根际环境,如pH、氧化还原电位等间接地影响根际微生物的类型和数量,此外,微生物间也存在着相互作用,包括有益的或拮抗的作用,这些差异又直接影响了根际微生物的种类和数量[28]。本研究表明,烟草根系分泌物中一定浓度的苯甲酸对烟草青枯病病原菌具有促进作用同时对拮抗菌生长却起到抑制作用,与前期研究结果一致[29]。

图 3 不同处理门水平上土壤物种相对丰度柱形图Fig. 3 Phylum relative abundance in soil under different treatments
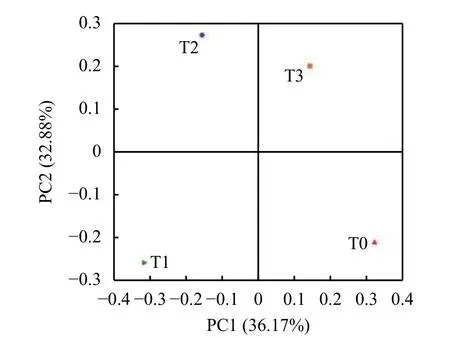
图 4 不同处理土壤Beta多样性主坐标分析Fig. 4 Principal co-ordinates (PCoA) analysis of Beta diversity in soils under different treatments
根系分泌物对土壤中的微生物群落结构具有较强的影响作用。有研究表明,随着烟草根系分泌物持续增加,能够显著影响土壤细菌、真菌和放线菌的种群数量,并改变土壤细菌的群落结构,可降低放线菌门 (Actinobacteria) 数量,增加酸杆菌门(Acidobacteria) 菌群的比例。在不同分类水平上进行差异比较分析,随着根系分泌物添加次数的增加,鞘脂单胞菌科 (Sphingomonadaceae) 相对丰度逐渐降低,酸杆菌科 (Acidobacteriaceae) 呈现逐渐增加的趋势;而芽单胞菌属 (Gemmatimonas) 比例在处理7 d后达到最高,而之后显著降低。进一步对细菌群落进行LEfSe (LDA effect size)分析发现,随着根系分泌物添加次数与培养时间的增加,土壤微生物中优势微生物种群呈现先上升后下降的趋势[30]。

图 5 不同处理UPGMA聚类树Fig. 5 UPGMA cluster tree of different treatments
本研究中,外源添加2种酚酸后的土壤中变形菌 (Proteobacteria) 相对丰度明显高于对照土壤,可能与变形菌的r-生长策略有关,即大部分变形菌生长速度较快,能广泛利用各种根际分泌物[31]。同时添加两种酚酸后,土壤微生物区系与对照土壤微生物区系聚类关系近于分别单独添加酚酸处理,可能由于单一的根系分泌物能够引起根际微生物连锁有关[32]。一般认为根系分泌物对作物本身具有化感自毒作用,但本试验发现对照土壤中的土壤杆菌属(Agrobacterium) 优势度较高,而Rhodanobacter明显低于酚酸添加土壤,据报道Agrobacterium具有一定的解磷作用[33],Rhodanobacter则与促生作用密切相关[34],该结果表明苯甲酸和3-苯丙酸加入土壤后由于整体OTU数量的减少,解磷微生物群落相对减少,根际促生菌群落相对增多,2种酚酸是否具有促生作用还有待进一步探索。
土壤功能微生物是指在土壤中具有特定生物学功能的微生物集合群,这种分类与生物分类学原则无关,只是它的生物功能相同或相近,如固氮微生物、解磷微生物、氨化微生物及纤维素降解微生物等。不同根系分泌物决定了土壤中功能微生物的差异。Kuikman等[35]比较了施用不同数量的NH4NO3两个土壤的根际微生物对不同有机物分解利用的情况,发现施氮量高的土壤,微生物偏嗜利用根系分泌物,而对土壤中原有机质或残茬的分解作用降低,而施氮量低的土壤则不产生这种偏嗜性。同样的,不同植物和不同种类的根系分泌物对相应的功能微生物具有质和量的差异,有些根系分泌物能够促进亚硝酸菌属 (Nitrosomonas) 和硝化细菌(Nitrobacteria) 数量的增加,而有些根系分泌物却不利于它们的生长,甚至产生抑制效果[36]。当根系分泌物中存在高量的有效碳化合物和低量的化合氮 (C/N比值大) 时,土壤中非共生固氮微生物例如固氮菌属Azotobacter、氮单胞菌属Azomonas、拜叶林克氏菌属Beijerinckia、固氮螺菌属Azospirillum、核菌属Clostridium等活性增强[37]。在小麦的生长发育过程中,随根系分泌物的增加,根际环境中反硝化细菌数量明显增加,说明根系分泌物的增加,为根际土壤中反硝化细菌的发育创造了良好的生态环境,根系分泌物还能刺激反硝化细菌的代谢活动。根系分泌物的浓度对土壤微生物生长速率影响具有差异,凤眼莲根系分泌物对细菌降酚酶活性影响表现出低浓度促进、高浓度抑制的规律[38]。
本研究的功能微生物着重在固氮菌、无机磷细菌和硅酸盐细菌,这三类微生物能够使土壤中难矿化的氮、磷、钾分别转化为有效形态。本研究表明,添加两种酚酸后这三类微生物数量也明显低于对照,说明两种酚酸对土壤的有效态营养具有负效应作用。
4 结论
连作烟草根系分泌物中两种主要酚酸类物质苯甲酸和3-苯丙酸的积累导致土壤根际微生物多样性
和结构平衡性降低,病原菌数量显著提高,拮抗菌、固氮菌、无机磷细菌、硅酸盐细菌、细菌和真菌数量显著减少。烟草移栽10、20和30 天后,含有苯甲酸3 μg/kg的土壤中茄科劳尔氏菌数量是非连作土壤的2.08、5.40和2.26倍,含有8 μg/kg 3-苯丙酸的土壤中该细菌数量分别是对照土壤的0.35、0.71和0.90倍,同时含有这2种酚酸的副作用更加显著。
