根除幽门螺杆菌对萎缩性胃炎患者血清学指标的影响
2019-09-11刘德地王亚雷
刘德地,王亚雷,张 磊
胃癌(gastric cancer,GC)是常见恶性肿瘤,其缓慢地演变为GC的防治提供契机。根据Correa假说,在GC病因作用下,胃黏膜由慢性非萎缩性胃炎可逐步进展为慢性萎缩性胃炎(chronic atrophic gastritis,CAG)(包括萎缩、肠化)、上皮内瘤变及肠型GC[1]。而幽门螺杆菌(Helicobacterpylori,HP)既是CAG最常见病因,也是GC Ⅰ类致癌因子,根除HP可降低GC的患病率[2]。胃镜及病理可诊断萎缩、肠化、上皮内瘤变,但胃镜的侵入性等因素限制了胃镜用于监测GC风险,而血清学指标可避免此影响,初筛异常者可进一步行胃镜及病理学检查。该文采用前瞻性研究,观察CAG在根除HP前后血清胃蛋白酶原(pepsinogen,PG)及促胃液素- 17(gastrin- 17,G- 17)的变化,与OLGA分期和OLGIM分期进行比较,以探讨血清学指标在CAG治疗随访中的临床意义。
1 材料与方法
1.1 病例资料选取2014年11月~2017年11月因上腹部不适症状就诊于安徽医科大学第一附属医院消化内科门诊患者为研究对象。通过问卷方式,记录研究对象的一般资料,包括姓名、性别、年龄和联系电话。
1.1.1纳入标准 同意进行血清学检查、胃镜、病理学检查及HP检测;年龄≥18岁。
1.1.2排除标准 消化性溃疡、消化道出血、胃肿瘤及胃手术史;4周内服用抑酸药物、胃黏膜保护药物、抗菌药物;长期口服抗凝药物、非甾体类抗炎药物;严重的心、肺、肝、肾脏等疾病。
1.2 胃镜和取材胃镜检查者需空腹8 h以上,由经验丰富的内镜医师进行胃镜(XQ260型胃镜仪,日本Olympus公司)检查,取材5块胃黏膜进行病理学检查,包括胃窦2块(距幽门2~3 cm处大弯侧和小弯侧)、胃角1块和胃体2块(距贲门8 cm处大弯侧,距离贲门4 cm处小弯侧),若胃镜下发现胃黏膜病变部位可酌情增加取材数量[3]。取材后立即将标本放入装有10%中性福尔马林固定液(合肥新标志科技有限公司)的瓶中,分别在瓶身标明取材的部位及数量。
1.3 病理学检查经2位胃肠病理学专家进行读片,并且各自作出病理学诊断,若两份病理学诊断存在明显差异,则协同第3位病理学专家经过讨论后作出最终诊断。
1.3.1萎缩和肠化的分级 胃黏膜取材确保能观察到黏膜肌层,根据直观模拟评分法(visual analogus scale,VAS)[3],观察萎缩和肠化(intestinal metaplasia,IM)的改变,并根据病变严重程度分为无、轻度、中度和重度4个等级。
1.3.2上皮内瘤变分级 上皮内瘤变(intraepithelial neoplasia,IN)分为高级别IN和低级别IN[4]。
1.3.3OLGA分期和OLGIM分期系统 OLGA分期[5]和OLGIM分期[6]的分级系统是由国际萎缩研究小组提出,该分期系统结合了病理诊断的严重程度和病变累及范围,分别对萎缩和IM进一步分期分级,分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期5个等级。
1.4 血清学检查所有血清学检查者均需空腹8 h以上,静脉采血5 ml于促凝管中,离心后通过酶联免疫吸附试验(芬兰Biohit公司)检测血清PG和G- 17水平,血清PG包括PGI和PGII,并计算血清胃蛋白酶原Ⅰ/Ⅱ比值 (pepsinogen ratio,PGR)。
1.5 HP的诊断研究对象在空腹状态下,口服14C标记的尿素胶囊(深圳中核海得威生物科技有限公司)20 min后进行尿素酶呼气试验,阳性结果为每分钟衰变(disintegrations per minute,DPM)值≥100,或者进行胃镜检查时胃窦部取材1块,通过快速尿素酶试验(珠海克迪科技开发有限公司)检测HP。上述2种检查方式中,有1项及以上阳性则可诊断为HP阳性[7]。
1.6 根除HP菌及复查方案明确HP阳性者,口服四联药物根除治疗共14 d,药物剂量和用法如下[7]:阿莫西林胶囊(珠海联邦制药股份有限公司)1.0 g/次,每天2次,阿莫西林过敏者调整药物为呋喃唑酮片(襄汾云鹏制药有限公司)0.1 g/次,每天2次;克拉霉素缓释片(连云港恒瑞医药股份有限公司)0.5g /次,每天2次;胶体果胶铋胶囊(晋中振东安特生物制药有限公司)0.2 g/次,每天2次;艾司奥美拉唑(英国阿斯利康制药有限公司)20 mg/次,每天2次;根除治疗结束4周后复查HP,通过14C尿素酶呼气试验检查,若DPM值<100则根除HP成功。
1.7 随访方案以成功根除HP的CAG患者为随访研究对象,根除治疗6个月和12个月后进行随访复查,复查的内容包括血清学指标水平、14C尿素酶呼气试验、胃镜及病理学检查。

2 结果
2.1 一般情况根除HP治疗6个月后完成复查的有36例,包括女12例,男24例,年龄为35~74(53.83±10.56)岁;根除治疗12个月后完成复查的有51例,包括女21例,男30例,年龄为35~72(52.24±10.41)岁。
2.2 根除HP治疗后6个月的随访结果
2.2.1血清学指标水平 CAG患者在成功根除HP 6个月后,血清G- 17水平下降,而血清PGI、PGII以及PGR水平在根除治疗前后的变化差异无统计学意义(P>0.05),见表1。

表1 HP成功根除6个月后血清学指标变化
2.2.2萎缩、IM和IN的变化 在成功根除HP 6个月后,萎缩、IM以及IN在所有随访对象中所占比例的变化均无统计学意义(P>0.05)。见表2。

表2 HP成功根除6个月后萎缩、IM和IN的变化[n(%)]
2.2.3OLGA分期的变化 在成功根除HP 6个月后,Ⅲ期患者在所有随访的CAG患者中的所占比例较根除治疗前下降,其余各期变化均无统计学意义(P>0.05)。见表3。

表3 成功根除HP 6个月后OLGA分期的变化
* 卡方检验计算N×N表格时N必须大于1
2.2.4OLGIM分期的变化 在成功根除HP 6个月后,所有随访的CAG患者在各期中的分布变化均无统计学意义(P>0.05)。见表4。
2.3 根除HP治疗后12个月的随访结果
2.3.1血清学指标水平的变化 在成功根除HP 12个月后,CAG患者的血清PGR水平较根除治疗前上升,而血清G- 17水平较治疗前下降,其余血清学指标水平在根除治疗前后的变化差异无统计学意义(P>0.05)。见表5。
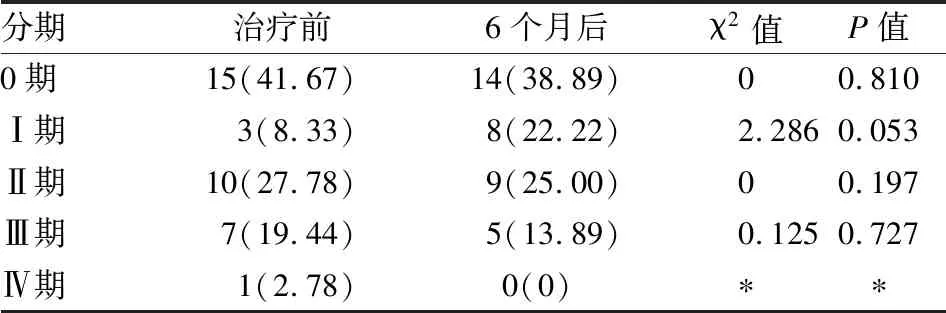
表4 成功根除HP 6个月后OLGIM分期的变化[n(%)]
*卡方检验计算N×N表格时N必须大于1

表5 HP治疗12个月后血清学指标的变化
2.3.2萎缩、IM、IN的变化 在成功根除HP 12个月后,萎缩在所有随访对象中所占比例减少,而IM和IN在治疗前后的变化无统计学意义(P>0.05)。见表6。

表6 HP治疗12个月后萎缩、IM和IN的变化[n(%)]
2.3.3OLGA分期的变化 在成功根除HP 12个月后,0期患者较根除治疗前增加,其余各期差异无统计学意义(P>0.05)。见表7。

表7 HP治疗12个月后OLGA分期的变化[n(%)]
2.3.4OLGIM分期的变化 在成功根除HP 12个月后,Ⅰ期患者较根除治疗前增加,其余各期变化无统计学意义(P>0.05)。见表8。
3 讨论
我国是GC高患病率和高死亡率的国家[8],而且,GC发生风险也是随着萎缩、IM、IN等胃癌前病变的逐步进展呈现逐步升高的趋势[9],基于GC缓慢地多步骤发展的过程,监测和防治胃癌前病变的发生发展是保障我国公民的身体健康和生命安全的重要手段。目前临床上识别胃癌前病变的主要方法是胃镜及病理学检查,我国的共识意见中明确指出了OLGA分期、OLGIM分期中的高危分期(Ⅲ期、Ⅳ期)是GC发生的高危人群[3],国外研究也建议Ⅲ期和Ⅳ期的高危人群定期进行内镜及病理随访[10],以便于早发现、早诊断和早治疗,降低GC的发生风险。除此之外,血清学指标中的PG和G- 17也是临床上评估GC发生风险的重要方法之一,国内外研究[11-12]显示血清PGR水平与OLGA分期呈负相关,比值越低,OLGA分期越高,前期研究[13]显示血清G- 17水平在OLGIM分期中的Ⅱ期就出现降低趋势。因此,定期检测血清学指标变化、复查胃镜及病理学检查是GC风险分层管理的重要方法,而根除HP是降低GC的患病率和病死率的关键。

表8 HP治疗12个月后OLGIM分期的变化[n(%)]
*卡方检验计算N×N表格时N必须大于1
本研究通过随访观察CAG患者,在根除HP前后病理学检查的变化,发现在根除治疗结束6个月后OLGA分期中的高危分期(Ⅲ期)患者减少,治疗结束12个月的OLGA分期中的低危分期(0期)患者增加,有部分萎缩消失,由此可见,GC发生风险在HP根除治疗后降低,而且证明了部分萎缩在去除病因后可逆转消失。与此同时,血清PGR水平在根除HP之后也出现了上升,进一步证实了血清PGR水平与OLGA分期呈负相关的既往研究结论。此外还发现,在HP根除后,虽然OLGIM分期中的低危分期(Ⅰ期)患者增加,IM严重程度有所减轻,但IM未出现逆转消失,同时血清G- 17水平也仍处于较低水平,再次说明血清G- 17水平与IM呈现一致性变化,回顾性研究与前瞻性研究结论一致。由于HP的根除使萎缩得到好转,胃酸分泌功能得到改善,胃酸的增加反馈性抑制胃黏膜G- 17的分泌释放,所以在HP根除治疗后血清G- 17水平较治疗前进一步下降。由此可见,在HP根除治疗后,血清学指标水平发生了与病理学结果一致的变化。
综上所述,去除病因后IM虽仍然持续存在,但萎缩可逆转消失,积极根除HP可以有效地降低GC的发生风险,与目前公认结论一致。同时还发现血清学指标在GC发生风险降低的同时也出现了一致性变化,尤其是血清PGR和G- 17水平,可以避免胃镜及病理学检查的限制因素,有利于监测GC发生风险的变化。
