奥希替尼联合槲皮素对H1975细胞增殖的协同抑制作用
2019-09-11李蔷薇潘跃银
刘 伟,李蔷薇,王 静,潘跃银
我国肺癌的发病率和死亡率在所有癌症中位居第一位,而其中非小细胞肺癌(non- small cell lung cancer,NSCLC)所占比例最多,约为80%~85%[1-2]。腺癌约占非小细胞肺癌的55%左右,其最常见的肿瘤驱动基因是表皮生长因子受体(epidermal growth factor receptor,EGFR)基因敏感性突变[3]。约65%EGFR突变的肺腺癌患者使用第一代EGFR酪氨酸激酶抑制剂(EGFR- tyrosine kinase inhibitors,EGFR- TKIs)10~14个月后出现继发性耐药[4]。因T790M突变导致耐药的患者改用第三代EGFR- TKI奥希替尼(osimertinib)后无进展生存期也仅为8~18个月,最终仍不可避免出现耐药[5]。
天然类黄酮槲皮素(quercetin)所具有的抗肿瘤特性已受到研究人员的关注和认可[6]。第一代EGFR- TKI吉非替尼联合槲皮素表现出显著的协同抗肿瘤作用[7]。该研究的目的是探讨奥希替尼与槲皮素联合使用后对NCI- H1975细胞增殖以及凋亡潜在的作用机制。
1 材料与方法
1.1 主要材料H1975细胞株由广东省肺癌研究所无偿馈赠。奥希替尼购自英国Astra Zeneca公司;槲皮素、二甲基亚砜(DMSO)购于美国Sigma公司;MTT、ECL检测试剂盒及BCA蛋白浓度测定试剂盒、兔抗人β- actin多克隆抗体及辣根过氧化物酶标记的山羊抗兔IgG(即二抗)购于北京索莱宝公司;RPMI- 1640培养液购自美国HyClone公司;Annexin V- FITC/PI双染细胞凋亡检测试剂盒购于南京建成公司;胎牛血清(FBS)、青链霉素混合液、SDS- PAGE凝胶快速配制试剂盒和RIPA裂解液均购自北京碧云天生物公司;兔抗人磷酸化Akt(p- Akt)单克隆抗体、兔抗人Bax单克隆抗体、兔抗人Bcl- 2单克隆抗体、兔抗人蛋白激酶B(Akt)多克隆抗体购自于英国abcam公司。
1.2 药物配制与保存RPMI- 1640培养液按10%FBS的体积分数、1×105U/L青霉素、1×105μg/L链霉素浓度配制保存于4 ℃冰箱。奥希替尼用PBS溶解,而槲皮素则用DMSO溶解,置于-20 ℃冰箱中保存。使用时,根据所需实验浓度用培养液予以稀释,且DMSO最终的体积浓度需<0.1%。
1.3 细胞培养H1975细胞置于RPMI- 1640新鲜培养基中,保存于37 ℃ CO2培养箱内。H1975细胞的传代时间为48~72 h,取对数生长期的培养细胞用于实验。
1.4 使用MTT法检测奥希替尼联合槲皮素对H1975细胞增殖的影响将H1975细胞消化混匀接种于96孔板(各孔细胞数5×103),培养箱中培养24 h;用PBS将奥希替尼稀释成2.625、5.25、10.5、21、42、84 μmol/L浓度梯度组,同样用DMSO分别将槲皮素稀释成15.625、31.25、62.5、125、250、500 mmol/L浓度梯度组。再用RPMI- 1640培养基按1 ∶1 000分别稀释各浓度组的奥希替尼至终浓度为2.625、5.25、10.5、21、42、84 nmol/L、各浓度组的槲皮素至终浓度为15.625、31.25、62.5、125、250、500 μmol/L。同时将各浓度组的奥希替尼和槲皮素在同一管中稀释1 000倍,即为奥希替尼和槲皮素联合组。将原孔培养基弃去,3块96孔板分别加入稀释后的奥希替尼、槲皮素及两药联合组,每个稀释度设置6个复孔,并相应设置 PBS和DMSO对照组以及空白对照组。CO2培养箱培养72 h后,每孔加入10 μl MTT(5 g/L)溶液。细胞在培养箱中孵育4 h后,使用1 ml注射器小心吸走各孔中的上清液,每孔加入100 μl DMSO(200 μl/孔),摇床摇动15 min。使用酶标仪读取各孔的吸光度(optical density,OD)值,根据OD值计算可得出奥希替尼及槲皮素对细胞的抑制率。利用GraphPad Prism5软件计算两药半数抑制浓度(half inhibitory concentration,IC50),使用Compu Syn软件计算两药联合指数(CI)值。
1.5 流式细胞仪检测奥希替尼联合槲皮素对NCI- H1975细胞整体凋亡的影响根据以上MTT检测得出的结果,将奥希替尼、槲皮素稀释至22 nmol/L和110 μmol/L,然后将H1975细胞分成4组:空白对照组、22 nmol/L 奥希替尼组、110 μmol/L槲皮素组、22 nmol/L奥希替尼+110 μmol/L槲皮素联合组,将各组药物加入6孔板中(每孔细胞数为1×106个)。处理72 h后进行细胞凋亡检测,将6孔板中的各组细胞培养液吸出至合适离心管内,使用PBS液轻轻洗涤贴壁细胞2次,最后使用不含EDTA的胰蛋白酶消化细胞。待细胞消化下来后,使用吸管将细胞加入此前收集细胞培养液的离心管内,稍稍混匀,离心后收集细胞沉淀,用PBS液轻轻使细胞重悬后计数; 取5×105个重悬的细胞,1 000 r/min离心5 min,弃上清液,接种至新的6孔板中。各孔加入500 μl AnnexinⅤ- FITC/ PI凋亡检测试剂盒中的结合液,轻轻使细胞重悬; 再加入5 μl Annexin V- FITC,轻轻混匀;最后加入5 μl碘化丙啶,再次混匀。随后在室温下将细胞用铝箔包裹避光孵育10 min,然后应用流式细胞仪检测,待检测完成后使用 FlowJo7.6.1 软件分析出各分组细胞的凋亡率。
1.6 蛋白免疫印迹法检测奥希替尼联合槲皮素作用后对 H1975细胞中 p- Akt、Bcl- 2及Bax蛋白表达的影响收集22 nmol/L 奥希替尼、110 μmol/L 槲皮素、22 nmol/L奥希替尼+110 μmol/L 槲皮素作用72 h后细胞,以及空白对照组细胞进行Western blot检测。步骤如下:将细胞消化,离心5 min收集细胞;用PBS液轻轻洗涤细胞2次,再次离心收集细胞沉淀;每管细胞沉淀加入100 μl RIPA(含1 mmol PMSF);将细胞吹匀,放置于冰上裂解30 min,在此期间每5 min将细胞上下颠倒操作1次,收集上清液即为裂解后蛋白液;BCA蛋白浓度测定试剂盒测定各蛋白质的浓度后沸水煮15 min,低温高速离心机离心10 min(12 000 r/min)。将各待测样品加入8%~10%SDS- PAGE凝胶中电泳,然后冰浴下转膜,接着在室温条件下用5%脱脂奶粉将转好的膜封闭2 h。加入按合适比例的抗体稀释,其中anti- Bax按1 ∶3 000稀释;anti- Bcl- 2按1 ∶1 000稀释;anti- Akt按1 ∶3 000稀释;anti- p- Akt按1 ∶5 000稀释;anti- β- actin按1 ∶2 000稀释。放置于4 ℃冰箱过夜,然后使用TBST液清洗3次,每隔10 min洗1次,之后加入二抗,抗体稀释度为1 ∶3 000,室温孵育约1 h,再次TBST液涮洗5次,每10 min洗1次。避光显影后使用Image J软件分析待测蛋白的灰度值。

2 结果
2.1 奥希替尼联合槲皮素作用对H1975细胞的增殖抑制效应MTT结果显示,作用72 h后,奥希替尼和槲皮素对H1975细胞的IC50值分别为(21.54±1.05) nmol/L和(109.7±1.08)μmol/L,细胞增殖的抑制率随着药物浓度的增加而增高,不同浓度的药物对细胞抑制率的差异有统计学意义(F=59.34、101.25,P<0.01)(图1)。 经过计算,不同浓度的奥希替尼联合槲皮素处理组CI值均<1,显示出明确的协同抑制作用(图2)。
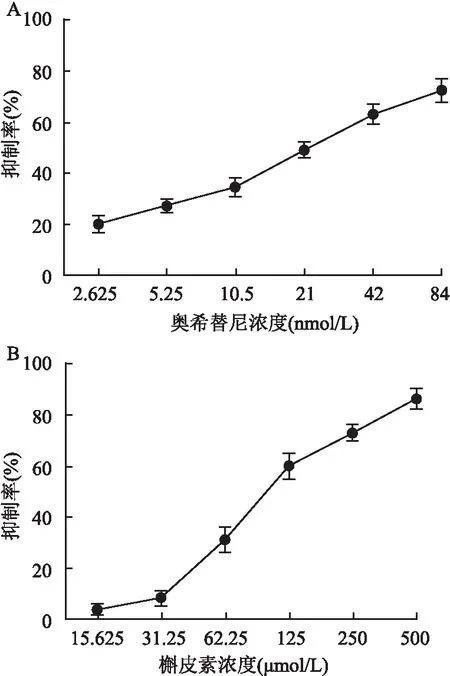
图1 MTT检测奥希替尼和槲皮素对NSCLC H1975细胞的增殖抑制效应
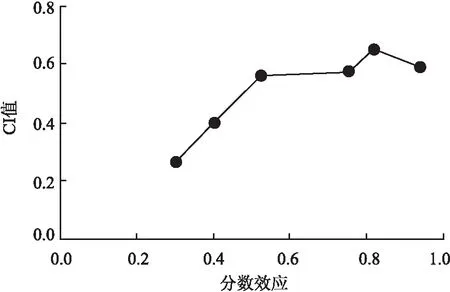
图2 奥希替尼联合槲皮素作用于NSCLC H1975细胞的CI值
2.2 各药物处理组H1975 细胞的凋亡率经流式细胞仪检测,奥希替尼单药和槲皮素单药处理72 h后的H1975细胞的凋亡率分别为17.14%和23.5%,而两药联合处理后为47.8%。与单药组及对照组比较,奥希替尼和槲皮素联合组细胞的凋亡率明显增高,差异有统计学意义(F=226.38,P<0.01) (图3)。
2.3 奥希替尼和槲皮素处理后H1975细胞中Akt/p- Akt及Bcl- 2、Bax蛋白的表达根据Western blot检测结果可见,与对照组、奥希替尼单药处理组和槲皮素单药处理组比较,双药联合处理组中,H1975细胞中p- Akt蛋白的表达水平明显下调,差异有统计学意义(F=143.48,P<0.01);联合组bcl- 2蛋白表达水平显著低于对照组和单药组,差异有统计学意义(F=58.72,P<0.01)。与奥希替尼单药组比较,奥希替尼和槲皮素两药组bax蛋白表达水平明显升高,差异有统计学意义(F=73.31,P<0.01)(图4)。
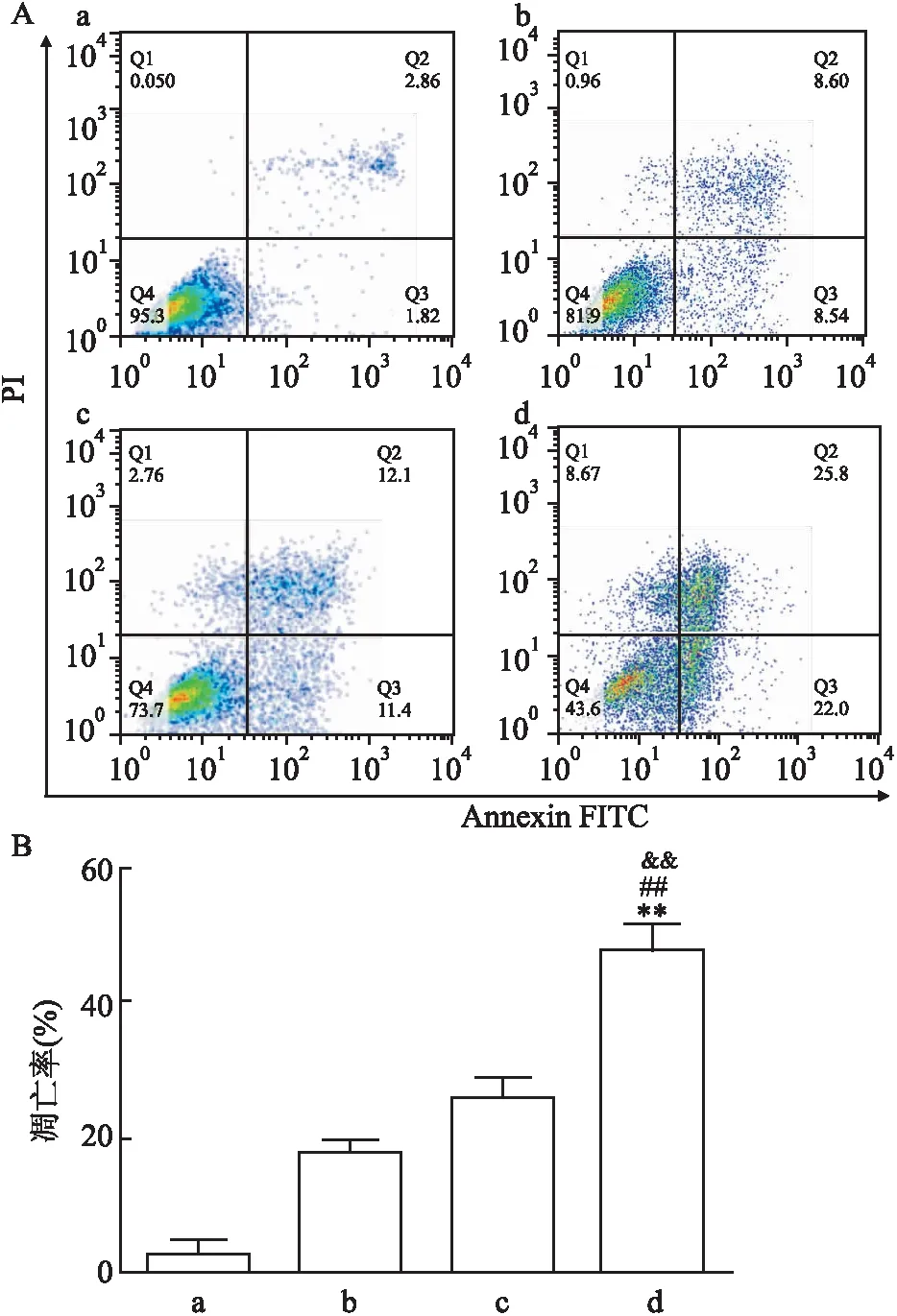
图3 流式细胞术法检测奥希替尼联合槲皮素对|NSCLC H1975 细胞凋亡率的影响
A:各组细胞的流式细胞仪检测结果;B:各组细胞的凋亡率;a:对照组;b:奥希替尼单药组;c:槲皮素单药组;d:两药联合组;与对照组比较:**P<0.01;与奥希替尼单药组比较:##P<0.01;与槲皮素单药组比较:&&P<0.01
3 讨论
亚洲EGFR阳性的非小细胞肺癌在肺癌中所占比例为30%~40%[8]。分子靶向药物的出现改变了该类型肺癌的治疗模式,第一代EGFR- TKI初始取得良好疗效,但很快出现继发性耐药,而最常见的耐药原因为T790M突变(约60%)[9]。第三代EGFR- TKI奥希替尼可选择性抑制T790M突变的EGFR[5]。而根据Jänne et al[10]对127例EGFR- T790M突变阳性的患者所进行的Ⅰ期临床试验中,对奥希替尼的客观缓解率达到61%,然而中位无进展生存期仅仅为9.6个月。
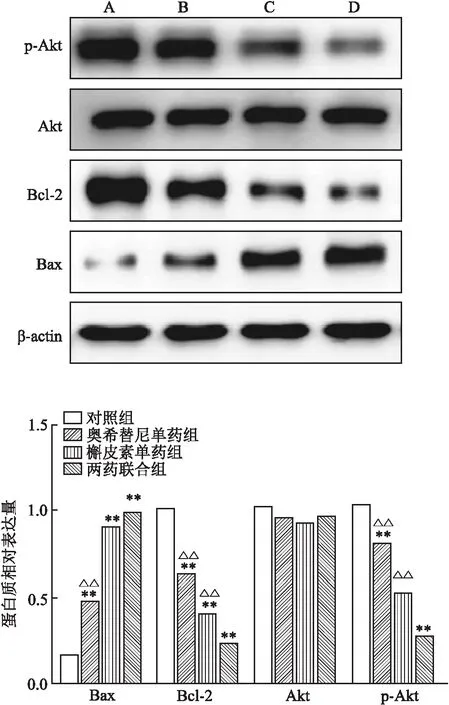
图4 Western blot检测奥希替尼联合槲皮素对NSCLC H1975细胞中目的蛋白(Akt、p- Akt、Bcl- 2及Bax)表达的影响
A:对照组;B:奥希替尼单药组;C:槲皮素单药组;D:两药联合组;与对照组比较:**P<0.01;与两药联合组比较:△△P<0.01
槲皮素是一种天然的类黄酮,槲皮素是一种天然类黄酮,存在于许多中草药和食品中,如银杏、三七、苹果、洋葱、绿茶等。其抗肿瘤特性贯穿于癌变的各个阶段,从肿瘤发生到侵袭和转移,并在不同的遗传、生化和免疫方面发挥作用,因此在近年来引起了癌症研究人员的关注[6]。研究[11]显示,槲皮素通过不同类型癌细胞的细胞内机制,增强了紫杉醇和顺铂等几种化疗药物对肿瘤细胞的生长抑制作用。
磷脂酰肌醇3激酶(phosphoinositide3- kinase,PI3K)/蛋白激酶B(Akt)信号转导途径是肿瘤发生发展过程中起关键性作用的一类信号通路。在多种肿瘤中观察到PI3K/Akt通路的过度激活,致使细胞凋亡受阻[12]。Wang et al[13]研究发现当PI3K/Akt通路的活性被抑制时,顺铂耐药的非小细胞肺癌细胞对化疗药物的敏感性增强。当PI3K开始活化,AKT的蛋白结构转变为具有激酶活性的p- Akt,使得下游效应分子中具有抗凋亡效应的原癌基因如Bcl- 2的表达也随之增加,从而抵抗放化疗所引起的肿瘤细胞凋亡,而Bax是Bcl- 2的同源基因,其编码的蛋白与Bcl- 2形成异源二聚体后可对Bcl- 2的表达产生阻抑作用,因而被认为是一种重要的促细胞凋亡基因[14]。
本研究将第三代EGFR- TKI奥希替尼联合槲皮素作用于T790M突变阳性的 H1975细胞,验证两种药物是否具有协同作用。实验结果表明,奥希替尼联合槲皮素可以更显著地抑制细胞增殖,各实验组的CI值均<1,显示出协同抑制作用。流式细胞术还进一步表明,奥希替尼联合槲皮素组所引起的H1975细胞凋亡比单一药物组更为明显,表现出更强的诱导细胞凋亡作用,其机制可能为两药联合后下调Akt的磷酸化水平,使得抗凋亡Bcl- 2蛋白的表达受到抑制而促凋亡Bax蛋白的表达量增加。由此可见,槲皮素联合奥希替尼可对 H1975细胞产生协同抗增殖与促凋亡作用。当然,本研究为体外实验,尚未建立动物模型验证,其作用有待进一步研究证实。
