Fur过表达对大肠杆菌血红素合成的影响
2019-09-11李蒙蒙王雨萱唐蕾
李蒙蒙,王雨萱,唐蕾,*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
血红素(heme)是一种含铁卟啉化合物,又称为血红素铁,是血红蛋白和肌红蛋白的重要组成部分,参与生物体内的电子传递、细胞信号传导等重要的生理生化反应过程。在大肠杆菌中主要以C5途径合成血红素,如图1所示,其生物合成受到严格调控[1-2]。血红素也是许多过氧化物酶的辅基,其生物合成量对过氧化物酶的活性具有重要作用,如提高血红素的合成有利于抗坏血酸过氧化物酶[3]、染料脱色过氧化酶[4]活性的提高。而且血红素铁有易于被吸收、无副作用等优点,因而作为食品添加剂、补铁剂等被广泛应用于食品、医药等行业[5]。
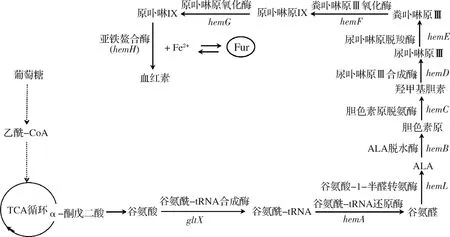
图1 大肠杆菌血红素合成途径Fig.1 The heme synthesis pathway of E.coli
铁离子是大多数细菌生长所必需的一种营养物质,胞内铁离子过多或过少都会对细菌的生长产生不利影响,同时血红素的生物合成也受到铁的可用性调节[6]。铁摄取调节子(ferric uptake regulator,Fur) 是细菌铁离子代谢中最重要的调节子,铁的全局转录调控由Fur蛋白介导。此外,Fur还参与细菌的能量代谢、抗酸能力、毒力和氧化应激等多种生物过程的调节[7]。Fur通过抑制或者激活基因的转录,来调节与铁摄取、利用和储存相关的基因,维持胞内铁离子浓度动态平衡[8-9],而在血红素合成途径的最后一步中,原卟啉Ⅸ在亚铁鳌合酶的作用下鳌合Fe2+生成血红素[10],但关于fur基因对大肠杆菌(Escherichacoli)血红素合成的影响未见进一步的研究。
本文以E.coliBL21为出发菌株,通过对铁摄取调节子Fur蛋白基因fur的过量表达,分别探究了不同条件下fur基因对菌体生长、铁离子浓度、血红素合成、血红素合成途径关键酶基因表达水平的影响,为寻找提高血红素合成策略提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验所用菌株和质粒见表1。

表1 本研究中使用的菌株与质粒Table 1 Strains and plasmids used in this study
1.1.2 试剂及仪器
限制性内切酶(EcoR I,XhoI)、T4DNA连接酶、DNA聚合酶:宝生物工程(大连)有限公司;2,2′-联吡啶(2,2′-dipyridyl,dip):阿拉丁试剂公司;异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG)、硫酸卡那霉素(Kan)、氨苄青霉素钠(Amp):生工生物工程(上海)股份有限公司;胰蛋白胨、NaCl、酵母粉:国药集团化学试剂有限公司。
核酸电泳仪、凝胶成像系统,Bio-Rad公司;可见光分光光度计,尤尼柯(上海)仪器有限公司;Enspire多标记检测系统(酶标仪),珀金埃尔默有限公司;电感耦合等离子体质谱仪,德国布鲁克公司;实时荧光定量PCR仪,美国应用生物系统公司。
1.1.3 培养基及培养条件
细菌肉汤培养基(LB)(g/L):胰蛋白胨10,酵母粉5,NaCl 10,固体LB培养基加入20 g/L的琼脂。
限铁培养基:在LB培养基的基础上添加终浓度为200 μmol/L的Dip。
摇瓶发酵条件:250 mL摇瓶装液量50 mL,37℃、200 r/min摇床培养。在菌株构建和发酵过程中,培养基添加的氨苄青霉素和硫酸卡那霉素终质量浓度分别为100和50 mg/L,IPTG终浓度0.2 mmol/L。
1.2 铁摄取调节子基因过表达重组菌的构建
(1)引物设计及合成:通过NCBI下载fur基因序列,利用DNAMAN软件设计引物,在5′端分别引入EcoRI 与XhoI限制性酶切位点及保护碱基。引物序列及限制性酶切位点见表2。

表2 过表达菌株构建所用引物Table 2 List of primers used in the construction of over expressing strains
注:″-GCG-″为保护碱基,″-GAATTC-″与″-CTCGAG-″分别为EcoRI 与XhoI限制性酶识别序列。
(2)产物扩增与连接:以E.coli基因组DNA为模板,以相应引物对fur基因的全长进行扩增。扩增产物经胶回收试剂盒回收后先加A尾后,再进行连接pMD19-T载体,将连接产物热转化E.coliJM109中,挑取阳性克隆培养,提取质粒后酶切验证,将验证正确的质粒进行测序,测序正确的保菌进行后续实验。将上述验证正确的质粒pMD19-T-fur与pET28a质粒进行酶切40 min,胶回收后进行16 ℃过夜连接。
(3)连接产物转化与阳性克隆验证:将连接产物热转化E.coliJM109中,挑取阳性克隆培养,提取质粒后酶切验证,将验证正确的质粒进行测序,将测序正确的保种。重组质粒结构如图2所示。测序正确的质粒热转化到表达宿主E.coliBL21中,挑取阳性克隆进行保种,并名为Eco/pEF。

图2 重组质粒pET28a-fur示意图Fig.2 Scheme of recombinant plasmid pET28a-fur
1.3 重组蛋白表达及SDS-PAGE检测
参照文献陈丹园等[11]实验方法检测重组菌株蛋白表达情况。
1.4 生长曲线测定
将各菌株于37 ℃、200 r/min摇床上过夜培养后以1%(体积分数)的接种量转接LB培养基及限铁培养基中,相同条件下进行培养,培养到2 h时,加入终浓度为0.2 mmol/L的IPTG,每间隔2 h取样测定菌液在600 nm下的吸光值,每株菌3个平行,共测定12 h的数据。
1.5 ICP-MS法测定胞内铁含量
参考文献[12]利用电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometry,ICP-MS)测定胞内铁含量。
将过夜活化的菌株按1%的转接量转接于50 mL LB液体培养基中,37 ℃、200 r/min培养,培养2 h后加入终浓度为0.2 mmol/L的IPTG,诱导5 h后收集菌体。用含有5 mmol/L EDTA的磷酸盐PBS缓冲液清洗2遍(10 000 r/min,5 min),再用不含有EDTA的PBS缓冲液清洗菌体2遍(10 000 r/min,5 min),之后转移至5 mL离心管中 105 ℃过夜烘干;分别称取干重后加5 mL浓硝酸进行石墨消解120 ℃ 45 min,经蒸发后使用超纯水定容到50 mL,之后用于ICP-MS测定,得到样品铁的浓度。计算方法如公式(1)、(2):
(1)
(2)
式中:A为菌体干重,mg;B为定容体积,50 mL;C为样品质量浓度,g/L;D为铁质量浓度,μg/mL。
1.6 血红素及5-氨基乙酰丙酸(5-aminolevulinic acid, ALA)浓度测定
将各菌株于37 ℃、200 r/min摇床上过夜培养后以1%(体积分数)的接种量转接LB培养基及限铁培养基中,培养到2 h时加入终浓度为0.2 mmol/L的IPTG,诱导培养5 h后取样测定血红素及卟啉物质的含量。根据参考文献陈丹园等[11]、MICHENER等[13]利用荧光法测定血红素浓度。血红素合成的前体物质ALA的测定参照ZHANG等[14]。
1.7 实时荧光定量PCR
各菌株于37 ℃、200 r/min摇床过夜培养后以1%(体积分数)的接种量转接新鲜LB培养基中,培养2 h后加入IPTG诱导,诱导到对数生长期后12 000 r/min、4 ℃、5 min收集菌体,用50 g/L的溶菌酶37 ℃破壁30 min。之后按照TaKaRa试剂盒说明书进行总RNA提取,提取的RNA浓度及纯度使用核酸定量仪测定,然后RNA直接反转录成cDNA用于荧光定量实验。以上述cDNA为模板,荧光定量PCR引物见表3,选择编码3-磷酸甘油醛脱氢酶的基因gapA作为内参基因,采用SYBR® Green I嵌合荧光法,反应体系参照试剂盒说明书。
2 结果与分析
2.1 铁摄取调节子基因过表达重组菌的构建
2.1.1 基因fur片段的扩增与连接
提取E.coliBL21基因组,以E.coliBL21基因组为模板,以fur-P-F/fur-P-R为引物扩增目的片段。扩增片段如图3所示。由图3可知,片段大小与理论值相符,目的片段扩增成功。
2.1.2 扩增产物连接与转化
扩增产物连接至pMD19-T载体,进行双酶切验证,如图4-A。双酶切验证正确的质粒测序验证,结果正确。将pET28a空载质粒进行相同的双酶切,如图4-B。由图4可知酶切验证正确,胶回收后16 ℃过夜进行连接。

表3 荧光定量PCR引物Table 3 Primers used in RT-qPCR
M-DNA marker;1-基因fur图3 目的基因fur的扩增Fig.3 Amplification of the target gene fur

A-质粒pMD19-T-fur双酶切;B-质粒pET28a双酶切图4 质粒的双酶切验证Fig.4 Double enzyme digestion verification of plasmid注:M-DNA marker;A-1:基因fur;B-1:酶切后的pET28a。
2.1.3 阳性克隆筛选与鉴定
将连接产物热转化到克隆宿主E.coliJM109中,在Kan抗性平板上筛选阳性克隆单菌落,提取质粒后进行双酶切验证,结果如图5所示。

M-DNA marker;1-重组质粒pET28a-fur双酶切后的凝胶电泳图5 重组质粒pET28a-fur的双酶切验证Fig.5 Verification of recombinant plasmid pET28a-fur by double enzyme digestion
由图5可知,双酶切条带验证正确。之后进行测序验证,将测序正确的单克隆保种后进行后续实验,并将其命名为Eco/pEF。
2.1.4 重组蛋白表达及SDS-PAGE检测
为了检测铁摄取调节子基因fur过表后产生的蛋白是否可溶,对Eco/pEF菌株诱导然后进行SDS-PAGE检测,蛋白Fur分子质量约为17 kDa,其蛋白的表达检测结果如图6所示。

M-Marker;1-E.coli BL21全细胞;2-E.coli BL21 破碎上清;3-E.coli BL21破碎沉淀;4-Eco/pEF诱导后全细胞;5-Eco/pEF诱导破碎上清;6-Eco/pEF诱导破碎沉淀图6 重组蛋白的检测Fig.6 Detection of recombinant protein
由图6可知,在诱导后的全细胞中即第4泳道、在破碎细胞的上清中即第5泳道及在诱导破碎后的沉淀中即第6泳道都检测到Fur蛋白的条带,第5泳道的Fur蛋白条带说明重组菌中有可溶性表达的Fur。以泳道1的Fur条带为参照,通过Image Lab软件对泳道4、5、6的Fur条带进行扫描定量,其蛋白表达量分别增加了12.23、9.47、8.49倍。因此,Fur蛋白表达量增加,重组菌株Eco/pEF可以用于后续的实验。
2.2 铁摄取调节子基因过表达对重组菌生长的影响
由于Fur蛋白调控铁代谢相关基因的转录,而铁元素对于细菌的生长和生理过程又至关重要。为了分析Fur的过表达是否能够影响菌株的生长,我们测定了野生型(wild)与fur过表达菌株(Eco/pEF)在LB培养基和限铁培养基中(LB+Dip培养基)中的生长曲线。结果如图7所示。

图7 菌株在不同培养条件下的生长曲线Fig.7 Growth curve of each strain under different culture conditions
由图7可知,相比于对照组(wild),LB培养条件下铁摄取调节子基因fur的过表达抑制了Eco/pEF菌株的生长;对照LB培养条件下,限铁条件下wild菌株与Eco/pEF菌株的生长均受到抑制;同时对比发现,限铁条件下Eco/pEF菌株的生长进一步受到抑制。此结果说明,铁摄取调节子基因fur的过表达会抑制菌株的生长;并且由缺铁条件下菌体生长受到抑制可以进一步说明胞外铁离子浓度对菌体生长至关重要。我们推测铁摄取调节子基因fur的过表达引起了菌株胞内铁离子含量的变化,进而影响了菌株的生长代谢。
2.3 铁摄取调节子基因过表达对重组菌胞内铁离子浓度的影响
一方面,铁元素对于细胞来说是必需的,铁含量减少时会影响菌体的生长;另一方面,过量的铁又会引起Fenton反应来毒害细胞[15]。所以,细胞内铁含量的稳态对于细胞来说是必需的。在绝大多数革兰氏阴性细菌中,Fur是调控铁吸收转运的关键转录调控因子。因此,我们通过ICP-MS方法测定了LB培养条件下与LB+Dip培养条件下wild菌株与Eco/pEF菌株中铁离子的含量。结果如图8所示。

图8 不同培养条件下菌株胞内总铁含量Fig.8 Total intracellular iron content of strains under different culture conditions
由图8可知,LB培养条件下,铁摄取调节子基因过表达菌株Eco/pEF的胞内铁离子含量减少;铁摄取调节子Fur蛋白作为细菌胞内铁离子浓度感受器和铁离子依赖性转录阻遏蛋白,在有亚铁离子作为辅因子的条件,Fur与Fe2+形成Fur-Fe2+复合物对铁离子转运系统有转录抑制作用[16-17]。Fur蛋白大量存在时,与Fe2+结合形成的Fur-Fe2+复合物会抑制铁离子转运系统的表达,因而铁离子含量减少。
由图8可以看出,LB+Dip培养条件下,菌株胞内铁离子均显著减少。菌株胞内铁离子的减少,会造成胞内铁离子代谢的不平衡,从而影响菌体的生长。由于外源铁螯合剂Dip的加入,使菌体处于相对缺铁的环境,菌体铁的转运吸收会进一步受到限制,所以其菌体胞内铁离子含量显著减少,同时菌体的生长也受到显著限制。
综上结果表明,Fur蛋白的过表达对菌体生长不利,会导致胞内铁离子量减少从而使菌体的生长受到抑制。外源环境缺铁时,菌体胞内铁离子的转运受到影响,胞内铁离子浓度进一步减少,菌体生长受到的抑制更显著。
2.4 铁摄取调节子基因过表达对血红素合成的影响
在大肠杆菌中,血红素合成途径中的前体物质ALA是血红素合成的限速步骤[18];另外,原卟啉Ⅸ在亚铁鳌合酶的作用下鳌合铁离子形成血红素也是其中的一个限速步骤[19]。为了分析铁摄取调节子Fur蛋白对血红素合成途径的影响,以明确Fur蛋白在血红素合成途径中的作用,本研究按照1.6的方法对不同条件下培养后的wild菌株与Eco/pEF菌株进行血红素及前体物质ALA的测定。结果如图9所示。
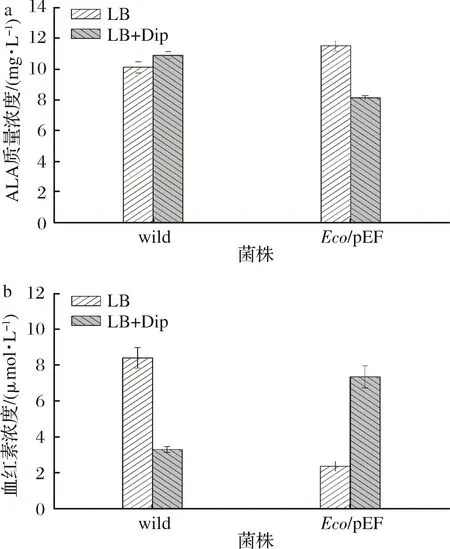
a-ALA质量浓度;b-血红素质量浓度图9 菌株的ALA与血红素含量Fig.9 Content of ALA and heme of strains
由图9可知,LB培养条件下,过表达菌株Eco/pEF的血红素合成量降低,胞外ALA的合成量增加,说明Fur蛋白的过量产生对血红素的合成有抑制作用;限铁条件下,过表达菌株Eco/pEF的血红素合成量增加,胞外ALA的合成量减少,说明限铁条件下Fur蛋白的过量产生却促进了血红素的合成,由于血红素在细胞呼吸、电子传递、氧气运输及信号传导等生理过程中具有重要作用[20],推测可能在限铁条件下,Fur蛋白的过量产生使铁离子更多地流向血红素合成途径,以维持细胞一些重要的生理活动和生长。
2.5 铁摄取调节子基因过表达对血红素合成途径关键基因转录水平的影响
由于在生物体内血红素的合成途径是高度保守和严格调控的,并且会受到自身血红素合成量的反馈调控。为了进一步分析过量表达铁摄取调节子基因fur对血红素合成途径基因的影响,在转录水平对重组菌株的血红素合成途径的关键酶基因gltX、hemA、hemL、hemB、hemC、hemD、hemE、hemF、hemG、hemH的转录水平进行了实时荧光定量PCR,其基因转录水平的变化结果如图10所示。

图10 不同培养条件下重组菌株血红素合成酶基因转录水平变化Fig.10 Transcription level of the heme synthase gene of recombinant strains under different culture conditions
由图10可以看出,两种培养条件下重组菌株Eco/pEF中过表达的基因fur的转录水平显著提高,说明基因得到成功表达。此外,LB培养条件下,fur基因的过表达使得大部分血红素合成途径基因的转录水平发生不同程度的上调,其中上调水平变化较大的是gltX、hemB、hemC,分别上调了4.93倍、4.61倍和9.39倍;血红素合成途径的最后一个限速步骤中的关键酶基因hemH的转录水平轻微上调,同时发现另一个限速步骤中的关键酶基因hemA的转录水平下调,在血红素合成途径中(图1),hemA基因编码的谷氨酰-tRNA还原酶催化谷氨酰-tRNA往下游合成ALA,ALA再往下游合成血红素,当前体物质合成不足时,会影响下游血红素的合成。因此,LB培养条件下,fur基因的过表达并未使血红素合成量提高。
与此相反的是,限铁条件下(LB+Dip)铁摄取调节子基因fur的过表达使血红素的合成相比于wild有所增加(图9),由图10可知,血红素合成途径的关键酶基因的转录水平都处于不同程度的上调状态,以基因hemB与hemG上调最为明显,分别上调了5.59和4.49倍,同时发现基因hemL与hemH分别上调了2.60与2.40倍。基因hemB编码的ALA脱水酶催化前体物质ALA合成胆色素原,胆色素原再经酶促反应合成血红素的前体卟啉物质,基因hemG编码的原卟啉原Ⅸ氧化酶催化原卟啉原Ⅸ合成原卟啉Ⅸ;基因hemH编码的亚铁鳌合酶催化原卟啉Ⅸ合成血红素(图1)。因此,限铁条件下铁摄取调节子基因fur的过表达使血红素的合成量有所增加,以维持细胞正常的生理活动。
同时,以上结果也表明血红素的合成受到严格的调控,Fur蛋白、铁离子及血红素合成途径基因的表达三者之间相互影响与作用,共同调控血红素的合成。
3 讨论
铁是血红素的重要组成部分,也是生物生长代谢的必需元素,其表达调控受多种因素的制约[21-23]。铁摄取调节子Fur对铁有全局调控作用,而在血红素合成的最后一步中,需要在亚铁鳌合酶的作用下鳌合铁离子生成血红素。已有研究表明Fur同系物FurA蛋白调控鱼腥藻(Anabaenasp.)的铁稳态和血红素合成[24]。通过过表达和转录分析,GONZALEZ等[25]发现FurA抑制Anabaenasp.的hemB与hemC表达,同时激活hemH的表达。本研究结果表明,与鱼腥藻不同,大肠杆菌fur基因的过量表达抑制了hemA的表达,显著上调了gltX、hemB、hemC的表达,而限铁条件下hemB进一步上调,由此可见,以gltX、hemA、hemB、hemC为靶点,结合Fur与铁的调控,可为控制E.coli胞内血红素的含量提供一个新的策略。
此外,fur对需要血红素参与的细胞生理过程和以血红素为辅基的蛋白表达也会产生显著影响。FU等[26]发现在奥奈达希瓦氏菌(Shewanellaoneidensis)的fur突变菌株中,血红素b的合成、细胞色素c的水平以及细胞呼吸活性发生改变;COLPA等[27]在异源表达脱色过氧化物酶时发现,重组蛋白表达量的增加并未提升酶的活性,原因在于与重组酶结合的是缺乏铁的血红素前体原卟啉Ⅸ,而非血红素。本研究结果表明,Fur的过量表达抑制了菌体的生长和血红素的合成。Fur对铁离子转运系统的转录有抑制作用[17],Fur的大量表达会抑制铁离子的转运,造成胞内铁离子含量减少,进而限制了参与血红素合成途径最后一步的亚铁螯合酶的作用。此外,由于血红素及前体卟啉物质过多会对细胞产生毒害作用[28],所以菌体生长受限,相应的血红素需求减少,合成量降低。因此血红素含量的变化是途径中的基因表达水平、铁离子浓度和菌体生长状况的综合体现。
综上所述,Fur介导的血红素合成调控对于细胞生长和代谢具有十分重要的意义。然而,不同微生物的调控机制存在差异,目前相关信息还十分有限。大肠杆菌作为模式菌株和常用的基因工程菌,深入研究其Fur、铁和血红素之间的相互关系,在血红素包括其前体合成以及以血红素为辅基的重组酶生产中具有潜在的应用价值。
