毒素胁迫烟草抗黑胫病鉴定及抗性指标分析
2019-09-10卢小亮张强孙渭王佩张帅李春莲齐宁海陈耀锋
卢小亮 张强 孙渭 王佩 张帅 李春莲 齐宁海 陈耀锋

摘 要:为建立一种高效准确的烟草黑胫病抗性鉴定方法,以4种具有不同抗性特性的烟草品种为材料,研究培养基附加不同浓度黑胫病病菌毒素及不同胁迫时间对烟草种子萌发和根系生长的影响。结果表明,烟草黑胫病病菌毒素胁迫对烟草种子的发芽率和根系生长均有抑制作用,抑制效果随胁迫浓度的增加而增强,且不同品种对毒素胁迫的耐受力不同,利用体积浓度为50%的毒素胁迫15 d时,抗病品种G28、中抗品种YN116、中感品种净叶黄、感病品种红花大金元的根系长进培养基中的株数比率分别为79.38%、70.74%、33.55%和13.36%。初步确定鉴别烟草种子抗性特性的最佳粗毒素胁迫浓度为50%(即含蛋白质13.53 µg/mL,含糖19.64 mg/mL)、最佳鉴定时间为胁迫15 d,利用该方法可在短期内高效准确地鉴定出不同品种(种质)对烟草黑胫病的抗感水平,加快烟草抗黑胫病育种进程。
关键词:烟草;黑胫病;毒素胁迫;抗性鉴定
中图分类号:S435.72 文章编号:1007-5119(2019)03-0060-07 DOI:10.13496/j.issn.1007-5119.2019.03.009
In order to establish an efficient and accurate method for identification of resistance to tobacco black shank, experiments were performed using 4 tobacco varieties with different resistance characteristics. The toxin was added to the medium to study the effects of different concentrations of toxin stress and different stress time on tobacco seed germination and root growth. The results showed that the toxin stress of black shank disease could inhibit the germination and root growth of tobacco seedlings, and the inhibitory effect increased with the increase of toxin concentration. Different varieties have different tolerance to toxin stress. When the toxin was used at a concentration of 50% for 15 days, the ratio of the number of plants in the root growth medium of G28, YN116, Jingyehuang and Hongda was 79.38%, 70.74%, 33.55% and 13.36%, respectively. It was preliminarily determined that the optimal crude toxin concentration for identifying the resistance level of different varieties (germplasm) to tobacco black shank was 50% (protein content 13.53 μg/mL, sugar content 19.64 mg/mL), and the optimal stress time was 15 days. This method can effectively and accurately identify the resistance level of different varieties (germplasm) to tobacco black shank in a short period of time, and accelerate the breeding process of tobacco resistance to black shank.
tobacco; black shank disease; toxin stress; resistance identification
煙草黑胫病(var.)是由卵菌纲疫霉属烟草疫霉引起的一种分布广泛、严重危害烟草生产的真菌性病害,每年因黑胫病给我国烟草行业造成巨大损失,其影响仅次于烟草病毒病。黑胫病病原菌的最适培养条件已有详细的报道,黄丽华等筛选出了黑胫病病菌毒素的高产培养条件。
抗病育种是作物病害防治的重要途径,应用抗病品种和提高品种的抗病性是防治烟草黑胫病最经济有效、且有利于环境保护的措施。传统烟草黑胫病抗性的鉴定主要采用苗期接种鉴定、田间病圃抗性鉴定和离体叶片接种鉴定。苗期接种鉴定一定程度上受接种时间、接种方法以及培养条件的影响,导致鉴定结果出现较大误差,而田间病圃抗性鉴定主要应用于烟草成株的鉴定,往往由于气候环境条件影响而不能准确评价材料的抗性水平。王桥美等研究表明,烟草品种对黑胫病病菌毒素的抗性与烟草品种对黑胫病的抗性有高度的相关性,选用适当的毒素浓度可作为寄主植物对病害抗性的鉴定剂。时焦等利用培养基添加赤星病菌毒素的方法建立了一种培养皿中筛选烟草抗赤星病种质材料的体系。丁燕芳等对粗毒素浸种法、粗毒素浸根法、孢子悬浮液浸根法及田间病圃接种法4种黑胫病抗性鉴定方法进行了比较,结果显示粗毒素浸种法可对烟草黑胫病抗性进行初期筛选,然而因种子质量影响形成的低发芽率可造成“假感病”的现象,影响毒素浸种法的判定效果。尽管在利用黑胫病菌毒素筛选和抗病性鉴定方面取得了令人兴奋的成果,但仍存在很多不足,如易受其他杂菌影响、鉴定历时长、耗费高、温湿度条件不易控制等。
鉴于此,本研究以4种具不同抗性水平的烟草品种为材料,采用培养基附加烟草黑胫病病菌毒素的方法,通过不同毒素浓度、不同时间胁迫,研究了烟草黑胫病病菌毒素对具不同抗性烟草种子发芽特性的影响,筛选能有效鉴别区分烟草不同抗性特性的最佳毒素浓度和胁迫时间,旨在建立一种高效、准确、广适的烟草黑胫病离体胁迫抗性鉴定方法,为烟草抗病育种提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种 供试的烟草黑胫病菌强致病力菌株PPBS042由西北农林科技大学农学院单卫星教授馈赠。
1.1.2 供试烟草品种 供试烟草品种均由中国烟草总公司陕西省公司提供,分别为G28(抗黑胫病品种,R)、YN116(中抗黑胫病品种,MR)、净叶黄(中感黑胫病品种,MS)和红花大金元(感黑胫病品种,S)。
1.2 试验方法和地点
1.2.1 试验地点 本试验于2017—2018年在西北农林科技大学农学院细胞工程实验室进行。
1.2.2 黑胫病菌的活化、产毒培养与毒素的制备 菌种的活化:采用5% CA培养基(胡萝卜汁50 mL/L、β-谷甾醇0.02 g/L、碳酸钙0.1 g/L、琼脂8 g/L),23 ℃光照培养4~7 d,菌丝布满整个培养皿为宜。
产毒培养与毒素的制备:参照庞龙等制备毒素的方法,取直径0.5 cm已经活化的黑胫病菌菌饼接于土豆培养液中(土豆600 g/L、蔗糖50 g/L、硫酸铵3 g/L、硫酸镁0.8 g/L),26 ℃避光振荡(150 r/min)培养24 d。培养液用无菌双层纱布过滤后,再用定性滤纸过滤两次,8000 r/min离心5 min,上清液即为粗毒素原液,然后经抽滤灭菌,4 ℃保存,备用。
1.2.3 黑胫病菌毒素活性测定 采用叶片注射法确定毒素的活性,用微量注射器将毒素液沿活体烟草叶背的叶脉注人5~10 µL,使之在表皮内形成一个渍斑,以水作同样注射为对照。分别于24 h和48 h观察注射部位坏死斑的出现情况。
1.2.4 黑胫病菌毒素有效成分测定 庞龙等研究发现烟草黑胫病菌毒素的主要成分为蛋白质和糖。分别采用考马斯亮蓝G-250染色法和蒽酮比色法对上述制备毒素中蛋白质含量和糖含量进行测定。结果表明该毒素液含蛋白质27.06 µg/mL,含糖39.28 mg/mL。
1.2.5 不同濃度毒素培养基的制备 毒素培养基:MS+30 g/L蔗糖+6.5 g/L琼脂+黑胫病病菌粗毒素,pH值5.8。制备方法:按量配制每200 mL毒素培养基所需要的蔗糖、琼脂粉等基本成分,装于250 mL三角瓶中,121 ℃灭菌20 min后,50 ℃保温备用;将装有黑胫病病菌粗毒素的15 mL离心管于微波炉低温加热至45 ℃,然后按浓度需要向培养
基中加入已过滤除菌的黑胫病病菌毒素,充分摇匀后分装到13 cm的方形培养皿,每200 mL分装到3个培养皿。培养基中毒素的浓度分别为:0(CK)、10%、20%、30%、40%、50%。
1.2.6 毒素胁迫培养 每个供试品种分别挑选150粒籽粒饱满且大小均一的种子于2 mL离心管中,在无菌环境中先用75%酒精对种子表面消毒30 s,无菌水冲洗2次,再用10% HO深层消毒10 min后用无菌水冲洗4次,以不附加黑胫病病菌毒素的MS培养基为空白对照,将消毒好的4个品种间隔开接种于同一培养皿为一个处理,3次重复。(27±2)℃,16 h/d光照条件下培养,于10、15、20 d统计其发病情况,以发芽率(%)和烟草种子根系长进培养基中的株数比率(%)为鉴定指标,筛选出能有效鉴别烟草不同抗性特性的最佳毒素浓度和胁迫时间。
1.3 数据分析
利用Excel 2010和DPS软件对试验数据进行处理,采用Duncan新复极差法进行差异显著性分析。
2 结 果
2.1 黑胫病菌毒素生物活性测定
毒素生物活性测定结果见图1,将水和毒素液沿烟草叶背的叶脉分别注入后在叶肉组织内立即形成渍斑。24 h时观察发现注射毒素液部位表现为叶片失绿,而注射水的渍斑消失,叶片恢复正常。48 h时注射毒素产生的失绿斑外围出现组织坏死,对照则正常生长。

2.2 毒素胁迫对烟草种子发芽率的影响
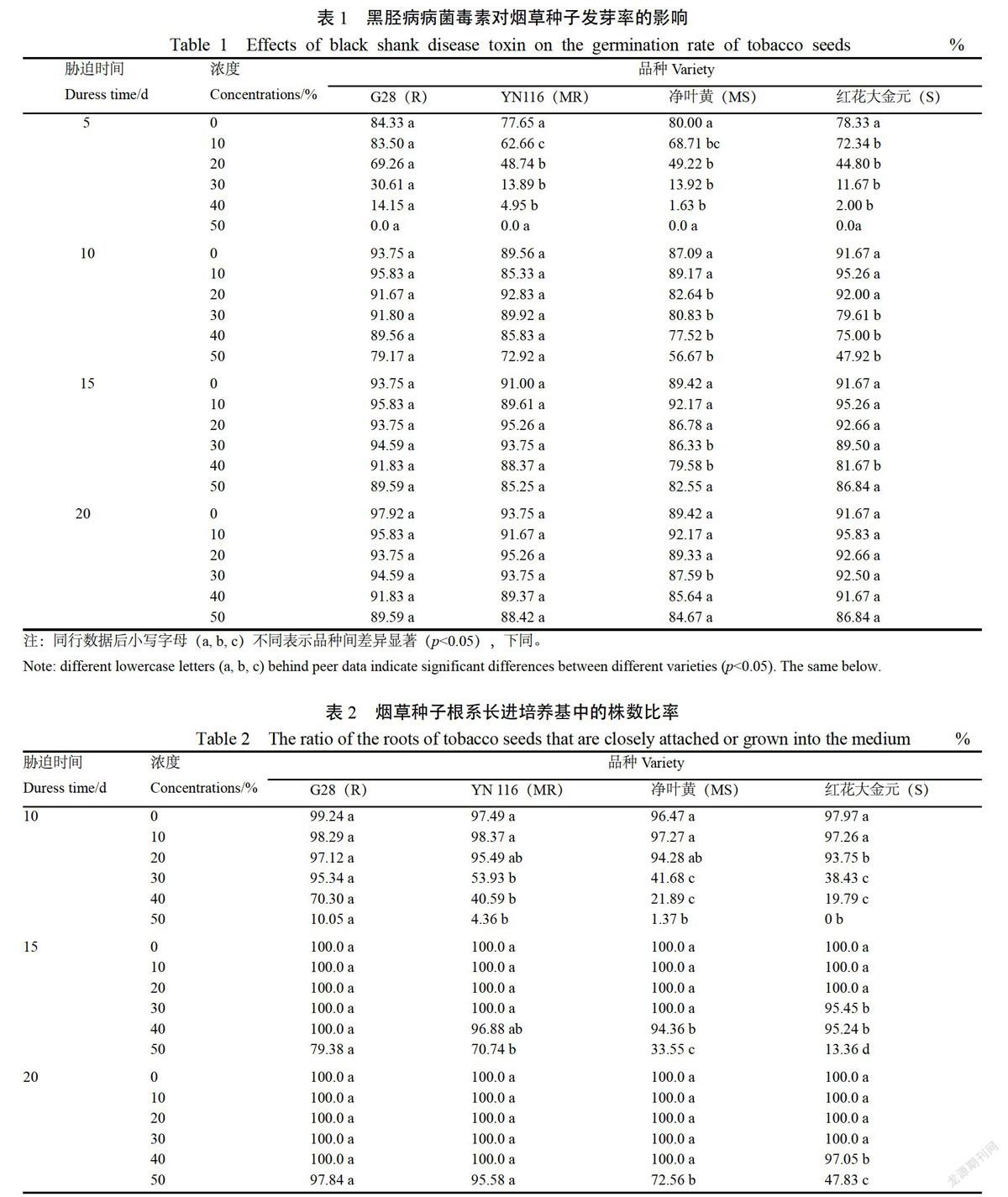
利用培养基附加病原菌毒素胁迫,研究了毒素胁迫时间和胁迫浓度对烟草种子发芽率的影响,通过不同处理发芽率显著性差异分析可知(表1),烟草黑胫病病菌毒素胁迫处理对所有烟草品种种子发芽均有较大影响,特别是高浓度毒素抑制烟草种子发芽。在胁迫条件下,低浓度(≤40%)毒素胁迫5 d时,抗病品种G28发芽率最高,显著高于其他3个品种(<0.05);胁迫浓度达到50%时,所有供试品种种子的发芽率均急速下降,高浓度毒素的抑制作用凸显。然后随胁迫时间延长,各浓度毒素胁迫对各品种烟草种子发芽率的影响差异水平逐渐降低。
2.3 毒素胁迫对烟草种子根系生长的影响
为了进一步探究黑胫病菌毒素胁迫对烟草种子根系生长的影响,对各品种烟草种子不同胁迫时间、不同胁迫浓度下根系长进毒素培养基中的能力进行比较,差异显著性分析结果(表2)表明,不同浓度毒素胁迫对烟草种子根系生长的影响显著不同,根系长进毒素培养基中的株数比率(根系长进毒素培养基中的株数/总发芽数×100%)随毒素浓度的增大而降低,体积浓度为50%的毒素胁迫第15天时,抗病品种G28的根系长进培养基中的株数比率最高,为79.38%,显著高于其他3个品种,与YN116、净叶黄、红花大金元的根系长进培养基中的株数比率相比分别是其1.12、2.37、5.94倍。胁迫时间增加至20 d时,0~40%的病菌毒素对根系生长无显著影响,但50%的病菌毒素仍对净叶黄和红花大金元影响显著,其根系长进毒素培养基中的株数比率分别为72.56%和47.83%。综合不同胁迫时间和胁迫浓度对烟草根系长进培养基的株数比率的变化,可得出抗黑胫病能力大小为G28>YN116>净叶黄>红花大金元。
2.4 毒素胁迫烟草抗黑胫病鉴定指标分析
综合表1、2表明,黑胫病病菌毒素胁迫对烟草种子的萌发具有一定的抑制效应,低浓度(≤40%)毒素胁迫5 d时,G28的发芽率均显著高于同等条件下YN116、净叶黄和红花大金元的发芽率,随胁迫时间延长不同品种间发芽率的差异水平降低,难以进一步鉴定对黑胫病的抗感性差异。另外毒素胁迫对烟草种子根系长进毒素培养基中的株数比率影响显著,各品种烟草种子根系长进培养基的株数均随胁迫浓度增加而下降,但不同品种间有所差异,低毒素浓度(0~40%)胁迫下,表现为毒素选择压力过低,使得感病品种能够克服毒素的抑制作用而导致对烟草黑胫病的抗性水平难以准确判断;而浓度为50%的毒素胁迫15 d时,品种间表现出显著性差异(<0.05),G28、YN116、净叶黄和红花大金元的种子根系长进培养基中的株数比率分别为79.38%、70.74%、33.55%和13.36%。说明通过对比分析烟草种子根系在50%毒素(含蛋白质13.53 µg/mL,含糖19.64 mg/mL)培养基上长进培养基中的株数比率,能够快速准确地鉴别出不同品种或种质对烟草黑胫病的抗性水平。
3 讨 论
植物病原菌毒素的本质是病原菌产生的有生物毒性的代谢产物,该产物可使寄主植物产生特定的病症反应,病症反应的强弱与寄主植物的抗病性具有高度的相关性。本研究发现,黑胫病病菌毒素胁迫对烟草种子的萌发具有一定的抑制效应,抑制效果的强弱与烟草品种对黑胫病的抗病性呈正相关,这与时焦等在煙草赤星病中的研究结果一致。近年来,以细胞工程为基础筛选抗病突变体的研究取得了一系列成就,最适毒素浓度的确定是高效鉴定并筛选抗烟草黑胫病材料的关键,晏娟等采用细胞突变体离体筛选与组织培养技术相结合的方法初步确定红花大金元和云烟85的最佳筛选毒素浓度。
本试验结果表明,黑胫病病菌毒素胁迫对烟草种子的萌发和生长均有显著影响。烟草根系长进毒素培养基中的株数比率随毒素浓度的增大而降低,低浓度毒素(0~40%)胁迫处理前期表现出轻微的抑制作用,但后期因毒素浓度过低,表现为筛选压力不足,致使感病品种能够适应致病毒素对烟草生长造成的影响。所有品种在50%的毒素浓度处理5 d时严重抑制了种子发芽,表现为毒素浓度过高,即超过抗性品种的耐受范围,导致抗病材料的抗性“丢失”。因此,在供试材料的抗性耐受范围内选用高毒素浓度可有效的鉴定并筛选出抗黑胫病的烟草种质,高崇等在烟草菌核病的试验中也得到了类似的结论。
传统上烟草黑胫病抗性的鉴定主要采用苗期接种鉴定和田间病圃抗性鉴定,苗期接种鉴定主要包括育苗、接种体的制备和诱发3个环节,对接种苗龄、接种方法以及诱发条件的依赖性较强,导致鉴定结果出现较大误差,而田间病圃抗性鉴定主要应用于烟草成株的鉴定,由于气候环境条件影响进而不能准确的评价材料的抗性水平。毒素胁迫鉴定方法与现有技术相比具有如下优点:1)与苗期接种鉴定相比较,毒素胁迫法在烟草种子水平上利用其病菌毒素能够引起寄主植物产生特定病症反应为依据进行烟草黑胫病抗性的鉴定,有效克服了因接种苗龄不一致和诱发条件受外界影响大等因素而出现较大误差;2)与田间病圃抗性鉴定相比,本研究方法利用烟草种子可在短期内对其进行高通量抗性水平鉴定,避免了从育苗移栽到成株期历时长、大田气候环境多变而不易控制温湿度条件等影响鉴定结果准确性的众多因素;3)技术难度小、鉴定成本低,结果可靠性高,抗感品种对毒素胁迫的反应差异显著。
尽管毒素胁迫对烟草种子的萌发和生长均有显著影响,但不同品种的烟草种子在毒素胁迫条件下的萌发差异可能与种子的质量有关,即使来源于同一品种,不同植株的烟草种子抗逆性也会与自身生物学特性密切相关。此外,人为控制的相同条件下不同品种间的发芽指标对于品种抗病性的判断存在一定局限性。因此,种质材料抗性的最终评价,需结合外界环境中田间抗性鉴定结果。
4 结 论
培养基附加黑胫病病菌毒素的鉴定方法具有较强的实用性,体积浓度为50%的毒素(含蛋白质13.53 µg/mL,含糖19.64 mg/mL)胁迫15 d时,通过对比分析烟草种子根系在毒素培养基上长进培养基中生长的株数比率,能够有效鉴定出不同品种(种质)对烟草黑胫病的抗感水平。该方法利用烟草种子可在短期内高效准确地的鉴定出不同品种(种质)对烟草黑胫病的抗感水平,并且不受其他杂菌影响和季节的限制,从而加快烟草抗黑胫病育种进程。
参考文献
LEE H H, KIM J S, HOANG Q T N, et al. Root-specific expression of defensin in transgenic tobacco results in enhanced resistance against var.[J]. European Journal of Plant Pathology, 2018, 151(3): 811-823.
郭璇,闫杏杏,蒋彩虹,等. 雪茄烟Beinhart1000-1對黑胫病0号生理小种的抗性遗传分析[J]. 中国烟草科学,2017,38(2):56-62.
GUO X, YAN X X, JIANG C H, et al. Genetic analysis of beinhart1000-1 resistance to black shank in tobacco[J]. Chinese Tobacco Science, 2017, 38(2): 56-62.
MCCORKLE K, LEWIS R, SHEW D. Resistance to var. in tobacco breeding Lines derived from variety beinhart 1000[J]. Plant Disease, 2013, 97(2): 252-258.
马国胜,高智谋. 烟草黑胫病菌培养性状的研究[J]. 中国农业科学,2007,40(3):512-517.
MA G S, GAO Z M. Cultural characteristics of var. , pathogen of tobacco blank shank[J]. Scientia Agricultura Sinica, 2007, 40(3): 512-517.
黄丽华,陈廷俊,宋军. 烟草黑胫病粗毒素高产培养条件的筛选[J]. 安徽农业科学,1999(4):368-370.
HUANG L H, CHEN T J, SONG J. Selection of cultural conditions for higher toxin from the black shank of tobacco[J]. Journal of Anhui Agricultural Sciences, 1999(4): 368-370.
孙计平,李雪君,吴照辉,等. 烟草黑胫病的研究进展[J]. 湖北农业科学,2011,50(16):3253-3256.
SUN J P, LI X J, WU Z H, et al. Progress on tobacco black shank disease[J]. Hubei Agricultural Sciences, 2011, 50(16): 3253-3256.
于海芹,刘勇,许美玲,等. 新引进烟草种质资源的黑胫病抗性鉴定[J]. 基因组学与应用生物学,2015,34(5):1027-1033.
YU H Q, LIU Y, XU M L, et al. Identification of resistance to black shank of new tobacco germplasm[J]. Genomics & Applied Biology, 2015, 34(5): 1027-1033.
于海芹,焦芳婵,肖炳光,等. 烟草种质资源苗期黑胫病抗性鉴定研究[J]. 中国农业科技导报,2008,10(4):70-75.
YU H Q, JIAO F C, XIAO B G, et al. Studies on identification of resistance to black shank disease of tobacco gemplasm resources in seeding stage[J]. Journal of Agricultural Science and Technology, 2008, 10(4): 70-75.
李梅云,刘勇,肖炳光,等. 烟草黑胫病抗性的漂浮苗鉴定方法[J]. 中国烟草科学,2014,35(1):76-79.
LI M Y, LIU Y, XIAO B G, et al. A float system resistant identification method of tobacco black shank[J]. Chinese Tobacco Science, 2014, 35(1): 76-79.
周向平,杨全柳,王锡春,等. 烟草品种(系)的烟草黑胫病抗性鉴定[J]. 作物研究,2013(6):637-639.
ZHOU X P, YANG Q L, WANG X C, et al. Resistance evaluation of tobacco varieties and tobacco lines to tobacco black shank disease[J]. Crop Research, 2013(6): 637-639.
申莉莉. 烟草突变体筛选与鉴定方法篇:2.烟草抗主要病虫害突变体的筛选与鉴定[J]. 中国烟草科学,2012,33(2):102-104.
SHEN L L. Screening and identification of tobacco mutants: 2. Screening and identification of tobacco resistance to major pests and diseases mutants[J]. Chinese Tobacco Science, 2012, 33(2): 102-104.
李梅云,李永平,刘勇,等. 抗黑胫病烟草种质资源的田间筛选[J]. 云南农业大学学报(自然科学版),2011,26(5):725-729.
LI M Y, LI Y P, LIU Y, et al. Screening of resistant tobacco germplasm to black shank disease in field[J]. Journal of Yunnan Agricultural University (Nat. Sci. Ed.), 2011, 26(5): 725-729.
王橋美,范静华,果志华,等. 烟草黑胫病菌毒素对烟草防御性相关酶的诱导作用[J]. 云南农业大学学报,2011,26(1):20-25.
WANG Q M, FAN J H, GUO Z H, et al. Induction effect of toxin extracts of on tobacco defense-related enzyme activities[J]. Journal of Yunnan Agricultural University, 2011, 26(1): 20-25.
时焦,孙丽萍,孟坤,等. 一种培养皿中筛选烟草抗赤星病种质材料的方法:中国,102876767 B[P]. 2013.01.16.
SHI J, SUN L P, MENG K, et al. A method for screening tobacco anti-amazing disease germplasm material in culture dish: CN, 102876767 B [P]. 2013.01.16.
丁燕芳,平文丽,孙计平,等. 烟草黑胫病抗性鉴定方法比较及其相关性分析[J]. 湖北农业科学,2017,56(18):3477-3480.
DING Y F, PING W L, SUN J P, et al. Comparison of methods to identify resistance to tobacco black shank disease and their correlation analysis[J]. Hubei Agricultural Sciences, 2017, 56(18): 3477-3480.
ZHANG Y S, GUO X, YAN X X, et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco ( L.) line Beinhart 1000-1[J]. The Crop Journal, 2018, 6(3): 282-290.
庞龙,黄河,周嘉平. 烟草黑胫病菌毒素的分离纯化与性质的研究[J]. 科学通报,1986,31(18):1416-1416.
PANG L, HUANG H, ZHOU J P. Isolation, purification and properties of toxin from tobacco black shank diseases[J]. Science Bulletin, 1986, 31(18): 1416-1420.
高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:140-148.
GAO J F. Plant Physiology Experiment Guide[M]. Beijing: Higher Education Press,2006: 140-148.
胡重怡,郑少清,陈兴江,等. 烟草无菌苗培养前的种子消毒技术研究[J]. 中国烟草科学,2007,28(2):45-51.
HU Z Y, ZHENG S Q, CHEN X J, et al. Methods for seed sterilization before aseptic tobacco seedling culture[J]. Chinese Tobacco Science, 2007, 28(2): 45-51.
晏娟,黎定军. 筛选烟草抗黑胫病细胞突变体的粗毒素浓度的初步研究[J]. 湖南农业科学,2011(5):66-68.
YAN J, LI D J. A primary study on screening crude toxin concentration for cell mutants of tobacco against black shank[J]. Hunan Agricultural Sciences, 2011(5): 66-68.
高崇,吴国贺,李佰霖,等. 延边烟区烟草菌核病病原菌鉴定及抗性种质筛选[J]. 中国烟草科学,2018,39(2):69-75.
GAO C, WU G H, LI B L, et al. Identification of tobacco sclerotinia rot in Yanbian and screening for resistant germplasms[J]. Chinese Tobacco Science, 2018, 39(2): 69-75.
叶协锋,张晓帆,郑宪滨,等. 复合盐碱处理下烤烟品种发芽特性及耐盐性评价[J]. 中国烟草科学,2017,38(3):37-43.
YE X F, ZHANG X F, ZHENG X B, et al. Germination characteristics of flue-cured tobacco varieties under mixed salt-alkali stresses and evaluations of their saline-alkali tolerance[J]. Chinese Tobacco Science, 2017, 38(3): 37-43.
