青鳞鱼蛋白酶解工艺及产物组分分析
2019-09-10俞益芹张焕新殷玲祁兴普董志俭
俞益芹 张焕新 殷玲 祁兴普 董志俭








摘要:以青鳞鱼鱼肉为原料,用风味蛋白酶对其进行水解处理制取水解蛋白质,通过单因素试验考察了酶解温度、加酶量、酶解时间、底物浓度、pH值等不同因素对青鳞鱼蛋白质水解物中游离氨基态氮含量和水解度的影响。在此基础上,采用Box-Behnken试验设计,优化了青鳞鱼水解蛋白质的制备工艺。结果表明:在水解温度50℃、pH值6.5、底物:水=1.O:1.9(质量比)、加酶量2 200 U/g、酶解时间300 min条件下,青鳞鱼蛋白质的水解度为14.82%,与理论预测值之间误差仅为0.29%,游离氨基态氮含量为1.946 mg/ml,表明采用响应面法优化得到的青鳞鱼蛋白质酶解工艺参数准确可靠。酶解产物主要由3- 19肽构成,占总酶解产物的71. 63%,其中2-4肽占总酶解产物的48. 6%。表明青鳞鱼鱼肉经风味蛋白酶水解时主要生成聚合度为2-4的小分子寡肽,风味蛋白酶对青鳞鱼蛋白质具有较强水解作用。
关键词:青鳞鱼;风味蛋白酶;氨基态氮;水解度
中图分类号:TS254
文献标识码:A
文章编号:1000-4440( 2019) 03-0701-08
青鳞鱼(Harengula zunast),硬骨鱼系,真骨总目,鲱形目,鲱科的一种,俗名“青皮”、“柳叶青”,属暖水性中上层低值鱼,是中国常见海产鱼种,主要分布于东海、黄海和渤海海域,资源丰富[1-2]。青鳞鱼肉虽然蛋白质含量高,但它体小多刺,脂肪及血和肉含量高,不宜鲜食,且不耐贮藏,是中国主要的低值海产品[3]。近年来,由于现代捕捞技术的推广,大中型鱼类资源逐年受到破坏,使得低值小杂鱼迅速繁殖,比重占到海洋捕捞产量的57% - 59%。由于食用价值低,用于食品加工的小杂鱼比重仅约1/3,大多制作为动物蛋白质饲料或工业原料等低值产品,资源价值未得到充分利用[4-5]。此外,因加工技术和回收手段落后,造成大量营养成分流失,产品的得率和附加值没有得到有效的提高,资源浪费严重并对环境造成污染[6]。因此,加大对低值鱼的深加工技术研究以提高其经济附加值对于充分利用水产资源有着非常重要的意义。目前,对青鳞鱼的应用研究主要集中在探讨酶法水解鱼肉提取浓缩鱼蛋白质、多肽以及制作鱼露等[7-11]终产物的技术研究,而针对酶水解工艺过程各种因素作用的详尽研究报告则相对较少[12-13],且不太完善。
风味蛋白酶是一种真菌蛋白酶/肽酶的复合体,在中性或微酸性条件下不仅能脱除蛋白质水解液的苦味,同时对蛋白质具有较强的水解能力,可以增进和改善水解液的风味[14-15]。本研究以青鳞鱼鱼肉为底物,以风味蛋白酶水解鱼肉制取水解蛋白质,探讨酶解反应中各因素对水解物中游离氨基态氮含量和水解度的影响,在此基础上,采用Box-Behnken试验设计,优化青鳞鱼水解蛋白质制备的最佳水解工艺参数,旨在为深入研究与利用青鳞鱼水解蛋白质提供参考,同时为低值海洋蛋白质的高值化开发利用提供基础。
1 材料与方法
1.1 试验材料与主要试剂
青鳞鱼,购自南通市水产品市场,鲜鱼清洗干净后人工取鱼肉片,去除鱼皮和黑膜;用冷水将鱼肉清洗干净,置于多孔筛网上沥干,然后用PVC袋按照1袋80 9进行封装,并于-18℃冰柜中保存备用。风味蛋白酶( Flavourzyme◎,24 000 U/g)购自诺维信(中国)投资有限公司,甲醛溶液、石油醚购自上海化学试剂公司,氢氧化钠、盐酸、硫酸钾,硫酸铜、硼酸均为分析纯(上海国药试剂有限公司产品),试验所用水均为蒸馏水。
1.2 试验仪器设备
S-3C型精密pH计购自上海精科雷磁有限公司,MA-45型水分测定仪购自北京赛多利斯仪器系统有限公司,BS323S型精密电子天平购自赛多利斯科学仪器(北京)有限公司,R502B型旋转蒸发器购自上海申生科技有限公司,78-1型磁力加热搅拌器购自常州国华电器有限公司,JJ-2型组织捣碎机购自舟山市淀海区海源仪器厂,CXJ-2型离心机购自上海离心机械研究所,DHG-9240A型电热恒温鼓风干燥箱购自上海精密实验设备有限公司。
1.3 分析方法
1.3.1 水分测定取适量鱼肉置于水分测定仪中,自动测定得出结果。
1.3.2 灰分含量测定参照GB 5009.4-2016《食品安全国家标准——食品中灰分的测定》测定灰分。
1.3.3 脂肪含量测定参照GB5009.6-2016中的索氏抽提法测定饮料中的脂肪含量(脂肪含量是粗脂肪)的方法测定。
1.3.4 蛋白质含量测定 参照GB5009.5 -2016测定蛋白质含量。
1.3.5 游离氨基态氮(AN)含量测定[16] 采用甲醛滴定法。取5 ml离心后的上清夜,置于100 ml容量瓶中,加蒸馏水定容,摇匀,吸取20 ml稀釋液于200ml烧杯中,加水60 ml。开磁力搅拌器,用0.05mol/L NaOH标准溶液标定至pH 8.20,再加入10ml甲醛溶液,继续用NaOH标准溶液标定至pH9. 20。相同条件下另做一组空白试验。按下列公式计算样品中游离氨基态氮的含量:
AN( mg/ml)=(V1-Vo )cx0.140 08xl00
(1)式中,c:NaOH的当量浓度;vl:滴定样品时消耗NaOH溶液的体积(ml);vo:滴定空白时消耗NaOH溶液的体积(ml);0.140 08:氮的毫克当量。
1.3.6 水解度(DH)测定[17]
DH=(B-C)/(A-C) xl00%
(2)式中,A:原料中总氨基氮含量;B:水解液中游离氨基氮含量;C:原料的游离氨基氮含量。
1.4 试验设计
1.4.1 单因素试验准确称取鱼肉10g(精确到0. 01g),分别置于250 ml烧杯中,加入40 ml蒸馏水,在60℃水浴锅中热处理10 min使鱼肉适度变性。待其冷却后,进行酶解试验。基于风味蛋白酶在其他蛋白质水解中的应用[18-19],单因素试验的基本条件设定为:反应温度50℃,pH 6.5,风味蛋白酶添加量1650 U/g,料水质量比1:4,反应时间240mm。反应完成后,100℃水浴5 min灭酶,测定游离氨基态氮及水解度。改变影响酶水解的其中一个因素,其他因素保持不变,分别考察反应温度、pH值、风味蛋白酶添加量、反应时间和底物含量对游离氨基态氮和水解度的影响,每组处理重复3次。
1.4.2 响应面分析法优化试验 在试验因素水平不多的情况下,为了得到全面完整数据,采用全面试验法:Response surface 3 -level factorial design[20]。根据单因素试验,选择酶解时间、料水质量比、加酶量3个对水解度(DH)有显著影响的因素,以水解度为响应值,应用Design Expert 6.0的3-level Factorial试验设计模块进行优化试验的设计及结果分析,因素水平见表1。
1.4.3 水解液各组分分子量测定 用Sephadex G一15柱(1.1 cm×50.0 cm)分析檢测[21]。以10mmol/L磷酸缓冲液(pH7.0)为洗脱液,流速为0.4ml/min,上样量为1 ml,QuadTecTM检测器检测,检测波长280 nm。标准样分别为L一酪氨酸(Mr=181.19)、AMP(Mr=347.2)、辅酶I(NAD,Mr=681.44)、短杆菌肽(Bacitracin zinc,Mr=1 486.2),用缓冲液配成5 g/L的溶液备用,用蓝葡聚糖2000测定柱外水体积Ve,然后由标准样的保留时间计算出相应的洗脱体积Vp,以相对分子质量的对数值(lgMr)为横坐标,Kav(有效分配系数)为纵坐标绘制标准曲线。
2 结果与分析
2.1 青鳞鱼的常规成分分析
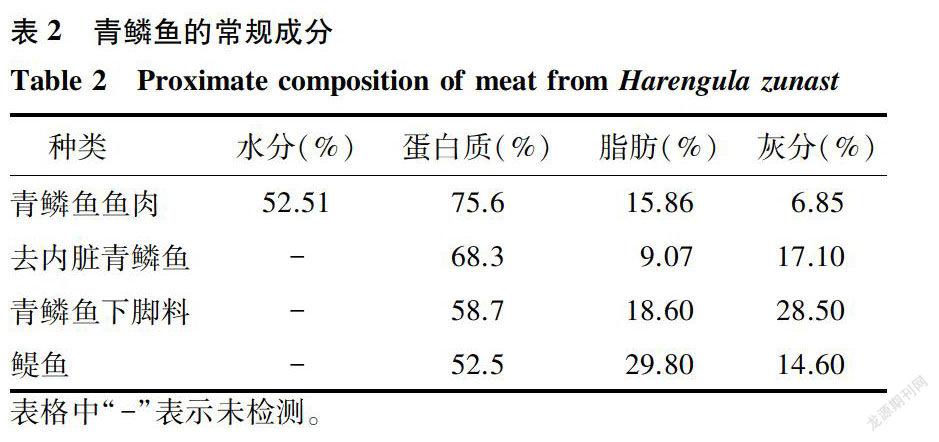
青鳞鱼鱼肉常规成分见表2,通过比较青鳞鱼鱼肉、去内脏青鳞鱼和青鳞鱼下脚料,可以看出随着青鳞鱼加工深度的提高,蛋白质、脂肪的含量增加,而灰分减少。蛋白质含量在鱼肉中所占的比率要大于内脏等其他部位。因此,鱼肉可以用来制造经济价值较高的水解蛋白质,而内脏等下脚料用来制造经济价值较低的鱼粉更为合适[22]。和另一种常见海洋低值鱼——鲲鱼相比,青鳞鱼蛋白质含量更高,其具有更好的经济价值[6]。
2.2 单因素试验
2.2.1 温度对酶解游离氨基态氮和水解度的影响
风味蛋白酶在40 - 65℃内水解青鳞鱼鱼肉时游离氨基态氮和水解度的变化如图1所示。由图1可知,在风味蛋白酶水解作用下,产物中游离氨基态氮含量和水解度呈现明显的相关性,在40 - 50℃内,游离氨基态氮含量(AN)和水解度(DH)均随温度升高而增加,当温度升高到50℃,AN和DH分别达到最大值1.225 mg/ml和8.77%。在50- 60℃,二者均呈下降趋势,原因主要是反应温度过高,酶分子的空间结构发生改变,次级键解离,导致酶活力下降[23]。同时,鱼肉蛋白质变性后,水解难度增加24]。因此,风味蛋白酶水解青鳞鱼鱼肉的最佳酶解温度为50℃。
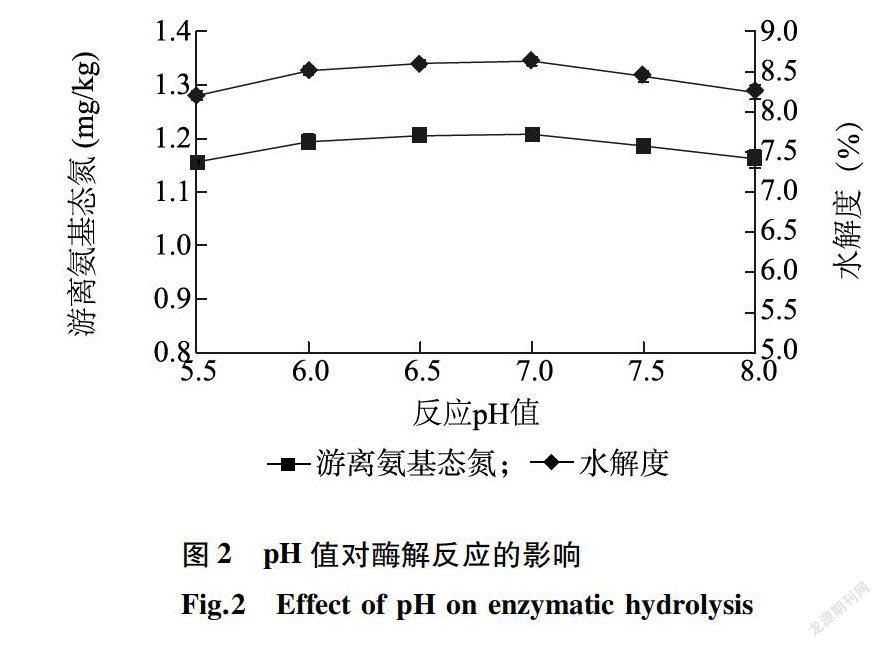
2.2.2 pH值对酶解游离氨基态氮和水解度的影响
在温度50℃,加酶量1 650 U/g,料水质量比1:4,时间240 min条件下,探讨pH对风味蛋白酶水解青鳞鱼鱼肉反应的影响,结果如图2。图2表明,在pH值5.5 -8.0,游离氨基态氮含量和水解度均变化不大,当pH值为7.0时,AN和DH分别达到最大值1.208 mg/ml和8.63%。总体来看,在试验选取范围内,pH值对风味蛋白酶水解青鳞鱼鱼肉反应的影响较小,最佳酶解pH值为7.0。
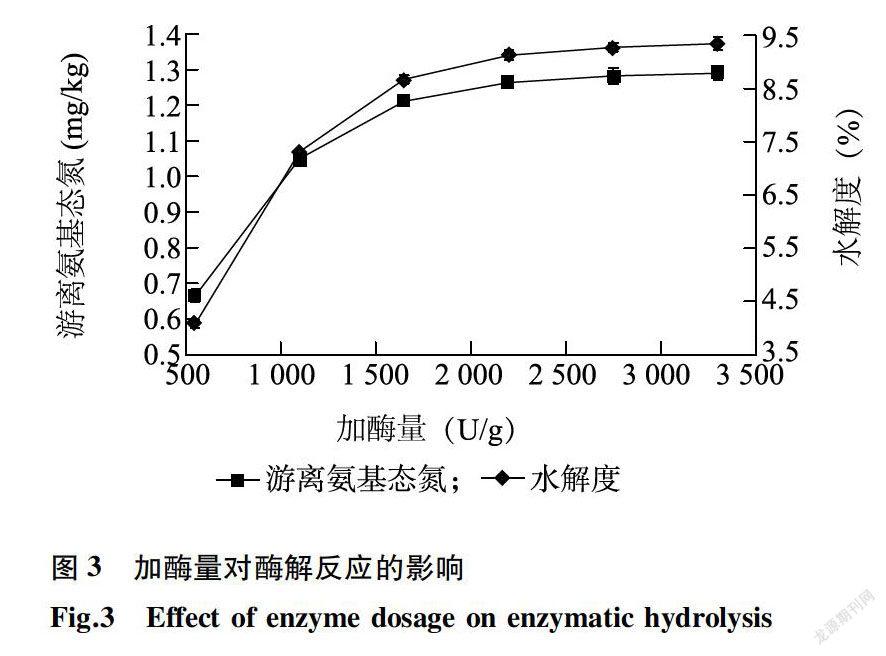
2.2.3 加酶量对酶解游离氨基态氮和水解度的影响在反应pH值6.5,温度50℃,料水质量比1:4,时间4.0 h条件下,探讨风味蛋白酶添加量对青鳞鱼鱼肉水解反应的影响,结果见图3。由图3可知,随着风味蛋白酶添加量的增加,水解度和游离氨基态氮同时增大。风味蛋白酶添加量由550 U/g增大至1 650 U/g时,水解曲线斜率增大迅速,表明反应速度增大,水解度和产物中游离氨基态氮含量快速提高;当风味蛋白酶添加量大于1650 U/g时,水解曲线斜率缓慢减小,表明反应速度降低,水解度和产物中游离氨基态氮含量增加缓慢。综合考虑得率与生产成本之间的关系,确定风味蛋白酶适宜添加量为1 650 U/g。
2.2.4 时间对酶解游离氨基态氮和水解度的影响
在pH值6.5,反应温度50℃,加酶量1 650 U/g,料水质量比1:4条件下,探讨反应时间对风味蛋白酶水解青鳞鱼鱼肉反应的影响,结果见图4。图4表明,随着酶解时间的延长,水解度逐渐增大,水解液中游离氨基态氮含量增加。反应时间从180 min延长至270 min,两者增幅较大。由此可见,反应时间延长使蛋白质水解为更多的小肽和游离氨基酸。从270 min到300 min水解度和水解液中游离氨基态氮含量增幅较小,反应时间至300 min时,AN和DH分别达到最大值1.398 mg/ml和10. 22%。而300 min到330 min时AN和DH都略有下降。因此,风味蛋白酶水解青鳞鱼鱼肉适宜的酶解时间为280 min。
2.2.5 料水质量比对酶解反应的影响 在pH值6.5,反应温度50℃,加酶量1650 U/g,时间240nun条件下,探讨料水质量比对风味蛋白酶水解青鳞鱼鱼肉反应的影响,结果见图5。图5表明,底物浓度对酶解反应的影响较大。料水比为1:2(质量比),AN和DH分别达到最大值1.736 mg/ml和13. 06%。料水质量比大于1:2后,随着加水量的增加,水解度和游离氨基态氮同时大幅度下降。因此,风味蛋白酶水解青鳞鱼鱼肉的适宜料水质量比为1:2。
2.3 酶解工艺参数的RSA优化
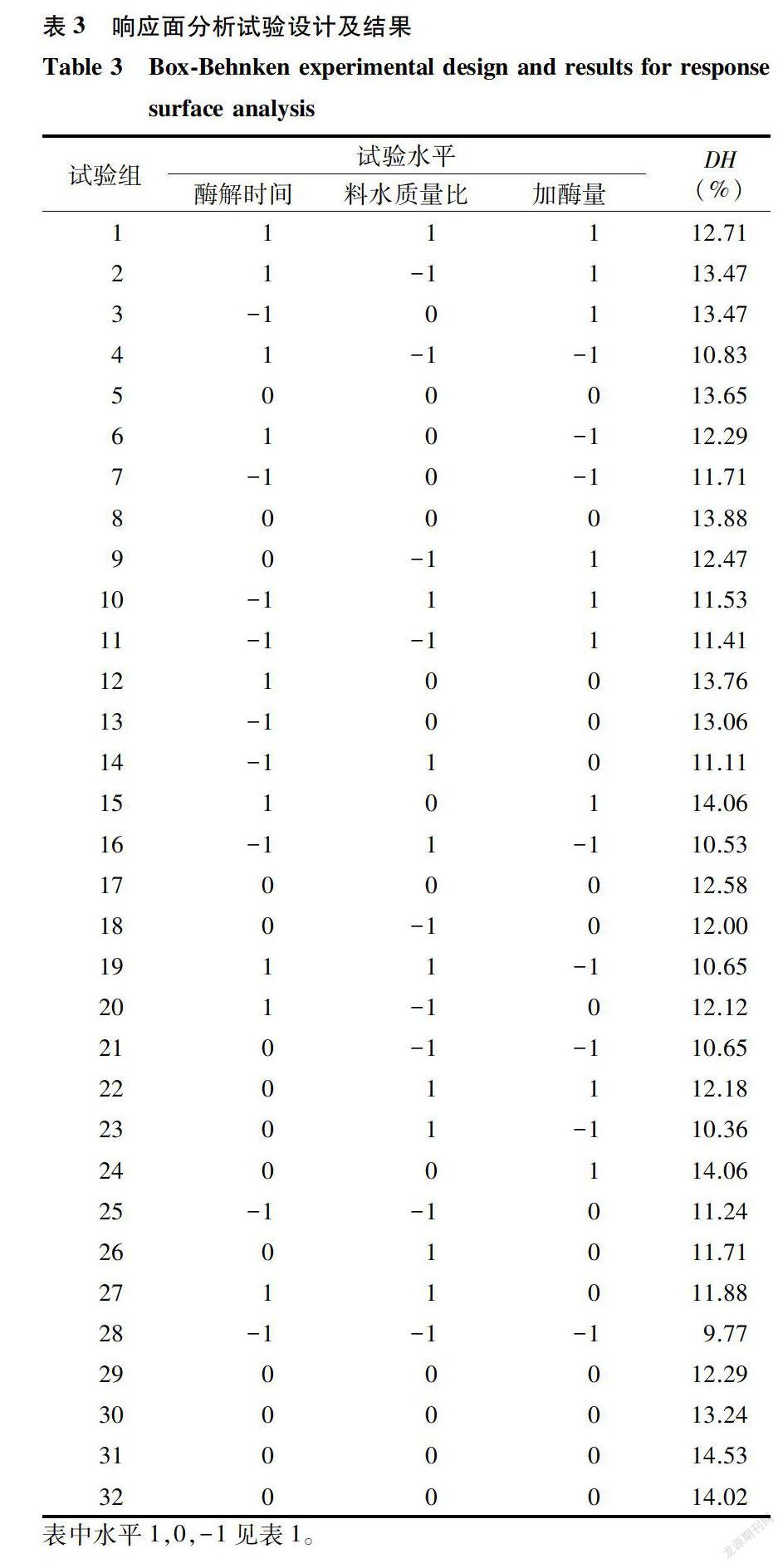
本试验选取对酶解反应影响较大的3个因素(酶解时间、料水质量比和加酶量)作为自变量,DH为响应值,采用响应面分析法在三因素三水平上对酶解反应条件进行优化,其他两因素条件固定为:温度50℃,pH7.O。试验设计及结果见表3。
试验组1- 28为析因试验,29-32为中心试验。32个试验点分为析因点和零点,其中析因点为自变量取值在X1、X2、X3所构成的三维顶点;零点为区域的中心点,零点试验重复4次,用以估计试验误差。采用RSA Quadratic Model对所得数据进行回归分析,回归分析结果见表4。
由表4可知:模型F值为38. 03,产生误差的可能性只有0.01%,具有显著性。“Prob>F”值小于0. 010 0,表明计算模型是高度显著的,可以利用该响应面近似模型进行后续的优化设计。在试验中A、C、B2和C2是显著的模型体系;“Prob>F”值大于0. 010 0表明该因素对模型计算影响不显著[25]。“失拟F值”为0. 10,“Prob>F”值大于0.05表明不显著,即该模型在被研究的整个回归区域内拟合较好,试验误差小[26],回归模型能充分说明酶解工艺过程。
对各因素进行回归拟合,得回归方程:
DH=13. 590+0.440A -0.072B+0.900C -0. 2IOA—1. 700B—0. 400C22—0. 160AB+0.170AC -0. 1OOBC
(3)
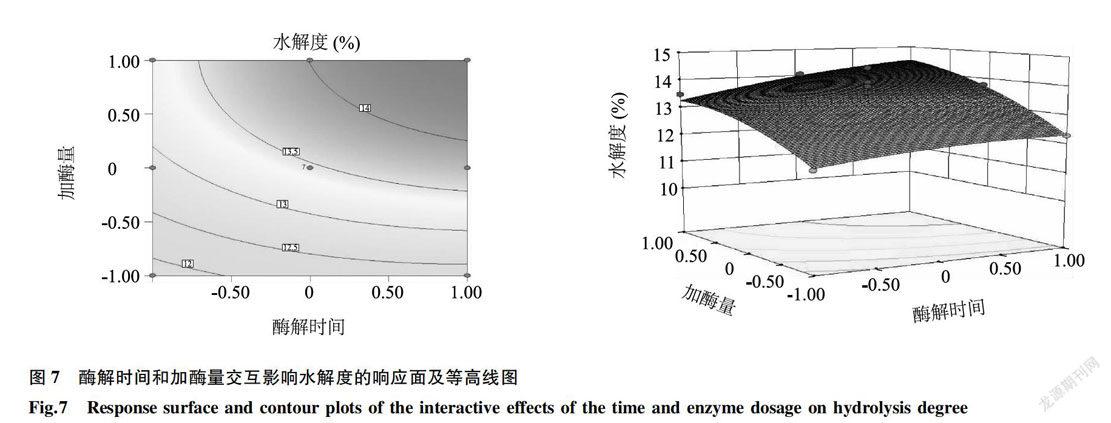
為了直观表示各因素对响应值的影响,并反映最佳优化条件,作出响应面图和等值线图(图6、图7、图8)。
图6-图8直观地反映了各因素对水解度的影响,由等值线图可以看出存在极值的条件应该在弧形内侧。比较3组图可知,加酶量(C)对水解度的影响最为显著,表现为曲面较陡;而酶解时间(A)次之;料水质量比(B)影响最小,表现为曲面较为平滑,随数值的增加或减少,其响应值变化较小。
在因素水平范围内,进一步确定最佳点的值,运用优化程序“Optimization”求解最佳点,解得:A=1. 00,B=-0.01,C=1. 00,即风味蛋白酶水解青鳞鱼鱼肉的最佳酶解时间为300 min,最佳料水质量比为1.0:1.9,最佳加酶量为2 200 U/g。在此条件下,酶解反应的鱼肉蛋白水解度DH的理论值可达14.51%。
2.4 最佳工艺条件下的酶解
为检验RSA分析法的可靠性,采用上述最佳提取条件进行酶解试验,酶解条件为pH7.0,温度50℃,加酶量2 200 U/g,料水质量比1.0:1.9,时间300 min,同条件下多次重复试验以减少误差,试验结果见表5。
由表5可知,实际测得青鳞鱼蛋白质水解度平均值为14.82%,与理论预测值14.51%相比误差小于0.5%;实际测得游离氨基态氮含量为1.946mg/ml。表明采用RSA分析法优化得到的水解条件参数准确可靠。在上述的工艺流程和试验确定的工艺条件下,用风味蛋白酶对青鳞鱼鱼肉水解处理,制得的浓缩鱼蛋白质具有如下特性:色泽为白色至灰白色,固体疏松无结块,无腥臭味,易溶于水,口感不苦有鱼肉的鲜味,表明此工艺具有较高实用价值。
2.5 酶解物组分分析
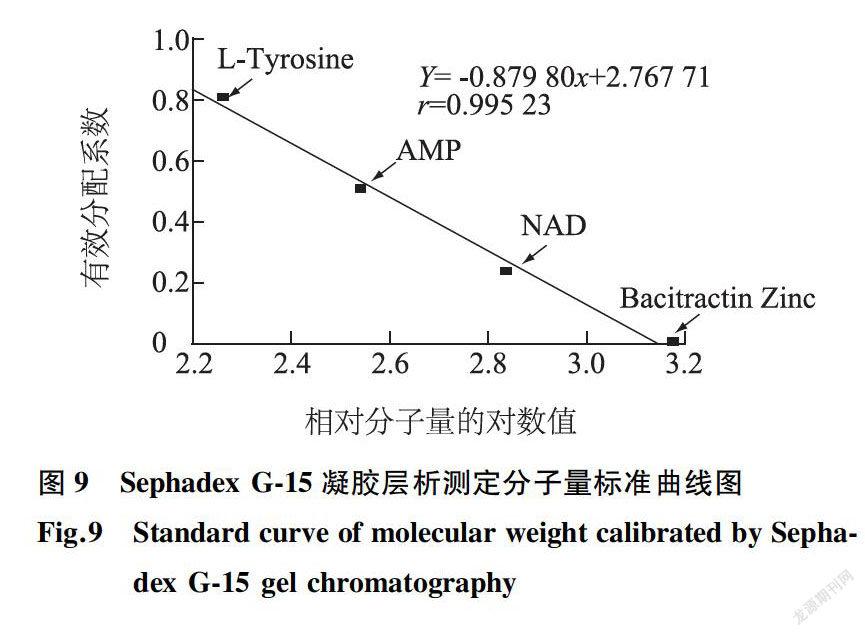
2.5.1 标准曲线的绘制 测得Sephadex G-15柱的Vc为14. 98 ml,柱床体积为47. 50 ml,由各标准物的保留时间计算出相应的vP,进而计算出有效分配系数Kav,制作标准曲线(图9)。由图9可见,Kav(有效分配系数)与相对分子质量的对数值(lgMr)呈线性关系,回归方程为Y= -0. 879 80x+2.767 71,r=0. 995 23,其中x为相对分子质量的对数值,y为有效分配系数,标准曲线的线性相关系数为0. 995 23,说明线性关系很好,可以根据此回归方程计算出待测样品的相对分子质量27]。
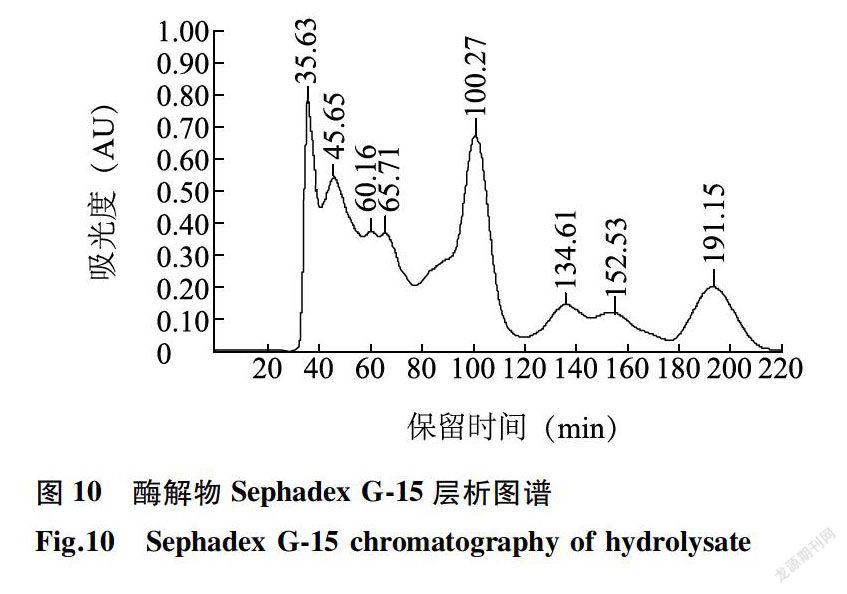
2.5.2 酶解物分子质量分布 取待测酶解液2 ml利用Sephadex G-15凝胶柱层析分离,流速为0.4ml/min,每管收集2 ml,由此得到洗脱峰(图10)。由图10可知,青鳞鱼鱼肉经风味蛋白酶水解后产生不同分子质量的多肽类物质。酶解样品经过Sephadex G-15凝胶分离后出现8个明显的洗脱峰,根据标准曲线可以计算出8个峰值处的分子质量及含量,分别为1484.72(14. 91%)、1 075.34(5.22%)、674. 00(0.70%)、563. 72(1.94%)、185. 28( 48. 86%)、61. 33(5.91%)、34. 45(2.88%)和9. 93( 20. 23%)。酶解蛋白质分子质量为185. 28 -1 484. 72,酶解产物中主要由小分子的肽(3-19肽)构成,占酶解产物总量的71. 63%;其中2-4肽(分子质量185. 28)占酶解产物总量的48. 86%,由此可见青鳞鱼肉经风味蛋白酶水解后的主要产物为聚合度为2-4的小分子寡肽。氨基酸残基最小为57,平均分子质量为61. 33,酶解产物代表游离氨基酸,占酶解产物总量的5. 91%;而平均分子质量34. 45和9.93洗脱峰的出现表明酶解产物还含有其他杂质和非氨基酸残基类物质[28-30]。
3 结论
通过单因素试验,考察了不同因素对风味蛋白酶水解青鳞鱼鱼肉效果的影响,研究结果表明,在试验选取的因素水平范围内,结果表明反应温度和pH值对酶解效果影响较小,酶解时间、料水质量比和加酶量对酶解效果影响较大;应用响应面试验设计优化的酶解工艺:pH值7.0、酶解温度50℃、加酶量2 200 U/g、酶解时间300 min、料水质量比1.0:1.9,在此条件下,游离氨基态氮含量和水解率分别可达1. 946 mg/ml和14. 82%,且以青鳞鱼鱼肉为原料制得的浓缩鱼蛋白质具有良好的感官特性。酶解产物主要由3- 19肽构成,占总酶解产物的71. 63%;其中2-4肽占总酶解产物的48. 86%。表明青鳞鱼鱼肉经风味蛋白酶水解时主要生成聚合度为2-4的小分子寡肽,风味蛋白酶对青鳞鱼蛋白质具有较强水解作用。
参考文献:
[l]王杏珠,青鳞鱼加T和利用的研究[J].水产科技情报,1995,16(1):28-32.
[2]邓尚贵,杨萍,青鳞鱼肌肉蛋白复合酶水解机制研究[J].食品科学,2004,25(3):67-75.
[3] 范蘊莹,不同种类低值鱼酶解效果的比较及优化[J].现代食品科技,2012,28(7):814-818.
[4]段蕊,张俊杰,海洋低值小杂鱼的加工方向和现状[J].食品与发酵工业,2000,26(6):53-56.
[5]张海莲.浅谈海洋低值小杂鱼的综合利用[J].河北渔业,2005 (4):7-8.
[6] 师晓栋,何海伦,王运涛,等,酶法进行海洋低值蛋白资源高值化利用初探[J].海洋科学,2001,25(3):4-7.
[7] 杨萍,邓尚贵,吴玉廉,蛋白酶及其作用方式对制取青鳞鱼肉水解蛋白的影响[J].食品与发酵工业,2003,29(4): 91-94.
[8]杨萍,邓尚贵.木瓜蛋白酶在制取青鳞鱼可溶性蛋白中的应用[J].广东海洋大学学报,2002,22(3):38-41.
[9]
DENC S G,YANG P,YANG Z J,et al-Conditions and hydroly-sate of the enzymolysis of harengula zunasiB muscle proteins byflavorease[J].Journal of Zhanjiang Ocean University, 2004, 24(1):20-27.
[10] DENG S G,PENG Z Y,CHEN F,et al.Amino acid compositionand anti-anaemia action of hydrolyzed offal protein from HarengulaZunasi, Bleeker[J].Food Chemistry, 2004, 87(1):97-102.
[11]常志娟,邓尚贵,青鳞鱼水解蛋白复合果味酸奶的研制[J].饮料工业,2008,11(2):35-38.
[12] KAWACUTI S,KAMISHIMA Y.Electron microscopy on the blueback of a clupeoid fish, harengula zunasi[J].Proceedings of theJapan Academy, 2006, 42(4):389-393.
[13]曹文红,冯思涛,莫敏婷,等,青鳞鱼酶解工艺正交优化及其产物分子量分布的研究[J].食品科技,2013(4):130-135.
[14]郭晶晶,马海乐,程宇,等,风味蛋白酶水解草鱼肉的试验研究[J].食品工业科技,2014,35( 13):248-252.
[15]邵俊杰,朱昱璇,黄鸿兵,等,不同蛋白酶酶解河蚬蛋白的比较[J].江苏农业学报,2017,33(4):921-926.
[16]候曼玲,食品分析[M].北京:化学工业出版社,2004:76-77.
[17] WALSH D J,CLEARY D, MCCARTHY E, et al-Modification ofthe nitrogen solubility properties of soy protein isolate followingproteolysis and transglutaminase cross-linking[J].Food ResearchInternational, 2003, 36(7):677-683.
[18]陈杰,马美湖,风味蛋白酶水解蛋清工艺条件的研究[J].现代食品科技,2007,23(7):43-44.
[19]刘爽,夏杨毅,尚永彪,鸡蛋蛋清蛋白酶解产物的研究进展[J].食品科学,2013,34(15):409-414.
[20]汪怀建,谭文津,丁雪杉,等,超声波辅助提取玉米芯中木聚糖条件优化研究[J].中国粮油学报,2009,24(7):50-54.
[21]陈爱瑛,贾建萍,叶小弟,等,鱼皮胶原蛋白水解液中小分子寡肽的分子量分布测定[J].中国现代应用药学,2011,28(2): 160-162.
[22]张俊杰,段蕊.高蛋白鱼粉的加工[J].淮海工学院学报(然科学版),2000,9(2):44-46.
[23]吉挺,张焕新,殷玲.油菜蜂花粉多肽饮料的研制及抗氧化活性评价[J].食品与发酵工业,2016,42(8):135-141.
[24]常志娟.采用复合酶水解青鳞鱼蛋白及水解产物特性研究[D].湛江:广东海洋大学,2005.
[25]李莉,张赛,何强,等,响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[26] KUMAR A, PRASAD B, MISHRA I M. Optimization of processparameters for acrylonitrile removal by a low-cost adsorbent usingBox-Behnken design.[J].Journal of Hazardous Materials, 2008,150(1):174-182.
[27]姚东瑞,盘赛昆,周鸣谦,等,菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽的研究[J].食品科学,2012,33(1):180-185.
[28]马永强,赵毅,大豆蛋白水解物中肽分子分布的研究[J].中国粮油学报,2001,16(3):15-17.
[29]刘文斌,尹君,王恬,棉粕蛋白及其枯草蛋白酶酶解产物的组分分析[J],食品与发酵T业,2005,31( 11):105-108.
[30] WANG J, HU J, CUI J, et al.Purification and identification of aACE inhibitory peptide from oyster proteins hydrolysate and the an-tihypertensive effect of hydrolysate in spontaneously hypertensiverats[J].Food Chemistry, 2008, 111(2):302-308.
