越橘原花青素合成相关基因VcLAR和VcANR的克隆和功能鉴定
2019-09-10宋杨刘红弟王海波张红军刘凤之
宋杨 刘红弟 王海波 张红军 刘凤之



摘要:本研究以越橘(Vaccinium corymbosum Duke)为试验材料,克隆原花青素合成基因VcLAR和VcANR,分析其表达模式及其对水杨酸和茉莉酸甲酯的响应,鉴定其在原花青素合成过程中的作用。结果表明,成功获得了越橘VcLAR(CenBank登录号为MH321470)和VcANR(CenBank登录号为MH321471)基因。VcLAR和VcANR在根、茎、幼叶、花以及不同发育阶段果实中均可表达,但相对表达量存在差异,在绿果中的相对表达量最高。在不同发育阶段果实中,原花青素含量在绿果中最高,在蓝果中最低。水杨酸处理可促进VcLAR和VcANR基因的表达,茉莉酸甲酯处理可抑制VcLAR和VcANR基因的表达。在转VcANR基因拟南芥株系中,原花青素的含量显著高于野生型。在转VcLAR基因拟南芥株系中,原花青素含量与野生型相比无明显变化。由此推测,VcLAR和VcANR在越橘果实原花青素积累过程中发挥重要作用,并受水杨酸和茉莉酸甲酯的调控。
关键词:越橘;VcLAR基因;VcANR基因;水杨酸;茉莉酸甲酯;原花青素
中图分类号: S663.9
文献标识码:A
文章编号: 1000-4440( 2019) 03-0682-07
越橘亦称蓝莓,其果实中含有丰富的黄酮类化合物,原花青素是黄酮类化合物的重要组成部分,在提高植物抵御逆境胁迫能力和提高人体免疫力等方面具有一定作用[1-3]。明确越橘果实中原花青素的代谢调控机理对果实品质改良具有重要意义。
植物黄酮类化合物合成途径起始于苯丙氨酸代谢,在此过程中有许多结构基因和调控基因参与原花青素的生物合成。其中,具有NADPH结合域的花青素还原酶(ANR)和无色花青素还原酶(LAR)是原花青素生物合成途径中的关键酶,能够催化无色花青素生成原花青素。目前,已经在许多植物中发现了ANR和LAR基因,其表达变化与原花青素积累情况紧密相关[4-5]。
国内外已有多位学者对越橘中原花青素等黄酮类化合物的合成调控机理进行了研究。有学者利用de novo转录组测序技术,分析了黄酮类化合物合成相关基因在越橘果实不同发育时期及其在果皮和果肉中的差异表达情况[6-8]。Zifkin等[9]建立了越橘果实不同发育阶段的表达序列标签( EST)数据库,并分析了原花青素和花青素合成途径中关键基因在各个时期的表达情况,指出脱落酸对于越橘果实中花青素的生物合成和果实成熟非常重要。目前,对越橘原花青素的合成机理知之甚少,ANR和LAR基因与越橘果实中原花青素生物合成是否相关还不清楚。本研究拟从越橘中分离并鉴定VcLAR和VcANR基因,通过表达模式和转基因分析,阐释他们在原花青素生物合成过程中的重要作用,以期为越橘果实黄酮类化合物代谢调控机制的研究奠定基础。
1 材料与方法
试验于2016年7月- 2018年4月在中国农业科学院果树研究所(辽宁省兴城市)进行。
1.1 试验材料
试验所用的材料为7年生越橘(Vacciniumcorymbosum Duke)。选取长势一致的越橘植株,分别采集花后40 d(绿果)、60 d(粉果)和75 d(蓝果)花絮顶端的果实,采后立即用液氮速冻,-70℃保存。使用浓度为10 mmol/L的水杨酸(SA)和50μmol/L的茉莉酸甲酯(MejA)处理长势一致的花后40 d果实,分别在处理后Oh、3h、6h、9h取样,液氮速冻后保存,清水处理为对照。用野生型拟南芥(Arabidopsis ecotype Columbia)进行遗传转化试验。
1.2 基因克隆和序列分析
根据在越橘转录组数据库(Song等[10])中获得的序列来设计引物VcLAR-F/R和VcANR-F/R,扩增开放读码框序列( ORF),引物序列如表1显示。以Duke越橘果实的cDNA为模板,进行PCR扩增。PCR反应程序为:95℃预变性5.0 min;95℃变性30.0 s,57℃退火30.0 s,72℃延伸1.5 min,30个循环;72℃延伸10.0 min。PCR产物用1.2%琼脂糖凝胶电泳,回收目的条带,连接到克隆载体pEASTblunt zero进行测序。
利用软件CLC Sequence Viewer 6分析VcLAR和VcANR蛋白的保守序列。采用软件MEGA 5引人多个物种的LAR和ANR蛋白,对VcLAR和VcANR蛋白进行聚类分析。
1.3 RNA的提取与实时荧光定量qRT-PCR分析
采用TaKaRa公司的植物总RNA提取试剂盒( Code No.9769)提取越橘果实的RNA。以提取的RNA為模板,反转录合成cDNA。用普通PCR进行序列验证,目的基因经PCR扩增、回收、转化大肠杆菌后,由华大基因完成测序。基因序列确定后,进行实时荧光定量qRT-PCR分析。以VcGAPDH为管家基因,计算其他基因在越橘中的相对表达量。以拟南芥AtUBQlO为管家基因,计算VcLAR和VcANR在转基因拟南芥和野生型拟南芥中的相对表达量。使用仪器为Bio-Rad公司的CFX Connect PCR system,所用试剂为ThermoFisher公司的PowerUpnvr SYBRRGreen Master Mix( Code No.A25742)。所有PCR均设3个重复。反应体系:SYBR Mixture 10.0μl,cDNA 2.0μl,上、下游引物各0.5μl,加去离子水至20.0μl。PCR反应程序:95℃预变性2 min;95℃变性15 s,58℃退火15 s,72℃延伸1 min,40个循环,在每次循环的第2步进行荧光采集。最后采用2-△△Ct法分析定量数据。实时荧光定量qRT-PCR引物见表1。
1.4 原花青素含量测定
参照文献[11]的测定方法,使用高效液相色谱法测定越橘3个发育时期果实中的原花青素含量。拟南芥种子中原花青素的测定:称取0.5g样品,液氮研磨,加入1.0 ml 70. 0%丙酮溶液(含0.1%抗坏血酸),4℃黑暗条件下静置30 min,离心后取上清液,沉淀中再加入1.0 ml 70.0%丙酮溶液,4℃条件下静置30 min,离心后取上清液,合并2次上清液,加入3.0 ml乙醚,- 20℃条件下静置1h。取2.0ml下层相,加入1.0 ml甲醇和0.5 ml 2.0%的4-=甲基氨基肉桂醛(4-dimethylaminocinnamaldehyde,DMACA)染色液,于室温下静置20 min,用紫外分光光度计在643 nm处测量吸光度。定量标准品为儿茶素( Catechin)。
1.5 拟南芥转化和鉴定
构建VcLAR-pRII01和VcANR-pRIl01过量表达载体,将这2个重组载体分别转化至农杆菌GV3101,利用农杆菌侵染花序法分别转化野生型拟南芥。在含有卡那霉素的MS( Murashige and skoog)固体培养基上筛选T1代转基因植株。将抗性苗移栽至基质中,并置于光照培养箱中培养,收获的T2代种子用于试验。载体构建时使用的引物见表1。
1.6 统计学分析
每个试验设3个重复,使用SPSS软件进行显著性分析。
2 结果与分析
2.1 越橘VcLAR和VcANR基因的克隆、编码的蛋白质结构域及进化树分析
通过RT-PCR技术分别获得2条约1100 bp和1 000 bp的条带。对克隆所得片段进行测序分析,结果显示,VcIAR和VcANR基因的ORF长度分别为1 056 bp和1 002 bp,分别编码含有352个和334个氨基酸的蛋白质。
使用软件CLC Sequence Viewer 6分析越橘VcLAR和VcANR蛋白及其他植物LAR和ANR蛋白的保守结构域。结果(图1)显示,VcLAR和VcANR是短链脱氢/还原酶超家族成员,均包含NADPH结合域。
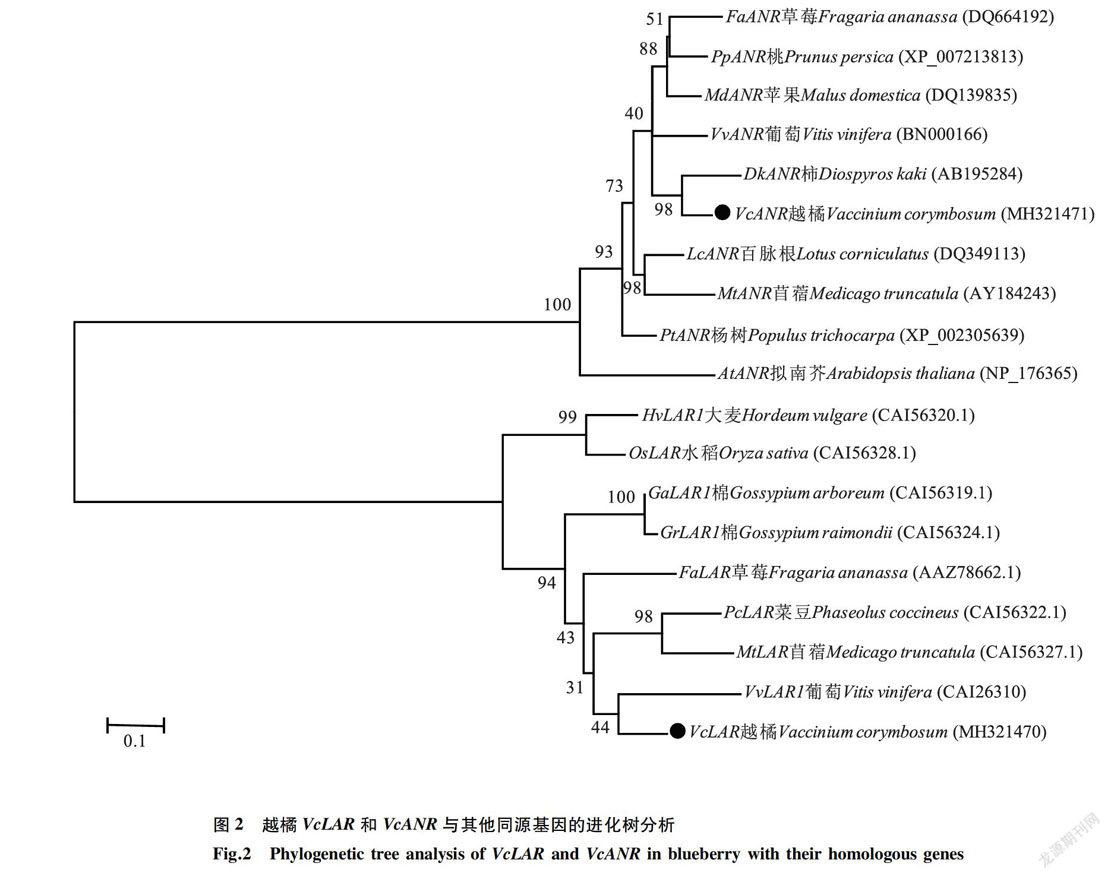
将VcLAR和VcANR蛋白序列与拟南芥、葡萄、苹果、柿等多个不同物种的LAR和ANR蛋白序列进行分析并构建进化树。进化树分析结果(图2)表明,越橘的VcLAR和VcANR分别与葡萄的VvLAR1和柿的DkANR同源性最高。
2.2 VcLAR和VcANR基因的表达分析
利用实时荧光定量qRT-PCR分析VcLAR和VcANR在越橘不同植物器官以及在果实不同发育时期的表达情况。结果(图3)显示,VcLAR在绿果中的相对表达量最高,在粉果中的相对表达量次之,在蓝果中的相对表达量最低。VcANR在绿果中的相对表达量最高,在根中的相对表达量次之,在花托中的相对表达量最低。
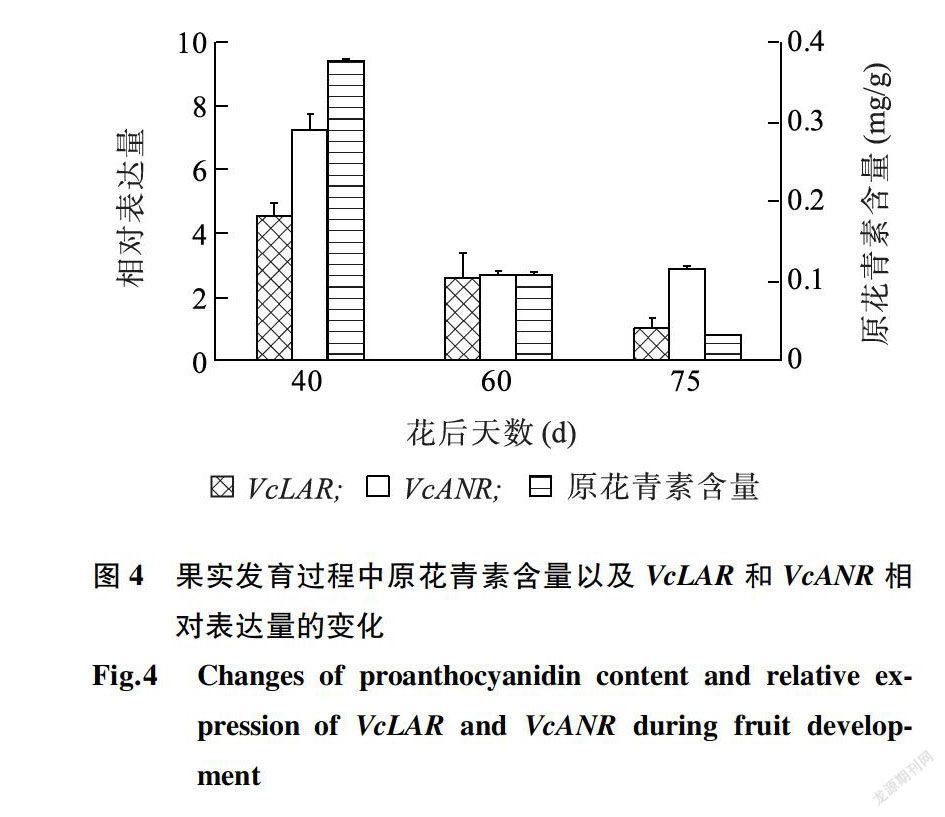
图4显示,在果实发育过程中,花后40 d的绿果中,原花青素含量最高,随着果实成熟,原花青素含量持续下降。VcLAR相对表达量的变化趋势与原花青素含量的变化趋势相似,VcANR的相对表达量呈先急剧下降后略有上升的趋势。说明,VcLAR和VcANR相对表达量的下调与原花青素含量的减少有一定关系。
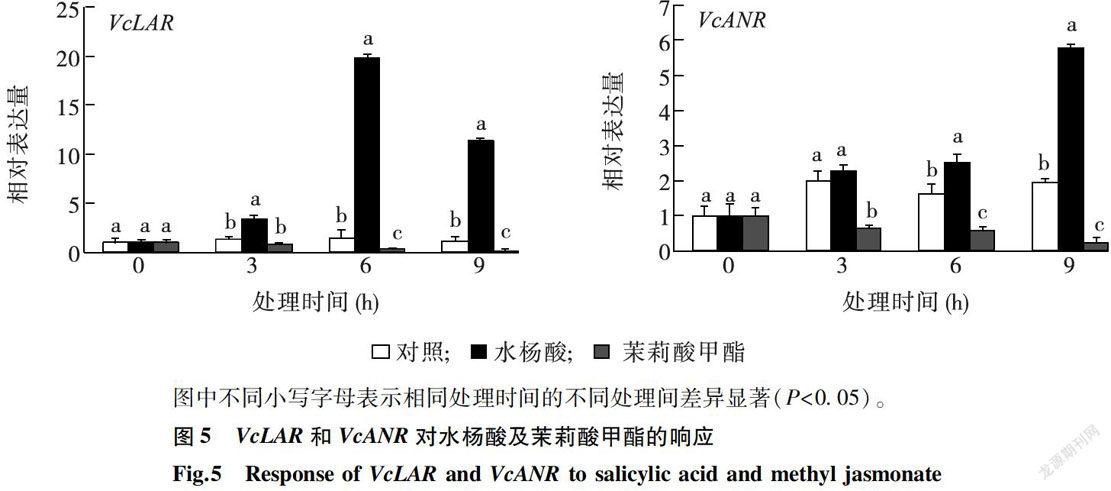
采用实时荧光定量qRT-PCR分析VcLAR和VcANR对水杨酸和茉莉酸甲酯的响应,结果(图5)表明,在水杨酸( 10 mmol/L SA)处理下,随着处理时间的延长,VcLAR的相对表达量先升高后降低,但始终高于对照,在处理后6h达到最大。VcANR在水杨酸的诱导下,相对表达量持续升高。在茉莉酸甲酯( 50μmol/L MejA)处理下,VcLAR和VcANR的相对表达量均低于对照。
2.3 VcLAR和VcANR的过量表达对原花青素含量的影响
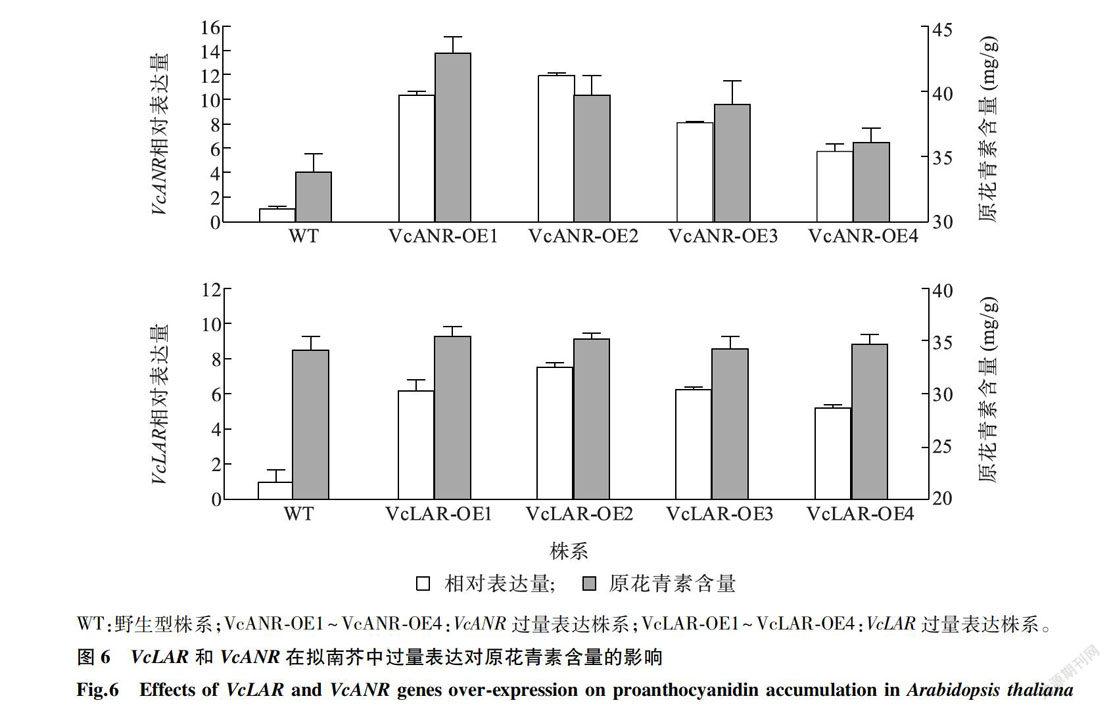
为进一步研究VcLAR和VcANR的功能,分别构建了VcLAR和VcANR的植物过量表达载体。用重组表达载体转化农杆菌GV3101,利用农杆菌介导的遗传转化方法侵染野生型擬南芥,分别获得4个转基因株系。图6显示,在转VcANR基因拟南芥株系中,VcANR的相对表达量显著高于野生型,转基因株系中原花青素的含量显著高于野生型。在转VcLAR基因拟南芥株系中,VcLAR的相对表达量显著高于野生型,转基因株系中原花青素含量与野生型相比无显著变化。
3 讨论
越橘在中国的种植面积和产量稳步增长[12]。越橘果实中含有丰富的原花青素,作为一种重要的次生代谢产物,在植物抗逆及清除人体内自由基等方面起重要作用[13-16]。
LAR和ANR基因是调控植物原花青素合成的关键基因。本研究分离获得的VcLAR和VcANR基因属于典型的短链脱氢/还原酶超家族基因,编码的蛋白质含有保守的NADPH结合域。越橘的VcLAR和VcANR分别与葡萄的VvLAR1和柿的DkANR同源性最高,说明VcLAR和VcANR可能与葡萄、柿及其他物种中的同源基因具有相似的生物学功能。原花青素的生物合成受多种植物激素的影响[17]。虽然前人的研究结果表明,植物激素可调节花青素、原花青素和黄酮醇等类黄酮物质的合成[18-19]。但是,水杨酸和茉莉酸甲酯在调节原花青素合成过程中的作用及分子机制还不清晰。本研究发现,在果实发育过程中,VcLAR相对表达量的变化趋势与原花青素含量的变化趋势相似。VcLAR和VcANR对水杨酸和茉莉酸甲酯处理均有明显响应。水杨酸处理下,随着处理时间的延长,VcLAR的相对表达量呈先升高后降低的趋势,VcANR的相对表达量持续升高。茉莉酸甲酯处理下,VcLAR和VcANR的相对表达量均低于对照。通过在拟南芥中过量表达VcANR,发现转基因植株种子中原花青素的积累显著高于野生型,而过量表达VcLAR拟南芥植株中原花青素含量与野生型相比无显著变化。
对很多植物的研究结果表明,R2R3-MYB、bHLH( basic helix-loop-helix)和WD40( WD-repeatprotein)蛋白质复合体可调控/AR和ANR的转录,从而影响原花青素的合成[20-21]。越橘中是否存在这样的调控模式?后期将通过酵母杂交和电泳凝胶迁移率试验,筛选以VcLAR和VcANR为靶基因的转录因子,进一步解析越橘原花青素的合成途径。
参考文献:
[1]BASU A,RHONE M,LYONS T J.Berries: emerging impact oncardiovascular health[ J]. Nutrition Reviews, 2010. 68(3):168-177.
[2]GORDILLO G,FANG H. KHANNA S,et al.Oral administrationof blueberrv inhibits angi0genic tumor growth and enhancessurvival of mice with endothelial cell neoplasm[J].Antioxidants&Redox Signaling, 2009, 11(1):47-58.
[3]张宇,张丙秀.魏媛媛,等,土壤pH值对蓝莓叶片生理生化的影响[J].江苏农业科学,2017 ,45( 13):107-109.
[4]BOCS J,DOWNEY M O, HARVEY J S,et al-Proanthocvanidinsynthesis and expression of genes encoding leucoanthocvanidin re-ductase and anthocvanidin reductase in developing grape berriesand grapevine leaves[ J]. Plant Physiology, 2005, 139( 2): 652-663.
[5]PAOLOCCI F,ROBBINS M P,MADEO L,et al-Ectopic expres- sion of a basic helix-loop-helix gene transactivates parallel pathwaysof proanthocyanidin biosynthesis. structure, expression analysis,and genetic control of leucoanthocyanidin 4-reductase and anthocy-anidin reductase genes in Lotus corniculatus [ J] . Plant Physiology ,2007 , 143 ( 1) : 504-516.
[6]11 X, SUN H, PEI J, et al. De novo sequencing and comparativeanalysis of the blueberry transcriptome to discover putative genesrelated to antioxidants[ J] . Gene, 2012, 511( 1) : 54-61.
[7] SUN H, LIU Y, GAI Y, et al. De novo sequencing and analysis ofthe cranberry fruit transcriptome to identify putative genes involvedin flavonoid biosynthesis, transport and regulation [ J] . BMC Ce-nomics, 2015, 16( 1) : 652.
[8] L1 1, ZHANG H, LIU Z, et al. Comparative transcriptome se-quencing and de novo analysis of Vaccinium corymbosum duringfruit and color development [ J]. BMC Plant Biology, 2016, 16
[9]ZIFKIN M, JIN A, OZGA J A, et al. Gene expression and metab-olite profiling of developing highbush blueberry fruit indicates tran-scriptional regulation of flavonoid metabolism and activation of ab-scisic acid metabolism [J] . Plant Physiology, 2012, 158 ( 1 ) :200-224.
[10] SONG Y, LIU H D, ZHOU Q, et al. High-throughput sequencing of highbush blueberry transcriptome and analysis of basic helix-loop-helix transcription factors [ J ] . Journal of Integrative Agricul-ture, 2017 , 16( 3) : 591-604.
[11] PRIOR R L, LAZARUS S A, CAO G, et al. Identification of pro-cyanidins and anthocyanins in blueberries and cranbemes ( Vaccin-iLtm spp.) using high-performance liquid chromatography/massspectrometry [J] . Journal of Agricultural and Food Chemistry,2001, 49( 3) : 1270-1276.
[12]李亞东,孙海悦,陈丽,我国蓝莓产业发展报告[J],中国果树,2016(5):1-10.
[13]曹森,王瑞,趙成飞,等.采前喷施哈茨木霉菌对采后蓝莓贮藏品质及生物活性的影响[J].江苏农业学报,2017,33(2):424-431.
[14]NETO C C.Cranberry and blueberry: evidence for protective effectsaWinst cancer and vascular diseases[J].Molecular Nutrition&Food Research, 2007, 51(6):652-664.
[15] RENDEIRO C,VAUZOUR D, KEAN R J,et al-Blueberry sup-plementation induces spatial memory improvements and region-spe-cific regulation of hippocampal BDNF mRNA expression in youngrats[J].Psychopharmacology, 2012, 223(3):319-330.
[16]尉莹莹,梁晨,赵洪海,等,华东地区蓝莓采后病害病原鉴定及其多样性分析[J].山东农业科学,2017 ,49(7):112-115.
[17] QI T,SONG S,REN Q, et al.The Jasmonate-ZIM-domainproteins interact with the WD-Repeat/bHLH/MYB complexes toregulate Jasmonate-mediated anthocyanin accumulation andtrichome initiation in Arabidopsis thaliana[J].The Plant Cell,2011, 23:1795-1814.
[18] NARAYAN M S,THIMMARAJU R, BHAGYALAKSHMI N.In-terplay of growth regulators during solid-state and liquid-state batchcultivation of anthocyanin producing cell line of Daucus carota[J].Process Biochemistry, 2005, 40(1):351-358.
[19] DEIKMAN J, HAMMER P E.Induction of anthocyanin accumula-tion bv cytokinins in Arabidopsis thaliana[J].Plant Physiology,1995,108 (1):47-57.
[20] WANG N, XU H, JIANG S,et al-MYB12 and MYB22 play es-sential roles in proanthocyanidin and flavonol synthesis in red-fleshed apple(Malus sieversii,niedzwetzkyana)[J].The PlantJournal, 2017, 90(2): 276-292.
[21] BOGS J,JAFFEF W, TAKOS A M, et al-The grapevine tran-scription factor VvMYBPAI regulates proanthocyanidin synthesisduring fruit development[J].Plant Physiology, 2007, 143(3):1347-1361.
(责任编辑:王妮)
