不同发酵时期大麦青贮品质和微生物多样性变化
2019-09-10刘蓓一宦海琳顾洪如许能祥沈琴丁成龙
刘蓓一 宦海琳 顾洪如 许能祥 沈琴 丁成龙



摘要:本试验旨在阐明不同发酵时期大麦青贮发酵品质及细菌多样性的动态变化。试验分别在青贮第2d、青贮第14 d、青贮第60 d和有氧暴露第Sd采样,对青贮饲料的发酵品质、营养成分等进行测定,并采用Miseq高通量测序技术分析细菌的多样性和组成。结果表明,与青贮第2d相比,大麦青贮第60 d的pH值显著下降(P<0.05),乳酸含量显著升高(P<0.05)。青贮第2 d的细菌优势菌群是魏斯氏菌属(Weissella)和乳杆菌属(Lactobacil-lus),相对丰度分别为45. 960%、30. 680%。青贮第14 d的细菌优势菌群为乳杆菌属(Lactobacillus),相对丰度为74.720%,其次是魏斯氏菌属(Weissella),相对丰度为13.170%。青贮第60 d的细菌优势菌群为乳杆菌属(Lactoba-cillus),相对丰度为96.740%。有氧暴露第5d乳杆菌属(Lactobacillus)的相对丰度为0.710%,有氧暴露后滋生了不动杆菌属(Acinetobacter]、沙雷氏菌属(Serratia)等有害菌。综上所述,青贮第2-60 d大麦青贮的优势菌群是乳杆菌属,而有氧暴露后菌群结构发生了变化,不动杆菌属、沙雷氏菌属等有害菌的相对丰度增加。
关键词:青贮品质;大麦青贮;Miseq高通量测序;细菌菌群
中图分类号: S512.3
文獻标识码:A
文章编号: 1000-4440(2019)03-0653-08
大麦是主要的谷类作物之一,因具有抗逆性强、适应性广等特点而被广泛种植。大麦是重要的粮饲兼用作物之一,其籽粒是畜禽的精饲料,蛋白质含量显著高于玉米,而淀粉含量比玉米略低。目前,草食家畜的优质粗饲料极度缺乏,丰富的水溶性碳水化合物和适宜的水含量是制作优质青贮饲料的基础。大麦的水溶性碳水化合物含量较高,可以为乳酸盐生产提供充足的底物,所以全株大麦适宜青贮,从而为革食家畜提供优质的冬季粗饲料[1]。
在开窖、取料和饲喂过程中,青贮饲料与外部空气频繁接触,容易通过二次发酵导致有氧腐败[2]。在二次发酵过程中,会产生大量腐败菌,造成饲料营养成分丧失,进而影响动物生产性能[3]。田静等[4]研究发现,大麦青贮过程中添加植物乳杆菌(Lacto-bacillus plantarum)可以显著增加青贮饲料的乳酸含量,降低pH值,提高大麦青贮饲料的发酵品质,添加类谷糠乳杆菌(Lactobacillus parafarraqinis)ZH1可以提高大麦抽穗期和开花期青贮饲料的发酵品质,且有效提高其有氧稳定性。Kim等[5]指出,植物乳杆菌和丙酸都能减少酵母菌的数量,从而减少有氧腐败。
青贮过程是一个复杂的微生物发酵体系,有多种微生物参与,且不同种类微生物对青贮饲料品质的影响不同[6]。因此,全面了解大麦青贮期间和有氧暴露后微生物菌群组成及主要有害菌种类,才能更好地防止有氧腐败。目前,采用传统可培养方法从青贮饲料中已分离鉴定出的微生物主要有乳酸菌、酵母菌、霉菌等[7-8]。但是传统的微生物培养方法只能分离到约1%的环境微生物,无法真正完全了解微生物的组成,而且传统培养法耗时长,操作复杂[9]。随着分子生物学技术的发展,16S rRNA克隆建库、变性梯度凝胶电泳技术( PCR-DGGE)、限制性片段长度多样性(T—RFLP)等非培养方法被广泛应用于青贮饲料微生物多样性的研究中[10-12],但是这些技术鉴定到的优势物种不够全面[13]。采用高通量测序技术直接从样品中提取DNA,能完整地分析样品全貌并且最大限度地展示样品中的微生物种类和丰度[14],揭示青贮饲料中有益菌和有害菌的种类。Zheng等[15]利用高通量测序技术研究添加乳酸菌和蔗糖对苜蓿青贮过程中微生物菌群的影响,发现添加乳酸菌和蔗糖可以阻止梭菌定殖,而未添加组的优势菌群是产气荚膜梭菌、硫酸盐还原菌和巴氏梭菌。刘晶晶[16]用高通量测序技术研究不同乳酸菌添加剂对柳枝稷青贮微生物多样性的影响,发现接种复合乳酸菌可以降低青贮饲料的细菌群落多样性,有效抑制肠杆菌属细菌的相对丰度,提高乳杆菌属细菌的相对丰度。然而,高通量测序技术在青贮饲料方面应用的报道较少。
本试验拟利用Miseq高通量测序技术与常规发酵品质分析相结合的方法,研究大麦青贮过程中不同发酵时期的青贮品质、营养成分及微生物多样性,监测微生物菌群组成的动态变化,为添加剂的安全使用和发酵调控提供理论依据。
1 材料与方法
1.1 试验材料和样品采集
2017年5月,在大丰区众鑫农机服务专业合作社基地采集试验样品(全株大麦),切割为1-2 cm大小的青贮原料,通过微波干燥,计算其中的水分含量,在其水分含量为70%时开始青贮。装入聚乙烯包装袋内,每袋500g,用真空封口机(DZQ-400/2D,上海康正包装机械有限公司产品)封口,封口后置于室温下避光保存。分别在青贮第2d、青贮第14 d、青贮第60 d采样,样品分别标记为D2、D14、D60,D2和D14各取3袋,而D60取6袋,其中3袋用作青贮第60 d样品的分析,另外3袋青贮饲料开启后,将其混匀后置入IL聚乙烯罐中,罐口用双层纱布包裹,防止苍蝇等污染和水分散失.空气可自由进入罐中,置于室温条件下保存,有氧暴露后第5 d(A5)进行取样。取每袋的中间部位作为样品,其中一部分冻存于50 ml的无菌离心管中,-80℃保存,主要进行后期微生物多样性检测;一部分装入封口袋于-20 ℃条件下保存,进行发酵品质测定;另外一部分(约10 g)用于微生物(包括乳酸菌、酵母菌、好氧细菌)数量的计数。剩余青贮饲料用于营养成分的测定。
1.2 青贮样品发酵品质及微生物数量的测定
分别于4个不同青贮阶段取20 g大麦青贮样品,加入180 ml蒸馏水充分混匀,通过捣碎机搅拌lmm,采用4层纱布和定性滤纸进行过滤,获得浸出液,于-20℃冰箱中保存待测,测定pH值,以及乳酸、乙酸、丙酸和乙醇的含量。pH值用MettlerToledo型pH计测定,乳酸、乙酸、丙酸、乙醇采用安捷伦1260高效液相检测系统测定,配备示差检测器和Carbomix@ H-NP;色谱性,流动相为2.5 mmol/LH2S04,流速为0.5 ml/min,温度为55℃。
取10g样品,置于无菌三角瓶内,并注入无菌生理盐水,共计90 ml,密封处理,摇床摇晃2h,速度为120 r/min。单层无菌纱布过滤,进行逐级稀释,稀释梯度的悬浮液于MRS( De Man Rogosa Sharpe)培养基中,在37℃厌氧的环境中培养2d,计算乳酸菌数量。将悬浮液接种于葡萄糖麦芽浸膏培养基中,30℃培养ld,计算酵母菌数量。将悬浮液接种于牛肉膏琼脂培养基中,于30 ℃下培养ld,计算好氧细菌数量。
将剩余部分的青贮饲料收集起来烘干称质量,测定干物质的含量。55℃烘箱中干燥48 h至恒定质量,测定干物质含量,采用范氏洗涤纤维法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。
1.3 青贮饲料微生物高通量测序
1.3.1 微生物基因组DNA的提取取青贮饲料样品10 g,注入90 ml无菌生理盐水,密封,120 r/min摇床摇2h。单层纱布过滤杂质,12 000 g离心15mm收集细菌菌体,然后利用PowerSoil DNAIsolation Kit试剂盒提取青贮饲料菌群的总DNA。
1.3.2 细菌16S rDNA的扩增使用细菌16S rRNA基因V3 - V4区引物对获得的DNA模板进行序列扩增。引物序列为F(5 '-GTACTCCTACGGGAGGCAGCA-3’)和R(5,-GTGGACTACHVGGGTWTCTAAT_3 7).PCR反应体系为50μl,包括5.0μl的SxPCR buffer,4.0¨l的dNTPs,0.3¨l的FastPfu DNA polymerase,30 ng模板DNA,2.0μl正向引物F(10 μmol/L),2.0μl的反向引物R( 10μmol/L),采用ddH70补充到50μ1。PCR程序为:95℃预变性10 min;95℃变性30 s,56oC退火30 s,72℃延伸40 s,反应循环数为25次,最后72 ℃延伸10 min。
1.3.3 测序PCR产物的浓度及目的条带采用2%琼脂糖凝胶电泳进行检测,在其浓度适宜和条带准确的情况下,送至北京诺禾致源科技股份有限公司进行测序。
1.3.4 生物信息学和数据分析使用Cutadapt( V1.9.1)软件先对Reads进行低质量剪切,基于Barcode对其样品数据进行拆分,同时去除引物序列和Bar-code,获取原始数据,在此基础上,与物种注释数据库比对,进行嵌合体序列检测,使用UCHIME软件剔除嵌合体,获取有效数据。
通过Uparse软件对有效数据进行聚类分析,以97%的一致性将其聚类成为操作分类单元(OTUs),采用高频次出现的序列作为代表序列[17]。在此基础上,对选出来的代表序列进行物种注释,完成物种注释后,采用Mothur方法将其与SSUrRNA数据库进行物种注释分析,从而可以得到分类学信息以及基于不同分类水平的菌群组成。利用QIIME软件对OTU进行多样性指数分析[18]。细菌16S rRNA基因V3 - V4区采用Sliva细菌数据库进行比对。物种注释和丰度分析基于RDP classifier算法在QIIME平台软件上进行,通常在其置信度水平为90%的条件下进行[19]。
1.4 统计分析
试验获取数据信息,采用统计软件SPSS19.0进行数据处理,数据比较采用方差分析,多重比较采用Duncan's法进行。
2 结果与分析
2.1 不同发酵时期大麦青贮品质和微生物数量的变化
表1显示,大麦青贮第2d的pH最高,经过60 d的青贮发酵,pH值显著下降(P<0.05),但有氧暴露第5 d,pH值显著上升,达到6.02+0.18( P
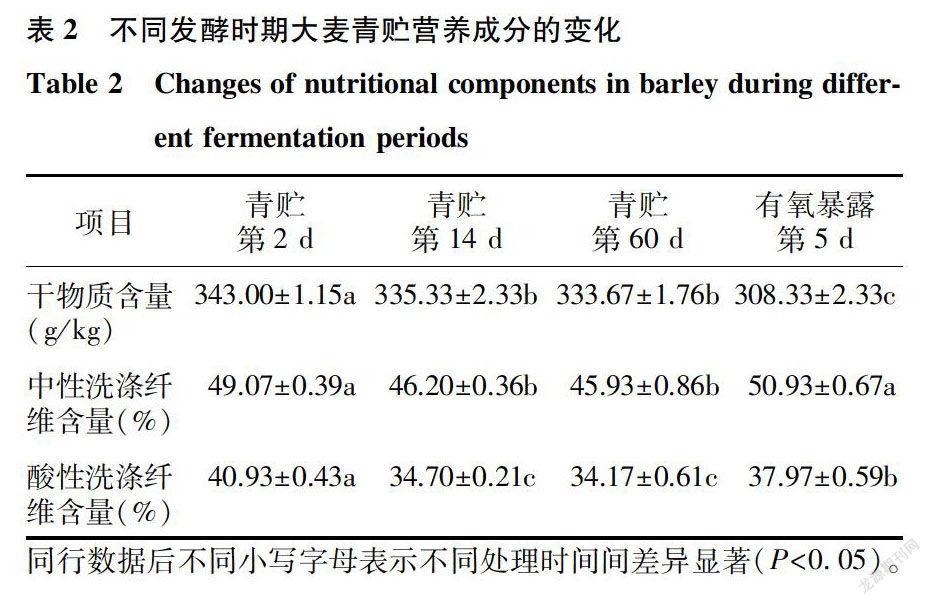
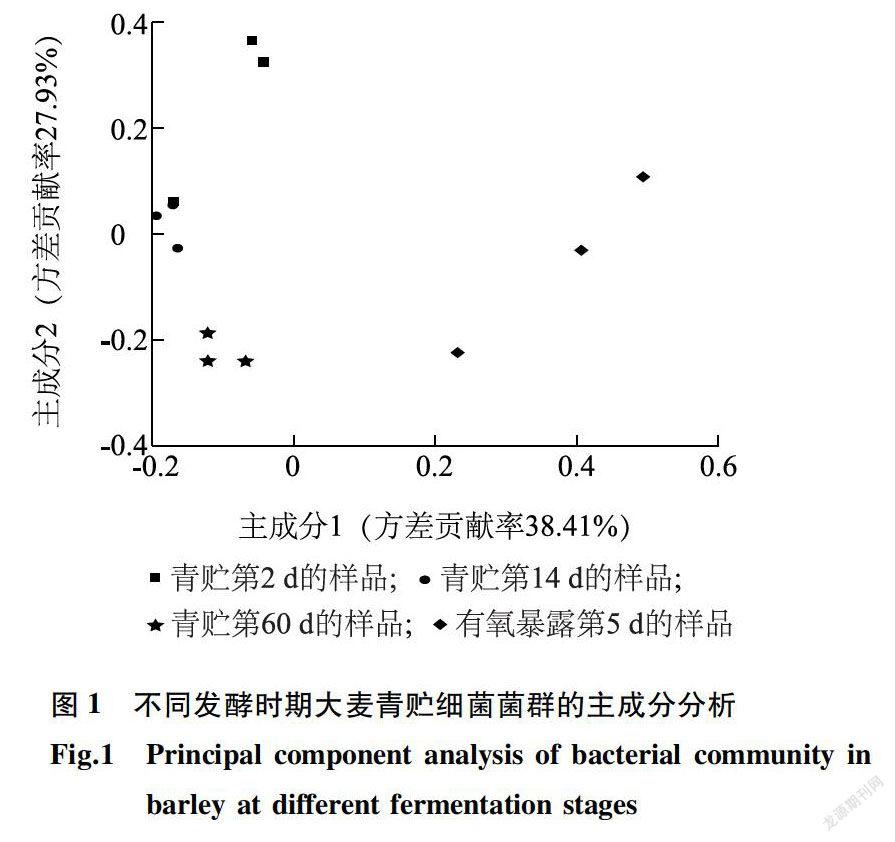
表2显示,青贮第2d大麦干物质含量最高,显著高于青貯第14 d和青贮第60 d(P 2.3 不同发酵时期大麦青贮细菌的多样性分析计算菌群丰度的指数有Chao指数、Ace指数,其数值越大,表示菌群丰度越高。表3显示,青贮第2d的细菌Chao指数和Ace指数最高,青贮第60 d时最低。有氧暴露第5d的细菌Chao指数和Ace指数均高于青贮第60 d。Shannon指数是用来计算菌群多样性的指数,Shannon指数越大,菌群多样性越高。青贮第2- 60 d,随着青贮时间的延长,细菌Shannon指数降低,但是有氧暴露第5d的Shannon指数增加,说明青贮第60 d时细菌多样性最低,有氧暴露会使细菌多样性增加。 2.4 不同发酵时期大麦青贮细菌菌群的主成分分析 由细菌菌群的主成分分析(图1)可知,青贮第2d与青贮第14 d细菌菌群的距离较为接近,表明二者在微生物组成上差异不大,青贮第60 d与青贮第2d、青贮第14 d的细菌菌群距离较远,存在一定差异,有氧暴露第Sd与其他3个取样时间的细菌菌群距离也较远。 2.5 不同发酵时期大麦青贮细菌菌群的组成变化 2.5.1 基于门水平的细菌茵群结构分析 表4显示,相对丰度大于1%的门有厚壁菌门( Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门( Bacteroidetes)、蓝细菌门(Cyanobacteria)等。青贮第2d的主要优势菌群为厚壁菌门、变形菌门和蓝细菌门,相对丰度分别为81.443%、3.702%、7.420%,总相对丰度为92.565%。青贮第14 d的主要优势菌群为厚壁菌门( 95.103%),其次是蓝细菌门(1.040%),变形菌门(0.877%),总相对丰度为97.020%。青贮第60 d的主要优势菌群为厚壁菌门,相对丰度为99.500%。有氧暴露第5d的主要优势菌群为厚壁菌门和变形菌门,相对丰度分别为34.278%和45.110%.其次是拟杆菌门(13.090%),总相对丰度为92. 482%。门水平上,在大麦青贮第2-60 d厚壁菌门(Firmicutes)细菌始终占优势地位,随着青贮时间的延长,厚壁菌门细菌相对丰度呈增长趋势,但是与青贮第60 d相比,有氧暴露第5d的厚壁菌门细菌相对丰度下降,变形菌门和拟杆菌门细菌相对丰度增加。 2.5.2 基于属水平的细菌茵群结构分析表4显示了在属水平上不同发酵时期大麦青贮细菌菌群结构的变化。青贮第2d的优势菌群为乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella),其相对丰度分别为30. 6800-/0和45. 960%。青贮第14 d的优势菌群为乳杆菌属(Lactobacillus),相对丰度为74. 720%,其次是魏斯氏菌属(Weissella)和片球菌属( Pediococcus),相对丰度分别为13. 170%和7. 210%。青贮第60 d优势菌群为乳杆菌属(Lactobacitlus),相对丰度为96. 740%,其次是魏斯氏菌属(Weissella)和片球菌属(Pediococcus).相对丰度分别为1. 400%和1.3600-/0。有氧暴露第Sd,乳杆菌属(Lactobacillus)的相对丰度仅占0.710%,而不动杆菌属(Acinetobacter)、肠球菌属(Enterococcus)、普罗维登斯菌属(Providencia)、稳杆菌属(Empedobacter)和沙雷氏菌属(Serratia)的相对丰度分别为26.540%、33.220%、16.400%、13.090%、2.170%。 青贮第2d、青贮第14 d、青贮第60 d乳杆菌属的相对丰度分别是30. 680%、74.720%、96.740%,即随着青贮时间的延长,乳杆菌属相对丰度增加,于青贮第60 d达到了峰值。但是有氧暴露第5d乳杆菌属的相对丰度仅有0.710%,被不动杆菌属、肠球菌属、普罗维登斯菌属、稳杆菌属所取代。说明,青贮第2-60 d大麦青贮的优势菌群是乳杆菌属,而有氧暴露后菌群结构发生了变化,不动杆菌属、沙雷氏菌属等有害菌的相对丰度增加。 3 讨论 3.1 不同发酵时期大麦青贮的发酵参数和微生物数量变化 大麦是中国主要的青贮原料之一。本试验在大麦青贮第2d、第14 d、第60 d取样,发现青贮饲料感官品质良好,无霉变和黏手现象,有酒酸香味,无臭味。但是在有氧暴露第Sd时,感官品质变差,有霉变现象。pH作为评判青贮成功的重要指标,pH值小于4.0时,青贮饲料品质优等,pH值为4.1-4.3,青贮饲料品质良好,pH值为4.4-5.0,青贮饲料品质一般,pH值在5.0以上,青贮饲料品质劣等[20]。试验中,青贮第60 d的pH值达3.94+0.01,属于品质优等,而有氧暴露Sd时pH值达6.02+0.18,品质劣等,即有氧暴露导致大麦青贮的有氧腐败,降低了青贮品质,这与万学瑞等21]报道的结果一致。在有氧条件下,随着暴露时间的增加,pH值相应增加,这主要是由好氧性微生物增殖导致的[22]。青贮过程较为复杂,乳酸菌是青贮发酵过程中关键的微生物[23],乳酸菌能否迅速大量繁殖决定着青贮的成败。青贮第2-60 d,随着青贮时间的延长,乳酸菌数量呈现先增加后降低的趋势,有氧暴露第5d的乳酸菌数量最低。有氧条件下,大麦青贮容易发生二次有氧发酵,导致内部的酵母菌和好氧细菌迅速增殖,抑制乳酸菌的生长,引起青贮饲料变质。有学者认为,酵母菌和霉菌是导致青贮二次发酵过程中营养损失的主要原因,这是因为酵母菌和霉菌等好氧微生物可以氧化青贮有机酸,从而引起青贮饲料的有氧变质[24]。本研究中,有氧暴露第5d,酵母菌和好氧细菌数量显著高于青贮第14 d和第60 d。因此,为提高大麦青贮品质和有氧稳定性,大麦青贮时应使用能提高有氧稳定性的添加剂。 3.2 大麦青贮细菌多样性的动态变化 青贮饲料为复杂的微生物体系,在整个青贮过程中,有多种微生物参与,主要有原料附着微生物、发酵微生物和腐败变质微生物[25],因此研究微生物的菌群结构十分重要。本研究通过MiSeq高通量测序发现,大麦青贮期绝对优势菌门为厚壁菌门。Eikmeyer等[26]利用NGS高通量测序技术进行研究,发现厚壁菌门是优势菌,在青贮第14 d和第58d厚壁菌门的相对丰度分别为86.000%、87.000%。厚壁菌门中包括产芽孢、非产芽孢和支原体菌群,且大部分具有降解纤维素、蛋白质、淀粉等大分子化合物的作用[27]。厚壁菌門和变形菌门是苜蓿青贮饲料中主要的优势菌门[13]。本研究中,有氧暴露第5d的优势菌群为厚壁菌门和变形菌门,相对丰度分别为34. 278%和45. 110%。变形菌门为细菌中最大的门,包括大肠杆菌、弧菌和螺杆菌等,另外欧文氏菌属、鞘氨醇单胞菌属、甲基杆菌属、假单胞菌属、土壤杆菌属等也属于变形菌门[28]。本研究采用MiSeq高通量测序技术对不同发酵时期大麦青贮的细菌菌群结构进行分析,发现青贮第2d、第14 d、第60 d乳杆菌属占绝对优势,其相对丰度分别是30. 680%、74.720%、96.740%,即相对丰度随着青贮时间的延长呈增加趋势,在青贮第60 d达到峰值,这与胡宗福等[29]的研究结果一致。Ennahar等[30]发现,青贮饲料发酵初期主要的优势菌群为片球菌,从植物原料到青贮饲料,粪链球菌和肠膜明串珠菌在开始阶段发挥作用,随后被乳杆菌、短乳杆菌和布氏乳杆菌等更耐酸的乳酸菌代替。乳杆菌属是青贮稳定期的主要菌群[31],为青贮饲料发酵品质的提升提供了菌群保障。本研究中,在青贮第2d,魏斯氏菌属也是优势菌群,相对丰度为45.960%,青贮第14 d时,相对丰度为13.170%,到青贮第60 d时,其相对丰度仅为1. 400%,说明在青贮初期,魏斯氏菌属具有重要作用,在青贮后期其作用明显减退,这与陶莲等[32]的研究结果一致。 不动杆菌是一种需氧的非发酵细菌,广泛存在于水体、土壤等外界环境中,而在青贮饲料中很少发现。通过试验发现,有氧暴露第5d,大麦青贮中不动杆菌属的相对丰度达到26.540%,此时pH值为6.02+0.18。青贮第14 d、第60 d青贮饲料中几乎不含不动杆菌属,这2个阶段青贮饲料的pH值都在3.96以下,即青贮饲料的pH值低于3.96时,不利于不动杆菌属生长,这与Li等[33]报道的结果一致。Liu等[34]指出,青贮饲料开袋后,玉米秸秆青贮饲料好氧细菌主要由香味类香味菌、不动杆菌、嗜麦寡养食单胞菌、嗜线虫沙雷氏菌、短小芽孢杆菌和纺锤型赖氨酸芽孢杆菌组成,推测玉米秸秆青贮有氧变质可能是由这些好氧细菌引起的。本试验研究发现,有氧暴露后好氧细菌数量增加,这与Liu等[35]提出的较多好氧细菌会引起青贮饲料中乳酸发酵不足,从而导致柱花草青贮饲料好氧变质的结果一致。沙雷氏菌属(Serratia)是肠杆菌目的一个属,存在于土壤、水、植物以及动物的青贮饲料中。Parvin等[36]利用变性梯度凝胶电泳技术进行研究,发现青贮原料中不存在沙雷氏菌,而青贮饲料中却检测到了沙雷氏菌。居泉沙雷氏菌就是青贮饲料中比较常见的1种肠道细菌,虽然是非致病性细菌,但属于有害菌,因为在青贮发酵初期,这类细菌会与乳酸菌争夺青贮饲料中的碳水化合物,从而降低青贮饲料品质。因此,有氧暴露改变了大麦青贮饲料菌群的菌属结构,抑制了乳酸菌的生长,为好氧菌的繁殖提供了良好环境,从而增加了不动杆菌属和沙雷氏菌属等有害菌的相对丰度。 參考文献: [1] HARGREAVES A,HILL J,LEAVER J D.Effect of stage ofgrowth on the chemical composition, nutritive value andensilabilitv of whole-crop barley[J].Animal Feed Science andTechnology, 2009, 152( 1/2):50-61. [2]张适,常杰,胡宗福,等.青贮饲料有害微生物及其抑制措施[J].动物营养学报,2017,29( 12):4308-4313. [3] 吕文龙,刁其玉,闫贵龙,布氏乳杆菌对青玉米秸青贮发酵品质和有氧稳定性的影响[J].草业学报,2011, 20(3):143-148. [4] 田静,谢昭良,刘家杏,等.冬闲田种植大麦不同生育期的营养价值和青贮品质[J].草业科学,2017 ,34(4):753-760. [5] KIM D H,AMANULLAH S M. LEE H J,et al-Effect ofmicrobial and chemical combo additives on nutritive value and fer-mentation characteristic of whole crop barley silage[J].Asian-Aus-tralasion Journal of Animal Science, 2015, 28(9):1274-1280. [6] 倪奎奎.全株水稻青贮饲料中微生物群落以及发酵品质分析[D].郑州:郑州大学,2016. [7] 熊乙,赵燕梅,许庆方,等,五个地区玉米青贮菌群多样性的研究[J].草业科学,2017, 235(5):16-22. [8] RASMUSSEN R R,RASMUSSEN P H,LARSEN T O,et al.hvitro cytotoxicity of fungi spoiling maize silage[J]. Food andChemical Toxicology, 2011, 49(1):31-44. [9]LIN C J,BOLSEN K K,BRENT B E,et al-Epiphytic lactic acidbacteria succession during the pre-ensiling and ensiling periods ofalfalfa and maize[J].Joumal of Applied Microbiology, 1992, 73 (5):375-387. [10] ROSSI F,DELLACLIO F. Quality of silages from Italian farms asattested by number and identity of microbial indicators[ J].Journal of Applied Microbiology, 2007, 103(5):1707-1715. [11] GRAF K,ULRICH A,IDLER C,et al-Bacterial community dy-namics during ensiling of perennial ryegrass at two compaction lev-els monitored bY terminal restriction fragmnent length polymorphism[J]. Journal of Applied Microbiology, 2016, 120(6):1479-1491. [12] WANC Y S,SHI W, HUANC LT,et al-The effect of lactic acidbacterial starter culture and chemical additives on wilted rice strawsilage[J].Animal Science Joumal, 2016, 87(4):525-535. [13] MCCARVEY J A, FRANCO R B, PALUMBO J D, et al.Bacterial population dynamics during the ensiling of Medicagosativa( a]fa]fa) and subsequent exposure to air[J].Journal of Ap-plied Microbiology, 2013, 114(6):1661-1670. [14] ASMA Z,SYLVIE C, LAURENT C, et al-Microbial ecology ofthe rumen evaluated by 454 GS FLX pyrosequencing is affected bystarch and oil supplementation of diets[J].FEMS Microbiology E-cology, 2013, 83(2):504-514. [15] ZHENG M L,NIU D Z,JIANG D, et al.Dynamics of microbialcommunity during ensiling direct-cut alfalfa with and without LABinoculant and sugar[J].Journal of Applied Microbiology, 2017,122(6):1456-1470. [16]刘晶晶,生物添加剂对柳枝稷青贮的作用及机理研究[D].北京:中国农业大学,2015. [17] EDGAR R C.UPARSE: hi~ly accurate OTU sequences from mi-crobial amplicon reads[J].Nature Methods, 2013, 10( 10):996-998. [18] KEMP P F,ALLER J Y.Bacterial diversity in aquatic and otherenvironments: what 16S rDNA libraries can tejl us[J].FEMS Mi-crobiology Ecology, 2004, 47(2): 161-177. [19] WANG Q, GARRITY G M, TIEDIE J M. et al-Naive Bayesianclassifier for rapid assignment of rRNA sequences into the newbacterial taxonomy[J].Applied and Environmental Microbiology,2007, 73( 16): 5261-5267. [20]杨云贵,张越利,杜欣,等.2种玉米青贮饲料青贮过程中主要微生物的变化规律研究[J].畜牧兽医学报,2012, 43(3): 397-403. [21]万学瑞,吴建平,雷赵民,等,优良抑菌活性乳酸菌对玉米青贮及有氧暴露期微生物数量和pH的影响[J].草业学报,2016, 25( 4):204-211. [22]王保平,董晓燕,董宽虎,等.有机酸对全株玉米青贮有氧稳定性的影响[J]。草地学报,2013, 21(5):991-997. [23] STOKES M R.Effects of an enzyme mixture, an inoculant, andtheir interaction on silage fermentation and dairy production[J].Joumal of Dairy Science, 1992, 75(3): 764-773. [24] DRIEHUIS F,ELFERINK S 0. SPOELSTRA S F.Anaerobiclactic acid degradation during ensilage of whole crop maize inocu-lated with Lactobacillus buchneri inhibits yeast growth andimproves aerobic stability[J].Journal of Applied Microbiology,1999, 87(4):583-594. [25]MUCK R E.Recent advances in silage microbiology[J].Agricul-tural and Food Science, 2013, 22(1):3-15. [26] EIKMEYER F G,KOFINGER P,POSCHENEL A, et al- Metage-nome analvses reveal the influence of the inoculant Lactobacillusbuchneri CD034 0n the microbial communitv involved in grass en-siling[J].Journal of Biotechnology, 2013, 167(3):334-343. [27]ROMERO J J,ZHAO Y, BALSECA-PAREDES M A. et al. Labo-ratory silo type and inoculation effects on nutritional composition,fermentation, and bacterial and fungal communities of oat silage[J]. Journal of Dairv Science, 2017, 100(3):1812-1828. [28] PENG K, JIN L,NIU Y D, et al.Condensed tannins affect bacte-rial and fungal microbiomes and mycotoxin production during ensi-ling and upon aerobic exposure[J].Applied and EnvironmentalMicrobiology, 2018, 84(5): 1-20. [29]胡宗福,常杰,薩仁呼,等,基于宏基因组学技术检测全株玉米青贮期间和暴露空气后的微生物多样性[J].动物营养学报,2017, 29(10):3750-3760. [30]ENNAHAR S, CAI Y M, FUJITA Y. Phylogenetic diversity of lac-tic acid bactena associated with paddy rice silage as determined by16S ribosomal DNA analysis[J].Applied and Environmental Mi-crobiology, 2003, 69(1):444-451. [31]陶雅,李峰,高凤芹,等,籽粒苋与青贮玉米混贮品质及微生物特性研究[J].草业学报,2016,25( 12):119-129. [32]陶蓮,刁其玉,青贮发酵对玉米秸秆品质及菌群构成的影响[J] .动物营养学报, 2016 . 28( 1) : 198-207. [33] LI Y, NISHINO N. Effects of inoculation of Lactobacillusthamnosus and Lactobacillus buchneri on fermentation , aerobic sta-bility and microbial communities in whole crop corn silage [J] .Grassland Science , 2011 , 57( 4) : 184-191. [34] LIU Q H, SHAO T, ZHANG J G. Determination of aerobic deteri-oration of corn stalk silage caused by aerobic bacteria [ J] . AnimalFeed Science and Technology, 2013, 183( 3/4) : 124-131. [35] LIU Q, ZHANC J, SHI S, et al. The effects of wilting and storagetemperatures on the fermentation quality and aerobic stability ofstylo silage [ J] .Animal Science Joumal, 2011 , 82( 4) : 549-553. [36] PARVIN S. WANG C, LI Y. et al. Effects of inoculation with lac-tic acid bacteria on the bacterial communities of Italian ryegrass,whole crop maize , guinea grass and thodes grass silages[ J] . Ani-mal Feed Science and Technology, 2010, 160 ( 3/4 ) : 160-166.
