引起玉米穗腐病的禾谷镰刀菌LAMP快速检测方法的建立
2019-09-10王芝涵王春伟高海馨荆琦余廷濠王燕
王芝涵 王春伟 高海馨 荆琦 余廷濠 王燕



摘要:针对引起玉米穗腐病的禾谷镰刀菌( Fusarium graminearum),根据翻译延伸因子基因(EF-1alpha)的保守区域设计特异性引物,通过优化反应时间和温度,建立一种灵敏、快速的环介导等温扩增( LAMP)检测方法,并对优化的F graminearum LAMP反应体系进行特异性、灵敏度及可行性检测。结果表明,该LAMP方法能够有效检测禾谷镰刀菌的基因组DNA,64℃、45 min为最优反应条件。在最佳条件下,该方法对禾谷镰刀菌具有良好的特异性,检测灵敏度可达到100 pg/μl。该检测方法为禾谷镰刀菌引起的玉米穗腐病的田间快速诊断及病原菌监测奠定了基础。
关键词:禾谷镰刀菌;翻译延伸因子基因;环介导等温擴增;分子检测
中图分类号:S432.4+4
文献标识码:A
文章编号: 1000-4440( 2019) 03-0581-05玉米穗腐病是玉米最常见的病害之一,在中国玉米种植区普遍发生,发病率为5% - 10%,感病品种的发病率高达50%,个别地块严重时可达100% [1-2],造成了巨大的损失。玉米穗腐病由多种病原菌侵染所致,镰刀菌为主要病原菌[3],而且镰刀菌在致病过程中能产生多种毒素(如赤霉烯酮、单端孢霉毒素、串珠镰刀菌素和伏马菌素等),可促使细胞凋亡,对动植物机体造成多种病理损伤,给人类的食物安全带来严重隐患[4]。目前,已报道的引起玉米穗腐病的镰刀菌有15种以上[5],其中禾谷镰刀菌[6-7]为优势种群。镰刀菌形态具有多型性和变异性,仅依据形态特征进行病原菌的准确鉴定具有较大难度[8],并且传统鉴定方法存在检测周期长、工作量大、结果不准确等问题[9]。因此,及时、有效地对镰刀菌进行快速、准确检测,是防止其寄主植物病害发生,保证农产品质量安全的基础。
目前,对病原菌的传统检测方法有形态学鉴定、酶联免疫吸附试验( ELISA)、聚合酶链反应(PCR)等[10-11],这些方法不仅操作繁杂、费时、准确度低,还易遗漏潜育期或隐症的病原菌,导致病害暴发。传统病原学检测方法已不能满足现代植物病理学研究的需要,建立一种快速、灵敏、准确的检测方法对玉米穗腐病的防控具有重要意义。环介导等温扩增(LAMP)是日本学者Notomi在传统PCR技术基础上发展起来的一种新型体外核酸扩增方法[12],随着IAMP的优点逐渐为研究者所熟知[13-16],将该技术应用于检测各种病原体的同时,研究者们也对该技术提出了很多改进建议,使得该技术逐步完善,现已广泛应用于细菌或病毒的定性定量检测、临床疾病诊断以及动植物中致病微生物检测等相关领域[17]。
本研究拟利用LAMP技术,针对翻译延伸因子基因(EF-1alpha]的保守区域设计特异性引物,建立禾谷镰刀菌的IAMP快速分子检测体系,以期为玉米穗腐病的病原监测及病害防控奠定基础。
1 材料与方法
1.1 供试菌株
2016年采集到玉米穗腐病样品,从中分离获得禾谷镰刀菌(Fusarium gramznearum),以及实验室保存的层出镰刀菌(F.proliferatum)、木贼镰刀菌(F.equiseti、锐顶镰刀菌(F.acuminatum)、尖孢镰刀菌(F.oxysporum)、轮枝镰刀菌(F.verticillioide)、半裸镰刀菌(F.semitectum)、砖红镰刀菌(F.lateritium)、燕麦镰刀菌(P avenaceum)、变红镰刀菌(F incar-natum)、藤仓镰刀菌(F.fujikuroi)、枝状枝孢菌(Cladosporium cladosporioides)、灰葡萄孢(Botrytisci一nerea)、拟盘多毛孢(Pestalotiopsis)。以上菌株均保存于马铃薯葡萄糖琼脂糖培养基(PDA)试管斜面,置于4℃冰箱中。
1.2 试剂及仪器
Biospin真菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,6×Loading buffer,DL2000 DNA Marker购自宝生物工程(大连)有限公司,LAMP PCR Master Mix反应液、10×Tris-Tricncme缓冲液、4S Green核酸染色剂购自生工生物工程(上海)股份有限公司。
SANYO超净工作台、Eppendorf PCR仪、Eppendorf超低温高速离心机、制冰机、电泳仪、Nanodr0 2000微量分光光度计、BIO-RAD凝胶成像系统、Thermo超纯水仪、紫外分光光度计、OLYMPUSDP72光学数字显微镜、SANYO超低温菌种保存柜和人工气候箱由植物病理学山西省重点实验室提供。
1.3 LAMP引物筛选
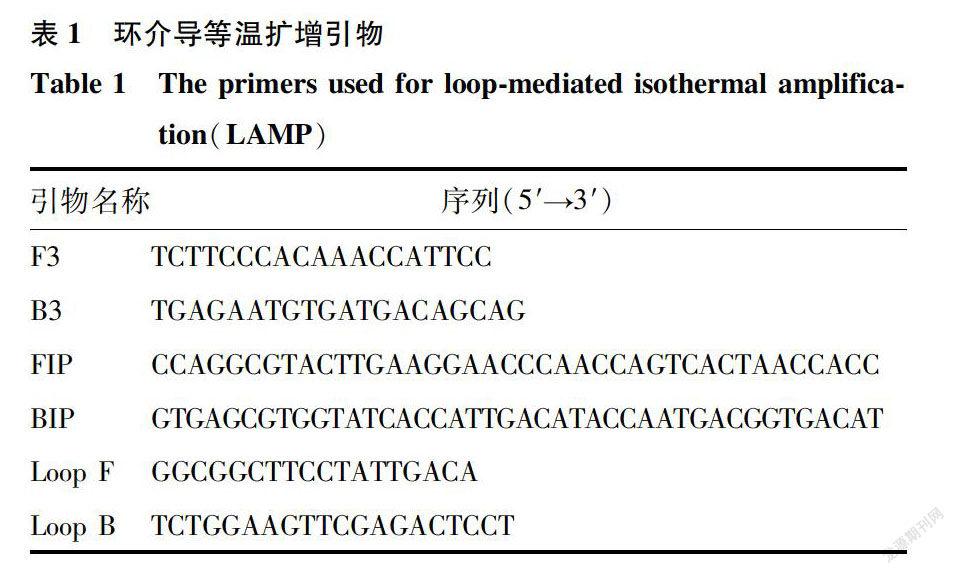
通过测定禾谷镰刀菌(F graminearum)的EF-lalpha保守区域碱基序列,使用Clustal X软件对镰刀属及其他病原菌不同种间EF-1alpha基因碱基序列进行比对分析。利用Primer Explorer V5软件设计出一套引起玉米穗腐病的禾谷镰刀菌LAMP检测引物组合,由1对外侧引物( F3/B3)、l对内侧引物( FIP/BIP)和1对环引物(Loop F/Loop B)组成。引物由生工生物工程(上海)股份有限公司合成,用ddH,0溶解后分装,保存于4℃冰箱中备用。引物序列如表1显示。
1.4 DNA提取
采用Biospin真菌基因组DNA提取试剂盒提取14种菌株的DNA。以ddH20作为空白对照。
1.5 LAMP体系优化
反应体系为25.0μl: 12.5μl 2x Lamp MasterMix,10.0 μmol/L内侧引物FIP和BIP各2.0μl,10.0μmol/L外侧引物F3和B3各0.5μl,10.0μmol/L环引物LoopB和Loop F各1.0μl,1.0μl TemplateDNA, 0.5μl DNA Polymerase, 4.0μl SterilizedddH20。将反应溶液混匀,放人恒温水浴锅,对反应温度和反应时间进行优化,反应结束后观察2%琼脂糖凝胶电泳结果,每个试验重复3次。
琼脂糖凝胶电泳图观察:称取0.7 9琼脂糖,加35.0 ml TAE缓冲液,用微波炉加热1.5 min后加入6.5μl染色剂。取5.0μl LAMP产物与6×Loadingbuffer混匀染色,在2%琼脂糖凝胶中进行电泳,若有亮条带出现,则表明扩增产物存在。
1.6 LAMP检测方法的灵敏度
用DNA质量浓度测定仪测定玉米禾谷镰刀菌DNA质量浓度。将DNA质量浓度依次稀释,使得质量浓度梯度依次为10 ng/μl、1 ng/μl、100 pg/μl、10 pg/μl、1 pg/μl,分别取2.Oμl作为LAMP检测方法的反应模板,每个质量浓度梯度设置3个重复。反应结束后观察结果,確定LAMP检测方法的灵敏度。
1.7 LAMP检测方法的特异性
将上述14种供试菌株的基因组DNA进行IAMP扩增,反应结束后观察IAMP反应的特异性结果。
选用健康的玉米籽粒,先在实验室的无菌操作台进行消毒处理,用2%的次氯酸钠(NaClO)溶液浸泡2 min,无菌水冲洗、晾干。再用接种针在籽粒上刺约3 mmx2 mm(深×宽)的伤口,伤口晾干后接种禾谷镰刀菌孢子悬浮液(1 ml lx10个孢子)10μl。籽粒晾干后用灭菌保鲜膜包裹,贮藏于20℃培养箱中,并保持95%左右的相对湿度。
采集田间发生玉米穗腐病的玉米籽粒和人工接种禾谷镰刀菌发病的玉米籽粒,从每份样品中挑取100 mg鲜组织,用NaOH快速裂解法提取DNA[18],作为模板用于LAMP扩增,以上处理重复3次。以玉米穗腐病禾谷镰刀菌纯DNA作为阳性对照,以空白PDA平板接种健康玉米基因组DNA作为阴性对照。
2 结果与分析
2.1 反应温度的优化
为了探索IAMP的最佳反应温度,从61- 65℃进行LAMP检测,反应时间60 min,反应结束后用2%琼脂糖凝胶电泳检测,选取最清晰条带所对应的反应温度。结果(图1)表明,61-65℃条件下均能进行扩增,反应温度为64℃时条带最清晰。
2.2 反应时间的优化
为了明确LAMP检测方法的最佳反应时间,在64℃的反应温度下,分别在15 min、30 min、45 min、60 min、75 min条件下进行环介导等温扩增反应。结果(图2)表明,反应时间为45 min时,便可观察到清晰条带,符合快速检测的要求。
2.3 LAMP检验方法的灵敏度
对提取的禾谷镰刀菌基因组DNA进行梯度稀释,结果(图3)显示,质量浓度为100 pg/μI仍能看见清晰条带,表明该体系检测灵敏度高。
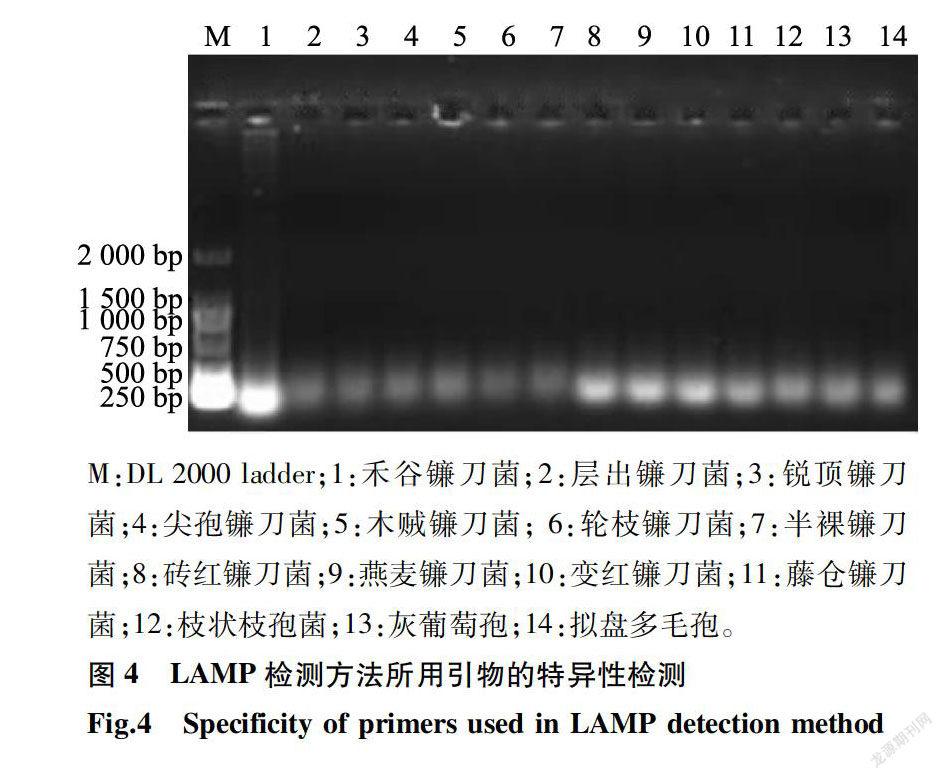
2.4 LAMP引物的特异性
对14种供试菌株进行LAMP扩增检测,结果(图4)表明,禾谷镰刀菌在电泳后可观察到明亮的条带,而其他供试菌株电泳后未观察到清晰的梯形条带。说明,该体系对禾谷镰刀菌具有很好的特异性。
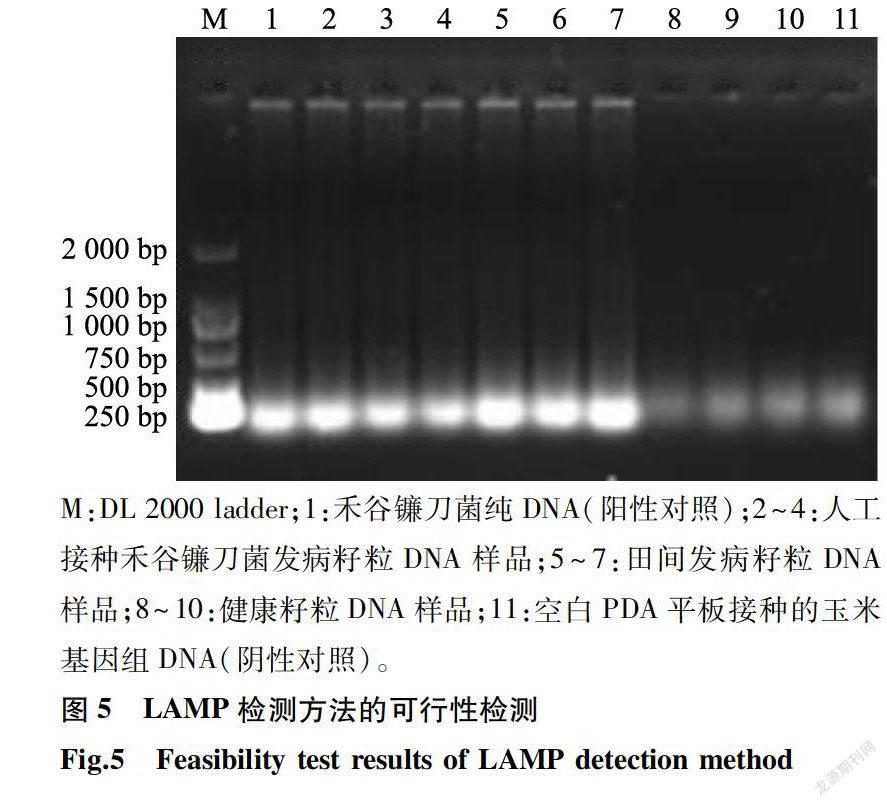
2.5 发病组织的LAMP检测
使用优化之后的LAMP反应体系,对禾谷镰刀菌纯DNA(阳性对照)、人工接种禾谷镰刀菌发病籽粒DNA样品、采集的田间发病籽粒DNA样品、健康籽粒的DNA样品和空白PDA平板接种的玉米基因组DNA(阴性对照)进行LAMP快速检测。结果(图5)表明,阳性对照、人工接种禾谷镰刀菌发病籽粒DNA样品、田间发病籽粒DNA样品的2%琼脂糖凝胶电泳条带清晰,而健康籽粒的DNA样品和阴性对照未检测到清晰条带。
3 讨论
在中国,玉米穗腐病病原菌的种类多[19],其中禾谷镰刀菌(F.graminearum)是引起玉米穗腐病的主要病原菌[3],对玉米的危害较大。目前,PCR方法已经成功用于玉米穗腐病病原菌的检测20-22]。史亚娟等20]建立了禾谷镰刀菌和拟轮枝镰孢菌的快速和定量检测体系,刘金华等[21]应用PCR技术检测玉米中的禾谷镰刀菌,焦铸锦等[22]建立镰刀菌基因敲除体系,同源重组核酸片段的PCR转化过程需要2-3 h。由于普通PCR反应耗时长,对操作人员、操作环境和仪器设备的要求高,因此,目前需要建立一种安全、准确、高效的检测方法。
双重PCR检测体系中,DNA模板的检测灵敏度为6. 25 ng/μl,低于传统的PCR检测标准,能够满足快速检测的要求[20]。本研究基于玉米穗腐病禾谷镰刀菌建立了IAMP快速检测方法,灵敏度为100 P9/μl,但是由于IAMP的灵敏性较高,容易造成假阳性现象,因此需要对试验器材进行定期消毒处理,并采用不同的移液器操作,以避免交叉感染。影响IAMP反应的因素很多,反应体系中的每个参数都可能会影响最终的结果。
引物是否具有特异性是决定IAMP检测方法成败的关键。现阶段,用于鉴定和检测禾谷镰刀菌的靶标中,核糖体转录间隔区域基因(ITS)是最常用的靶标,但对于一些近似种,其ITS区域同源性相对较高,很难设计出特异性引物[23]。EF-1alpha基因的保守区域具有足够多的特异性位点,并且其序列在种内相对保守,非常适合作为禾谷镰刀菌的分子检测靶标[24-25]。因此,本研究选择EF-1alpha基因作为禾谷镰刀菌特异性检测的靶标基因。LAMP引物的设计和筛选有其独特的原则及规律,利用Primer Explorer V5软件,设计出一套引起玉米穗腐病的禾谷镰刀菌LAMP检测引物组合。LAMP反应中内引物FIP/BIP和外引物F3/B3的特异性决定了反应的特异性。对供试菌株基因组DNA进行IAMP特异性分析,检测结果显示,LAMP体系只对禾谷镰刀菌表现出良好的特异性。段亚冰等[26]通过人工接种禾谷镰刀菌,检测LAMP反应体系在小麦赤霉病对多菌灵抗药性检测应用中的可靠性。在本试验中,为了提高LAMP检测特异性的可靠性,对采集的田间发生玉米穗腐病的玉米籽粒样品进行检测,结果显示出良好的特异性。
LAMP快速檢测方法具有普通PCR所不能比拟的优点,它操作简便,检出效率高,用时短,不需要复杂的仪器设备,更适合在基层推广应用[27-28]。同时,可结合NaOH快速提取DNA技术,使玉米穗腐病检测方法在田间应用成为可能。该体系为田间玉米穗腐病病原的快速检测和病害防治工作奠定了基础。
参考文献:
[1]郭满库,王晓鸣,何苏琴,等.2009年甘肃省玉米穗腐病、茎基腐病的发生危害[J].植物保护,2011.37(4):134-137.
[2]陈捷,我国玉米穗、茎腐病病害研究现状与展望[J].沈阳农业大学学报,2000, 31(5):393-401.
[3]黄思良,卢维宏,陶爱丽,等.南阳市玉米穗腐病致病镰刀菌种群结构分析[J].南阳师范学院学报,2012.11(3):54-57.
[4] 张卫娜,贾谏,陆晓宇,等,镰刀菌属真菌毒素的研究进展[J].广东农业科学,2013 ,40(15):130-133.
[5]SARVER B A J,WARD T J,CALE L R,et aL Novel Fusariumhead blight pathogens from Nepal and Louisiana revealed bv multi-locus genealogical concordance[J].Fungal Cenetics and Biology,2011, 48( 12): 1096-1107.
[6]秦子惠,任旭,江凯,等.我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定[J].植物保护学报,2014, 41(5): 589-596.
[7]LEE S H,LEE JK,NAMY J,et al-Population structure of Fu-sanum graminearum from maize and rice in 2009 in Korea[ J].The Plant Pathology Joumal, 2010 ,26(4):321-327.
[8] LESLIE J F,ZELLER K A,SUMMERELL B A.Icebergs andspecies in populations of Fusarium [J].Physiologcal andMolecular Plant Pathology,2001, 59(3):107-117.
[9]赵柏霞,高增贵,庄敬华,等,瓜类保护地土壤镰孢菌种群及UP-PCR多样性分析[J].应用生态学报,2009, 20(4):857-862.
[10] ALBERT H H,SCHENCK S. PCR amplification from a homolog ofthe BE mating-type gene as a sensitive assay for the presence ofUstilago scitaminea DNA[J].Plant Disease,1996 ,80( 10):1189.
[11] SHEN W, XI P,LI M, et al-Development of a sensitive nested-polymerase chain reaction( PCR) assay for the detection of Ustilagoscitaminea[J].African Journal of Biotechnology, 2012, 11( 46):10541-10547.
[12] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Re-search,2000, 28( 12): 63-69.
[13] FUKUTA S, KATOS, YOSHIDA K,et al. Detection of tomato vellowleaf curl virus by loop-mediated isothermal amplification reaction[J]Joumal of Virological Methods, 2003, 112( 1/2): 35-40.
[14] IWAMOTO T,SONOBE T,HAYASHI K.Loop-mediated isother-mal amplification for direct detection of Mycobacterium tuberculosiscomplex,Mavium, andMintracellulare in sputum samples[J"Joumal of Clinical Microbiology, 2003, 41(6):2616-2622.
[15] KUBOKI N, INOUE N, SAKURAI T,et al-Loop-mediated iso-thermal amplification for detection of African trypanosomes[J].Joumal of Clinical Microbiology, 2003, 41( 12): 5517-5524.
[16] ENDO S,KOMORIT,RICCIG,et al- Detection of gp43 0f Para-coccidioides brasiliensis bv the loop-mediated isothermalamplification( LAMP) method[J].FEMS Microbiology Letters,2004.234(1):93-97.
[17] HUANG J L,WU J Z,LI C J,et al-Detection of Phytophthoranicotianae in soil with real-time quantitative PCR[J].Journal ofPhytopathology, 2010, 158(1):15-21.
[18]吴向远,丁冬,宋桂良,等,玉米载因组DNA快速提取方法[J].河南农业大学学报,2012,46(1):7-10.
[19] ZHANG T,SUN X D. LYU G Z.Fusarium species and itsisolation frequency from rot ears of maize in Northeast China[J].Joumal of Fungal Research, 2011,9(1):9-14.
[20]史亞娟,孙新艳,袁虹霞,等,引起玉米穗腐病的两种镰孢菌双重PCR快速检测体系的建立[J].植物病理学报,2017,47 (1):35-39.
[21]刘金华,肖成蕊,魏春艳,应用PCR技术检测玉米中的禾谷镰刀菌[J].植物检疫,2004,18(6):333-335.
[22]焦铸锦,黄思良.玉米穗腐病致病层出镰刀菌基因敲除体系的构建[C]//中国植物病理学会,中国植物病理学会2014年学术年会论文集,北京:中国农业科学技术出版社,2014.
[23] BRASIER C,KIRK S,DELCAN J,et a1.Phytophthora alni sp.nov.and its variants: designation of emerging heteroploid hybridpathogens spreading on Alnus trees[J].Mycological Research,2004, 108( 10):1172-1184.
[24]姚正颖,张丹,李春霞,等.能源植物续随子延伸因子EFIA基因cDNA序列的克隆及分析[J].中国野生植物资源,2016,35(1):6-11,27.
[25]覃迎姿,黄先益,叶兴枝,等,植物延伸因子eEFIA研究进展[J].广西农业科学,2009 ,40(5):472-477.
[26]段亚冰,效雪梅,杨莹,等,一种基于LAMP技术快速检测小麦赤霉病菌对多菌灵抗药性方法的建立及应用[J].南京农业大学学报,2016,39(1):97-105.
[27]贾蒙骜,陈兴江,林叶春,等.基于环式等温扩增的烟草青枯病病原菌快速检测方法[J].中国农业大学学报,2014, 19(1): 93-98.
[28]李本金,刘裴清,刘小丽,等.荔枝霜疫霉巢式PCR和IAMP检测方法的建立[J].农业生物技术学报,2016,24(6):919-927.
(责任编辑:王妮)
