分离自土壤的裸囊菌科真菌中国及大陆新记录种
2019-09-10邵秋雨张芝元董醇波邹晓韩燕峰梁宗琦
邵秋雨 张芝元 董醇波 邹晓 韩燕峰 梁宗琦

摘 要:裸囊菌科類群是一类重要的人和动物皮肤病原真菌,尤其是小孢子菌属,目前对其报道主要以临床病例为主,对环境中如土壤和水源中的菌研究较少,为及早预防真菌感染的发生,对我国山西省和甘肃省土壤中的裸囊菌科真菌资源进行调查。采集不同环境中的土壤样品,利用鸡毛和头发对土壤样品中的这类资源进行诱集,分离目标菌株;基于形态特征和ITS rDNA序列进行系统发育分析相结合的方法进行菌株的鉴定。从土壤中分离发现3个裸囊菌科菌株:经鉴定为布拉尔小孢子菌Microsporum boullardii,奇妙帕拉癣菌Paraphyton mirabile和弯奈尼兹皮菌Nannazzia incurvata。前两个种为中国新记录种,后一个为大陆新记录种;这些存在于土壤中的裸囊菌科真菌为潜在人和动物的致病菌,值得引起重视。
关键词:分类学;系统发育;新记录种
中图分类号:Q939.5
文献标识码:A
文章编号:1008-0457(2019)03-0016-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.03.004
Abstract:Arthrodermataceae was a group of important dermatopathic fungi for humans and animals,especially the genus Microsporum. At present,it is mainly reported in clinical cases,and the environment such as soil and water source;most reports mainly paid attention to the clinical cases,and there are few studies on such fungi in the environment such as soil and water. In order to prevent fungal infection,Arthrodermataceae resources in soil samples from Shanxi and Gansu Province were investigated. Different soil samples were collected,and cultivated with the chicken feather and hairs by baiting technique,then the target strains were isolated and identified by the morphological characteristics and phylogeny based on ITS rDNA sequences. Three target strains of Arthrodermataceae were obtained and identified as Microsporum boullardii,Paraphyton mirabile and Nannizzia incurvata. The former two species are new to China,while the last one is new to mainland of China. Those fungi of Arthrodermataceae in the soils were potential pathogen of human and animals,which was worthy of attention.
Key words:taxonomy; phylogeny; new record species
人类和动物皮肤是抵御外界病原微生物侵入的重要屏障,此外,其还可起到防止水分丢失等作用。在不同的皮肤部位存在着不同的微生物群落,通常不具有致病性。但当机体免疫力低下或外界环境条件的改变等因素打破皮肤上的微生物群落平衡时,皮肤有可能会因真菌感染而引起皮肤科疾病如皮肤癣病(皮肤癣菌Dermatophyte)、花斑糠疹(马拉色菌Malassezia)和黏膜念珠菌病(念珠菌Candida)等[1]。常见的能引起浅部真菌病的真菌有毛癣菌Trichophyton、白念珠菌 Canidia albicans、小孢子菌Microsporum和马拉色菌Malassezia等,其可引起成人和儿童的躯干、指甲、手部、头部、阴囊等部位的真菌病[2]。这类菌也能引起如猫、狗等动物的皮肤病。研究表明,皮肤癣病的高低与当地的环境卫生、生活习惯、生活用水和地区气候等密切相关。目前多数报道主要关注临床病例,对环境如土壤中这类真菌的分布和存在报道不多。本课题组长期对土壤中的这类真菌物种进行调查和正确的分类鉴定,及时发现新的潜在感染物种,以期为预防人类和动物皮肤感染的发生提供科学依据。
裸囊菌科Arthrodermataceae是重要的人类和动物皮肤病原菌,大多嗜角蛋白,可于富角蛋白基质的土壤中腐生,或与脊椎动物的皮肤病及其他感染相关。以往的研究多集中于病原株的分离、致病性、区域性调查等,关于该科的系统发育研究刚刚起步。de Hoog et al.基于多基因系统学研究将裸囊菌科划分为9属[3],即Arthroderma,Ctenomyces,Epidermophyton,Guarromyces,Lophophyton,Microsporum,Nannizzia,Paraphyton和Trichophyton。Wijayawardene等[4]报道该科有6个属,Arthroderma Curr. & Berk.,Ctenomyces Eidam,Epidermophyton Sabour.,Microsporum Gruby,Shanorella R. K. Benj.,Trichophyton Malmsten。因此,该科的系统分类值得进一步研究。其中重要类群小孢子菌属Microsporum Gruby于1843年以M. audouinii Gruby为模式种建立[5]。之后一些学者如Emmons 和Ajello等[6-7]对该属进行了重新整理,国内外发表了一些新分类单元丰富了该属成员[8-16]。近年来,国际上采用“一个真菌一个名称”,有些小孢子菌属成员被移入奈尼兹皮菌属Nannizzia中,例如M. incurvatum更名为Nannizzia incurvata;有些小孢子菌属成员被移入新建属帕拉癣菌属Paraphyton中,如M. cookie和M. mirabile分别更名为P. cookie 和 P. mirabile。国内对该科类群还未见有系统研究,但发现一些种的分布[17-18],大部分是从动物不同部位发现的,也从土壤中报道一新分类单元[11]。本研究对山西省和甘肃省两省50余份土壤中的裸囊菌科类群进行调查研究,以期丰富我国的真菌物种多样性。
1 材料與方法
1.1 菌株的分离
从我国山西省和甘肃省采集的土壤样品经鸡毛和头发段诱集,挑出目标菌株L19.3,K82.3和L6.7至PDA培养基中,25°C下培养7 d或14 d,透明胶带制片进行形态学描述、显微拍照和制作形态图。所有活菌株现保存于贵州大学真菌资源研究所(GZUIFR),其干培养物保存于中国科学院菌物标本馆(HMAS)。
1.2 DNA提取及PCR扩增
将研究菌株接种于PDA培养基中,25°C恒温培养14 d,刮取产孢菌丝,经液氮研磨后,按照真菌DNA提取试剂盒的流程进行DNA的提取。参照张芝元等[11]的操作方法,采用通用引物物ITS4(5-TCCTCCGCTTATTGATATGC-3)和ITS5(5-GGTGAGAGATTTCTGTGC-3)对ITS1-5.8S-ITS2 rDNA 进行PCR 扩增。25 μL 反应体系包括引物ITS4 1 μL,ITS5 1 μL,2 × Master Mix 12.5 μL,模板2 μL,无菌水补足25 μL。PCR 条件为:94°C 3 min;94°C 30 s,55°C 30 s,72°C 1 min,30 个循环;72°C 5 min。将获得的PCR 产物交北京诺赛公司进行测序,得到的序列经校正后提交GenBank(MH577288—MH577290)。
1.3 数据处理和系统发育树的构建
经GenBank中Blast后,下载小孢子菌属及其相关种的序列共33条,以合川戴氏霉Taifanglania hechuanensis为外群,经MAFFT v7.03b[19]进行序列比对及手工校正后,保存为FASTA 格式(具体信息见表1)。使用MrBayes 3.2 进行贝叶斯推理法(Bayesian inference,BI)分析[20],经Modeltest 3.7[21]检验获得最佳替换模型为K80+G。位点间差异比率采用分布比率差异(gamma-distributed rate variation),其中部分为不变位点(aproportion of invariant sites),其余参数为默认值;采用Metropolis-coupled Markov Chain Monte Carlo(MCMCMC)法运算10 000 000 代,每500 代取样1 次,从得到的样本中舍弃25 000 个老化样本后总结得到一致树,用TreeView(Page 1996)查看。同时在软件MEGA 6中采用最大简约法(MP)和邻接法(NJ)经1 000 次bootstrap 验证构建系统发育树[22]。
2 结果与分析
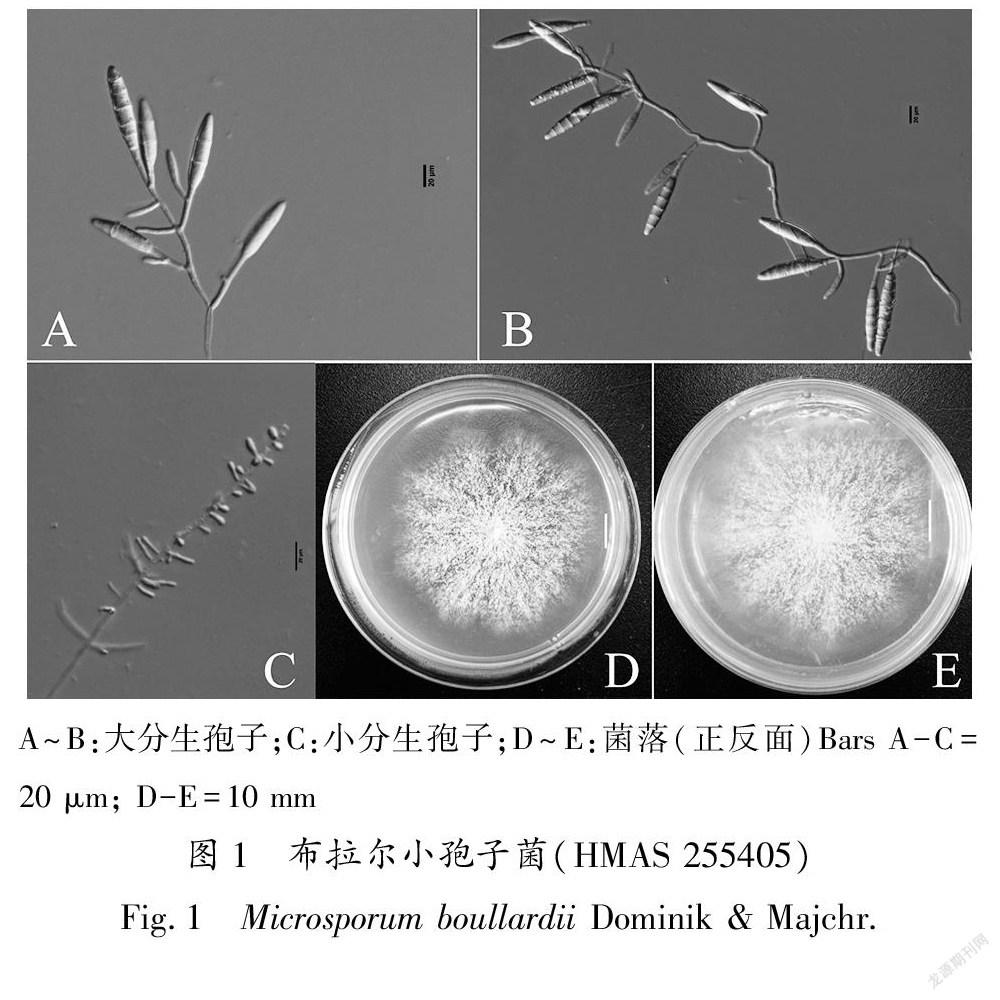
2.1 形态描述
2.2 系统发育分析
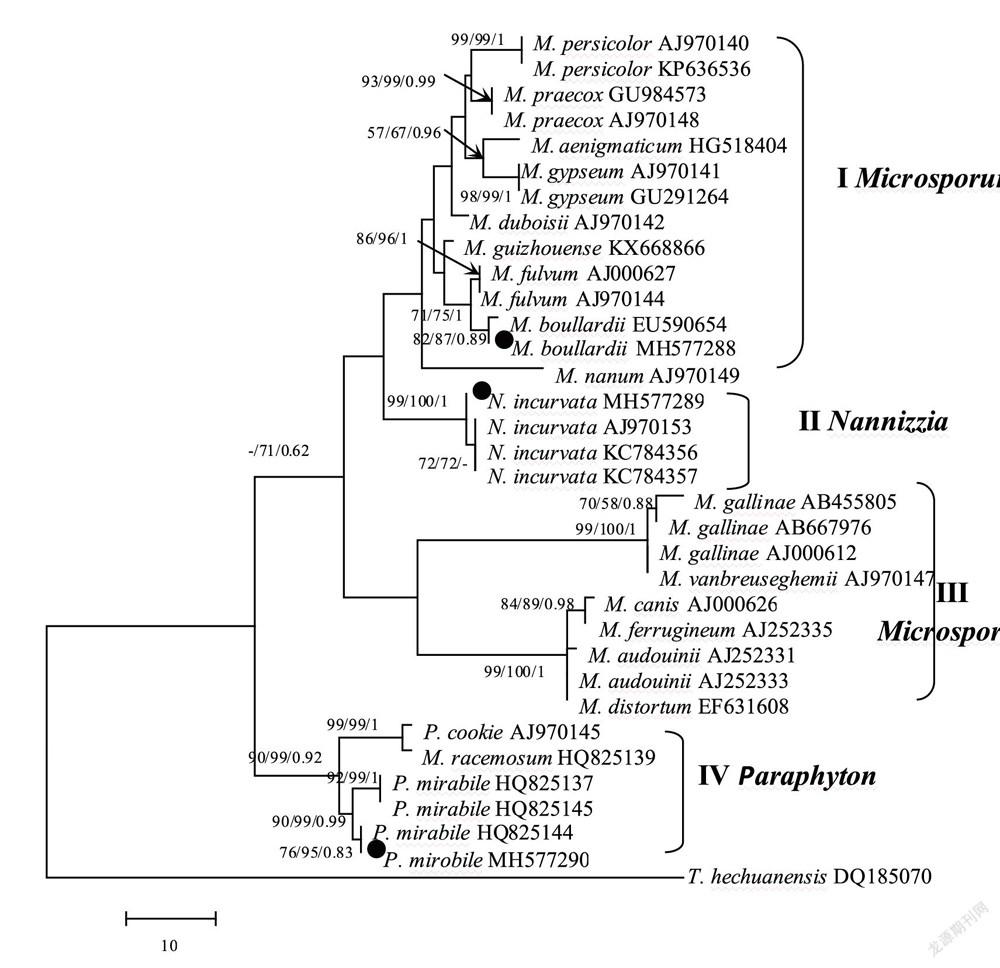
构建的裸囊菌科三个主要类群的系统发育树(图4)明显表明,采用最大简约法、邻接法和贝叶斯推理法构建的系统发育树具有相似的拓扑结构。该系统树分为I、II、III和IV四支。分支I包含了9种14个小孢子菌菌株,其中本研究菌株布拉尔小孢子菌Microsporum boullardii MH57288(菌株号L19.3,干培养物HMAS 255405)与报道的菌株以82/87/0.89的支持率聚在一起;分支II包含弯奈尼兹皮菌Nannizzia incurvata,本研究菌株MH577289(菌株号K82.3,干培养物HMAS 255403)与其余三个弯奈尼兹皮菌以高支持率99/100/1聚在一起;分支III包含了5种9个小孢子菌Microsporum菌株,这些菌均分离自染病动物上;分支IV 包含了3种6个帕拉癣菌属Paraphyton菌株,其中本研究菌株MH577290(菌株号L6.7,干培养物HMAS 255404)与本种另外三个菌株以较好的支持率90/99/0.99聚在一起。因此,系统发育结果支持了本研究三个菌株的分类地位。
3 结论与讨论
裸囊菌科Arthrodermataceae常见类群主要是小孢子菌属Microsporum及其相关属帕拉癣菌属Paraphyton、奈尼兹皮菌属Nannizzia和毛癣菌属Trichophyton,具有亲土性、亲动物性和亲人性等特点,可引起人和动物发生头癣、体癣等感染病害[16]。有研究表明,武汉及其周边地区近年来的头癣主要由亲人性的毛癣菌Trichophyton和小孢子菌Microsporum引起[23];昆明和兰州地区的儿童浅部真菌病以皮肤癣菌Dermatophyte病最多,男孩的发病率高于女孩,致病菌种以犬小孢子菌Microsporum canis位居第一[2]。这可能与接触小动物有关。黄梦雅等[24]研究结果表明重庆地区的足癣也是常见病,致病菌种以红色毛癣菌Trichophyton rubrum,可能与该地区温暖潮湿的环境适宜该真菌的生长有关。
Hoog GS等[3]基于ITS,LSU,TUB 和60S L10构建了裸囊菌科相关属的系统发育树,将该科分为9个属[3],其中对小孢子菌属Microsporum采用了3种32条序列进行了研究,结果表明不同来源如人、狗、猴子、兔子等皮肤的同种不同菌株均有一定差异,但三个种的所有菌株都能分别较好地聚在一起。张芝元等[11]在发表该属一新种时,采用了ITS rDNA进行系统发育分析,结果表明ITS能将本属不同种很好地分类,与Hoog GS等[3]多基因的结果一致。表明ITS可以作为该属的DNA条码标记进行分种鉴定,但对于属级以上阶元的分类采用多基因为好。
本研究从土壤中分离获得的奇妙帕拉癣菌Paraphyton mirabile L6.7菌株能分别与本种其他三个菌株以较好的支持率(90/99/0.99)聚在一起,而且与其模式标本描述基本一致[14];本研究L19.3菌株的描述特征与原始描述基本一致,其在系统发育树上,与GenBank上布拉尔小孢子菌M.boullardii唯一的一条序列仅以82/87/0.89的支持率聚在一起,支持率不高可能由于种内不同菌株的差异引起,正如本系统发育树中的P.mirabile中的两个菌株HQ825144和MH577290的支持率也仅为76/95/0.83,但与同种其他菌株能较好的聚为一支,同样的现象在本研究的N.incurvata三个菌株中也存在,因此,综合系统发育与形态特征,将其鉴定为布拉尔小孢子菌M.boullardii。这两个种在我国未见报道,是中国新记录种。弯奈尼兹皮菌Nannizzia incurvata Stockdale,曾被移入小孢子菌属中命名为M.incurvatum。早前认为石膏样小孢子菌M.gypseum是N.incurvata的无性型,但基于ITS rDNA聚类分析,虽然这两个无性型形态非常相似,但它们并不聚在一支,因此N.incurvata是独立的一个种[10]。该菌在台湾报道发现,现分离自我国甘肃省土壤,是大陆新记录种。它们在我国还未有病例报道,但这些潜在致病菌的存在和分布也值得重视。
土壤是真菌生活的大本营,这些产孢真菌的孢子可长期潜伏于土壤中,当有适宜的环境条件就会大量繁殖生长,尤其接触到人类和动物毛发更易大量富集。沈鑫等[25]研究表明土壤中加入鸡毛可明显促进人类致病菌如石膏样小孢子菌Microsporum gypseum的生长。近年来随着饲养猫、狗等宠物的增多,亲动物性的癣病发病率有上升趋势。有些癣病治疗时间长,病情易反复,不易根治。这些结果提示我们要做好疾病预防措施,养成讲卫生的良好习惯,对于易出汗的人群,要及时擦干;另外家里尽量不养宠物,在外也避免接触小动物。若发现症状,及时就医,切忌乱用药。
致谢:感谢中国科学院微生物研究所孙炳达老师和杨柳老师在菌株和干模保藏方面提供的帮助。
参 考 文 献:
[1] 王若珺,李若瑜. 皮肤真菌微生态研究进展[J].中国真菌学杂志,2018,13(3):188-192.
[2] 海 勒,马越娥,史玉玲. 131例儿童浅部真菌病患者临床和病原菌分析[J].中国真菌学杂志,2018,13(2):87-90.
[3] Hoog GS,Dukik K,Monod M,et al. Toward a novel multilocus phylogenetic taxonomy for the dermatophytes[J].Mycopathologia,2017,182(1-2):5-31.
[4] Wijayawardene NN,Hyde KD,Lumbsch HT,et al. Outline of Ascomycota:2017[J].Fungal Diversity,2018,88(1):167-263.
[5] Gruby D. Recherches sur la nature,le siège et le développement du porrigo decalvans ou phytoalopécie[J].Cormptes rendus de l academic des sciences seie Ⅱ fascicule C-chimic,1843,17:301-302.
[6] Emmons CW. Dermatophytes:Natural grouping based on the form of the spores and accessory organs[J].Archives of Dermatology and Syphilology,1934,30(3):337-362.
[7] Dominik T. Majchrowicz I.Some new species of fungi from the soil of Conakry[J].Mycopathologia et Mycologia Applicata,1966,28(3):209-219.
[8] Ajello L. A taxonomic review of the dermatophytes and related species[J].Sabouraudia,1968,6(2):147-159.
[9] Hubka V,Dobiáová S,Dobiá R,et al. Microsporum aenigmaticum sp. nov. from M. gypseum complex,isolated as a cause of tinea corporis[J].Sabouraudia,2014,52(4):387-396.
[10] Miriam J,Bhat DJ. Microsporum appendiculatum sp. nov. on goat dung from India [J].Kavaka,1997(25):93-94.
[11] 張芝元,邹 晓,韩燕峰,等.贵州小孢子菌——小孢子菌属一新种[J].菌物学报,2017,36(5):535-541.
[12] Sun PL,Mu CA,Fan CC,et al. Cat favus caused by Microsporum incurvatum comb. nov.:the clinical and histopathological features and molecular phylogeny[J].Medical Mycology,2014,52(3):276-284.
[13] Caretta G,Piotelli E. Microsporum magellanicum and Cunninghamella antarctica,new species isolated from australic and Antarctic soil of Chile[J].Sabouraudia,1977,15(1):1-10.
[14] Choi JS,Grser Y,Walther G,et al. Microsporum mirabile and its teleomorph Arthroderma mirabile,a new dermatophyte species in the M. cookei clade[J].Medical Mycology,2012,50(2):161-169.
[15] Hubálek Z,Rush-Munro FM. A dermatophyte from birds:Microsporum ripariae sp. nov.[J].Sabouraudia,1973,11(3):287-292.
[16] 韩燕峰,董醇波,张芝元,等.重要真菌资源——小孢子菌属的研究进展[J].山地农业生物学报,2018,37(2):1-6.
[17] 王端礼.医学真菌学:实验室检验指南[M].北京:人民卫生出版社,2005:1-525.
[18] 毛叶红,何蒙文,郑岳臣,等.1960-2015年湖北及周边地区头癣病原菌变化情况分析[J].中国真菌学杂志,2017,12(2):98-105.
[19] Katoh K,Standley DM. Mafft multiple sequence alignment software version 7:improvements in performance and usability[J].Molecular Biology and Evolution,2013,30(4):772-780.
[20] Ronquist F,Teslenko M,van der Mark P,et al. MrBayes 3.2:efficient Bayesian phylogenetic inference and model choice across a large model space[J].Systematic Biology,2012,61(3):539-542.
[21] Posada D,Crandall KA. Modeltest:testing the model of DNA substitution[J].Bioinformatics (Oxford,England),1998,14(9):817-818.
[22] Tamura K,Stecher G,Peterson D,et al. Mega 6:molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[23] 喻惠元,陳尊义,董碧麟,等.武汉及其周边地区2011-2015年头癣类型及病原菌分析[J].中国皮肤性病学杂志,2017,31(3):324-326.
[24] 黄梦雅,赵明丹,王晋蜀,等.135例足癣患者微生物调查及药敏分析[J].中国真菌学杂志,2018,13(5):290-293.
[25] 沈 鑫,张芝元,郑 欢,等.富角蛋白有机物对医院绿地真菌群落组成的影响[J].菌物学报,2018,37(8):999-1005.
