絮凝菌的分离及其复合培养絮凝效果研究
2019-09-10江雨兮
江雨兮







摘 要:从土壤中分离出19株具有絮凝活性的菌株,通过初筛和复筛,选取絮凝活性最好的4株构建复合菌,然后进行正交实验,确定复合菌株最佳絮凝效果的发酵条件,最后利用得到的复合菌株对印染废水进行甲基橙脱色处理。
关键词:微生物絮凝剂;发酵条件优化;甲基橙脱色率
沿福州江滨大道散步时,发现闽江中除了生活及工业垃圾之外,还广泛存在会产生异味的微生物污染。目前,处理江水中污染物的方法有:人工打捞、引入污水管截污、自然分解等。水中的污染物Al3+污染环境,危害水生生物的生长发育,甚至会导致其死亡[1],同时通过食物链及饮用水等途径对人体健康造成危害。临床上铝中毒主要表现为铝性脑病,铝性骨病和铝性贫血。目前,医学上定义的老年痴呆症是病人脑中铝质量分数较高所致[2]。在自然界中广泛存在铁、锰等重金属元素,它们是重要的生理微量元素。但如果水中铁锰的质量分数很高则会导致水的色度升高,并造成危害,如饮用高锰水会慢性中毒,严重的话可对人体产生三致毒性作用[3]。
印染废水是以加工化学纤维及其混纺产品、丝绸为主的印染、毛织染厂及丝绸厂等排出的废水,含有苯系、萘系、苯胺及联苯胺类化合物,具有可生化性差、难降解、致癌、致畸以及对生态环境危害严重等特点,属于难处理的工业废水之一。这些废水进入我国水体环境,成为威胁我国水体环境的重要因素之一。近年来对印染废水脱色的研究十分活跃,传统的处理方法有吸附法、气浮法、混凝法、膜分离法、氧化法、电化学法、光化学法等,虽然传统的处理方法已经很成熟,但是在处理效果与经济成本上总是无法兼得,因而本文提出可借助絮凝剂实现废水中的杂质沉降。
絮凝剂是一类可以使液体中的不易沉淀固体悬浮颗粒凝聚、沉淀的物质。处理废水工艺中常用絮凝沉淀法。絮凝沉淀法的絮凝剂主要有两类:有机高分子絮凝剂;无机絮凝剂。无机絮凝剂虽然在运行方面可靠,但处理效率差,费用高,且有二次污染,无法有效地解决问题。因此,急需一種脱色效果好、经济成本低、对环境友好的脱色方法,而微生物絮凝剂正好符合了这些要求。微生物絮凝剂进行脱色具有成本低、效率高、环保等优点[4]。Kurane和Nohata采用Alcaligennes latus[5]产生的絮凝剂处理了染料废水,脱色率达到94%。庄源益等[6]选育了对染料有较好絮凝脱色作用的菌株,开发了对黑染料生产废水的脱色率为60%的NAT型生物絮凝剂。张蔚平等[7]选育出了有较好脱色作用的菌株,对甲基橙废水的脱色率为68.4%。近年来对微生物废水的脱色研究主要集中在选育和培育出各种优良的脱色菌株,并对其培养条件进行优化。目前,我国主要从两个方面研究絮凝剂:一方面是筛选和分离出能够产絮凝剂的絮凝菌[8-9];另一方面是优化絮凝剂产生菌产生絮凝剂的条件[6-10]。主要是对微生物絮凝菌的单一菌株进行研究,对复合型微生物菌株的研究较少[11]。由于各个地方水中微生物种类不同,故需要有针对性地从不同地方的土壤中,培养和提取有效的微生物絮凝菌,大批量、工业化地培养微生物絮凝菌是不大现实的。
文章结合闽江水源,通过从江畔土壤中筛选出具有较高絮凝率的絮凝剂产生菌株,构建复合菌株,筛选出絮凝活性较高的絮凝菌株,再对它们的培养条件进行优化,研究复合絮凝菌对甲基橙废水的脱色效率。
1 研究的技术路线
复合微生物絮凝菌构建流程:取样,纯化,初筛,复筛,分离,复合,如图1所示。
2 实验准备
2.1 土样采集
取垃圾箱附近土样及河边淤泥中土样约100 g装于密封袋中,记录土样采集的位置、风向并拍照记录。
2.2 培养基
(1)富集培养基。
1#:邻苯二甲酸二丁酯(DBP)4 g/L;酵母粉0.5 g/L;尿素0.5 g/L;NaCl 0.1 g/L;MgSO4·7H2O 0.2 g/L;KH2PO4 2 g/L;K2HPO4 5 g/L;琼脂1.5%(w/w);pH =8.0。
2#:葡萄糖10 g/L;酵母粉0.5 g/L;KH2PO4 2 g/L;K2HPO4 5 g/L;(NH4)2SO4 0.2 g/L;尿素0.5 g/L;NaCl 0.1 g/L;琼脂1.5%(w/w);pH= 6.0~7.0。
3#:LB培养基;胰蛋白胨10 g/L;酵母粉5 g/L;NaCl 10 g/L;琼脂1.5%。
(2)分离培养基:LB培养基。
(3)发酵培养基:葡萄糖10 g/L;酵母粉2 g/L;KH2PO4 2 g/L;K2HPO4 5 g/L;(NH4)2SO4 0.2 g/L;尿素0.5 g/L;NaCl 0.1 g/L;琼脂1.5% ;pH=7.0。
2.3 仪器
(1)DHG-907 8A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
(2)赛多利斯BSA423S精密电子天平,德国赛多利斯集团。
(3)超净工作台SW-CJ-IF,苏净集团安泰公司。
(4)HERAcell150i全能型CO2细胞培养箱,赛默飞世尔科技。
(5)UV-1100紫外可见分光光度计,上海嘉鹏科技有限公司。
(6)LDZX-50KB立式蒸汽灭菌器,上海申安医疗器械厂。
(7)ZQZY-CF 3层组合式振荡培养箱,上海知楚仪器有限公司。
3 复合微生物絮凝菌的构建
3.1 平板初筛
从学校垃圾箱附近土壤及污泥土壤样品中经过富集培养,再用平板分离,共挑取109株表面潮湿、黏稠的单菌落。
3.2 菌种的初筛
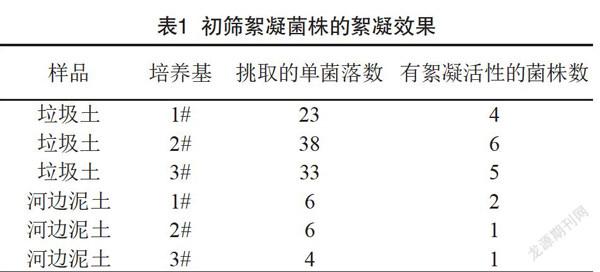
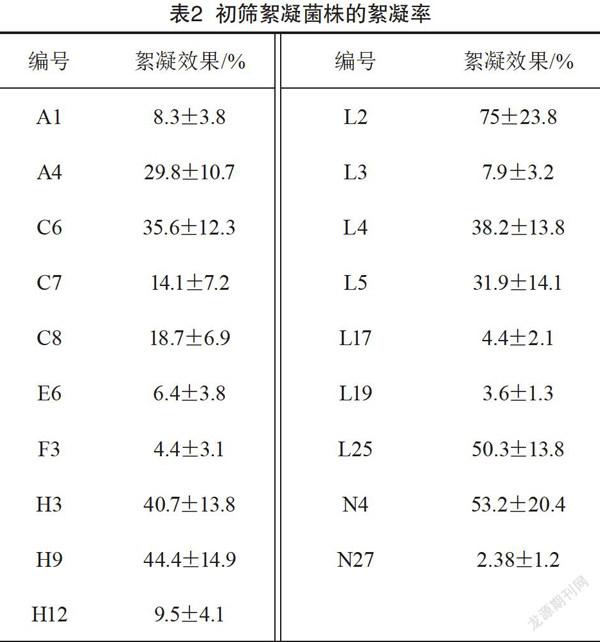
把平板初筛获得的109株单菌落,接种到发酵培养基中,培养48 h后,以CaCl2为助凝剂,检验以上的各个发酵液对高岭土悬浊液的絮凝能力,得到具有絮凝能力的细菌,有絮凝活性的菌株共19株,占挑取的菌落数的17.3%。如表1所示,其中垃圾堆的土壤中有絮凝活性的菌株较多,河边泥土中具有絮凝活性的菌株较少。将筛选到的19株具有絮凝活性的菌株编号后保存菌株。由表2可知,C6、L2、L4、L25、N4、H3、H9等7株作为复筛的菌株絮凝率均超过30%作为复筛的备用菌株。
3.3 菌种的复筛
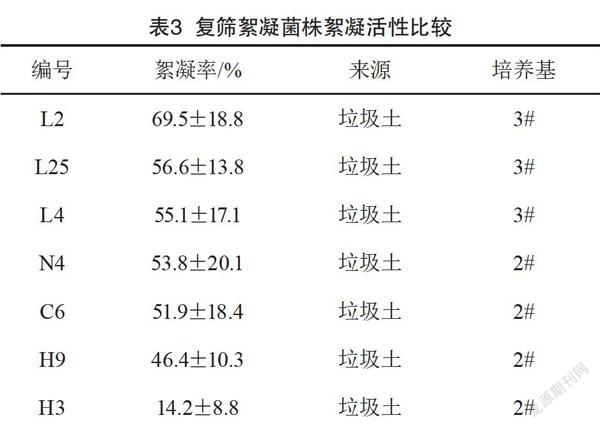
将表2中7株絮凝活性较高的菌株进行复筛,每株重复3次,结果如表3所示,选出絮凝效果较好的L2、L25、L4、N4进行传代培养、保存。
4 絮凝菌菌群的构建
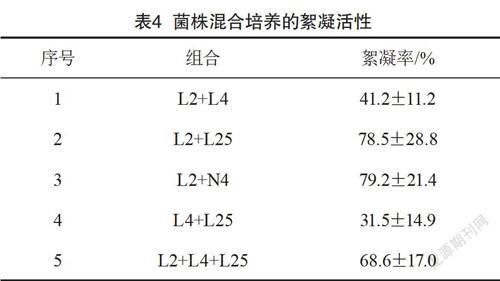
将复筛得到的菌株按照等比例(v/v)以2%的接种量混合培养,在37 ℃,150 r/min下培养48 h后,按照测定发酵液的絮凝活性步骤,得到结果如表4所示。试验发现由L2和N4构建的复合菌群的絮凝效果最好,达到79.2%,而单一菌株在同样的条件下絮凝效果分别是69.5%,53.8%。根据生态位理论[13]:在同一个环境中,生态位分离的菌株,它们在生长过程中相互利用产生和分泌营养物质形成共生关系,产生协同作用,从而促进絮凝性的提高。本试验表明形成了共生关系的菌株有L2和N4,它们产生了协同作用。
4.1 培养条件的优化
4.1.1 絮凝菌的生长曲线,培养时间对絮凝率的影响
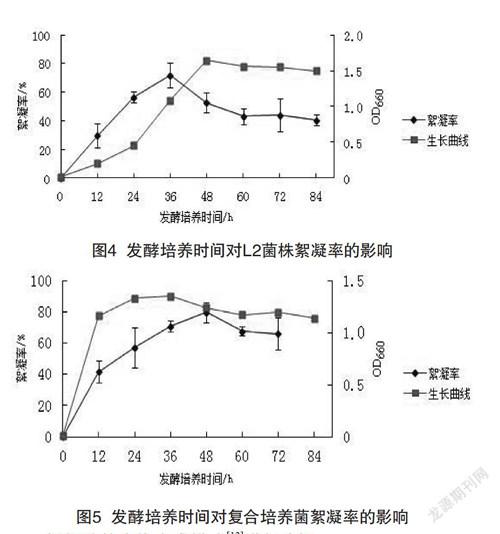
生长曲线如图2所示,N4和复合菌群都经过了短暂的停滞期,L2的停滞期较长(小于24 h),之后都进入了生长期,其中停滞期L2大于N4和复合菌群。初始阶段L2对培养条件和营养条件较不适应,经过一定的适应期后都能以较快的速度进行生长繁殖。复合菌株和N4在快速生长12 h达到了稳定期,菌体数目增长较为缓慢。而L2在摇床培养大约48 h后也进入了稳定期。经过稳定期后,菌体数量缓慢地下降,OD值降低,从单株和复合菌株可以分辨出生长过程的各个阶段。
实验在测定菌体生长曲线的同时也测定了菌液的絮凝活性,单一菌株和复合菌株的絮凝活性随培养时间的延长而发生变化。结果如图2~5所示。
根据酶的生物合成模式[13]进行分析:
(1)由图3可知,絮凝菌N4在0~24 h处于生长期,到48 h时处于平衡期,48 h之后开始慢慢地衰退。而絮凝率在平衡期时才大量合成,所以属于滞后合成型。在培养48 h时絮凝率达到最大值55.3%。
(2)由图4可知,絮凝菌L2在0~48 h处于生长期,在48 h后处于短暂的平衡期,之后处于衰退期。而絮凝率在此期间不断的增大,到36 h絮凝率达到最大值71.8%,在平衡期时絮凝率逐渐下降,所以属于同步合成型。
(3)由图5可知,将这两株菌种进行复合,在24 h时,絮凝菌处于平衡期,而此時絮凝率还在上升,48 h时达到最大值79.7%,所以经过复合,使其合成模式接近于延续合成型。
4.1.2 培养基初始pH对絮凝活性的影响
菌体细胞体系的氧化还原电位会被不同初始pH的培养基所改变,从而影响微生物体内的酶活性。不同的菌种生长的pH范围存在差异,产生絮凝剂所需发酵培养基的pH也不一样。由图6~8可知,絮凝活性随着pH的增大先增大后减小。
(1)N4在pH为6.0~8.0有较好的絮凝活性,最适pH=8.0。
(2)L2在pH为6.0~9.0絮凝活性较好,在pH=8.0絮凝率最大。
(3)复合菌在pH为6.0~9.0时絮凝活性较好,也是在pH=8.0时,絮凝率达到最大为85.8%,当pH=4.0和pH=10.0时絮凝活性最低。
复合菌在培养基的初始pH为中性偏碱的环境中所产絮凝剂的效率更高,在强酸和强碱条件下所产的絮凝剂效率低。
4.1.3 培养温度对絮凝活性的影响
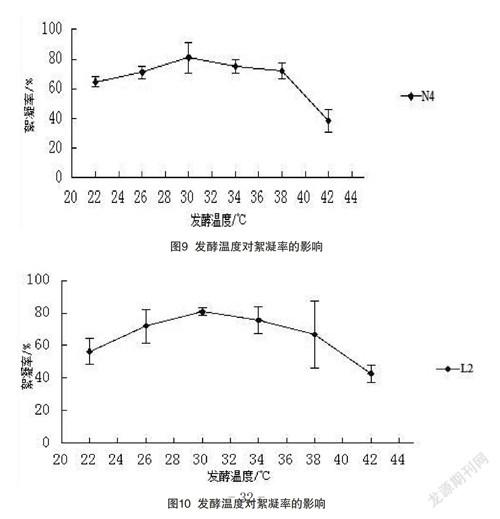
培养温度明显影响着微生物积累絮凝剂。温度是影响有机体生长与存活的重要因素。在一定范围内,机体的代谢活动与生长繁殖才会随着温度的上升而增加。而且酶的化学本质是蛋白质,高温受热时容易失活,过高或过低的温度均可能导致菌体内酶系统的作用方式发生转化,从而使微生物的代谢方式发生改变。
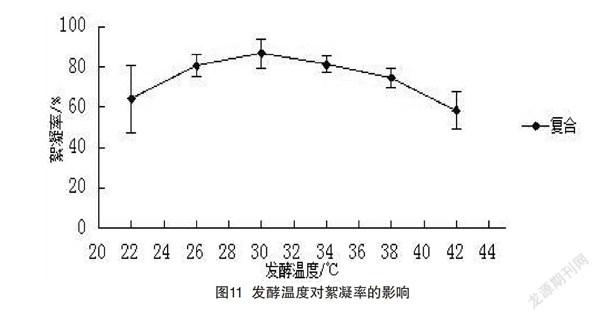
(1)由图9~10可知,N4和L2以及复合后的菌株变化趋势相似,温度由22 ℃升到30 ℃时,絮凝率逐渐升高,到30 ℃时,絮凝率达到最大值,N4的絮凝率为80.9%,L2的絮凝率为80.8%。
(2)由图11可知,复合培养菌的絮凝率达到86.6%。温度到30 ℃之后有所下降。38 ℃之后絮凝率下降得最快,由此可知,温度过高或过低都不适合酶的合成,较适合的培养温度为26~34 ℃,其中30 ℃为最佳培养温度,酶的活性最高。
4.2 培养条件的正交优化实验
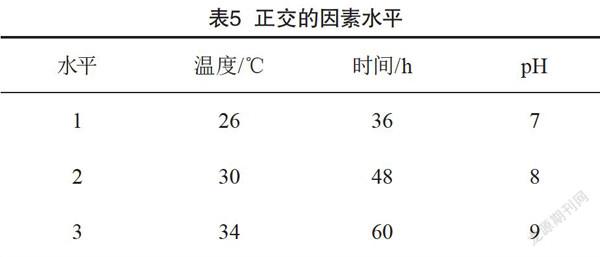
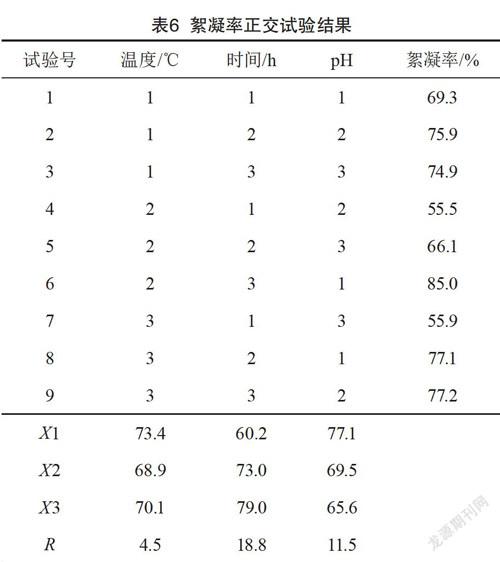
根据以上单因素试验的结果,培养时间、培养基初始pH、培养温度对实验结果有较显著的影响,它们之间可能存在交互作用,所以需要在单因素实验的基础上进一步采用正交实验优化培养条件。实验采用L9(34)方案法来设计正交实验。相对应的3个因素取为培养时间、培养温度和培养基初始pH,每个因素考察3个水平,通过9组正交培养实验,优化菌株培养条件,正交实验因素水平如表5所示。
由正交试验结果表6可知,最合适的培养条件是培养温度30 ℃,培养时间60 h,培养基的初始pH=7.0。絮凝率达到85.0%。模拟污泥的高岭土悬浊液液体呈白色混浊状,而加入复合菌后,液体澄清如图12所示。
对正交实验结果进行方差分析,得到结论:培养时间对絮凝活性的影响最大,在稳定期时絮凝效果较好(见表7)。pH在偏碱性环境条件下较适于复合菌产生絮凝物质,各因素对微生物絮凝剂絮凝效果影响程度大小的顺序为:培养时间、培养基的初始pH、培养温度。
4.3 对甲基橙废水的处理
在装有100 mL,pH=7.0的发酵液的250 mL三角瓶中,接入复筛得到的菌株,按照等比例(v/v)以2%的接种量混合培养,在30 ℃下培养60 h后,测其对甲基橙废水的脱色率。将1 mL培养液加入甲基橙废水中,振荡,使废水和培养废水充分混合,废水逐渐变浑浊,放置一段时间后颜色逐渐变浅,测其脱色率为25%。说明絮凝菌具有一定的脱色效果。
5 结语
选取学校垃圾箱旁边的土以及河边的淤泥为材料,以高岭土悬浮液进行絮凝效果的测定,筛选出絮凝效果好的菌株进行复合,并对其培养条件进行优化。结果显示:从平板中分离出109株表面潮湿、黏稠的单菌落,经过初筛,复筛得到絮凝活性最好的菌L2、L4、L25、N4;最后得到以L2和N4构建的复合菌群絮凝效果最佳。最后通过正交实验确定复合菌的最佳发酵条件为:在60 h发酵培养时间内,培养基的初始pH=7.0,发酵温度为30 ℃时絮凝效果最好。利用甲基橙测试絮凝菌的脱色率为25%。
目前,我国微生物絮凝剂应用于实际的工程比较少,研制和应用部分还处于初始阶段。微生物絮凝剂作为一种新型的水处理剂,具有安全、高效、可生物降解、不污染环境、可消除二次污染等特点,拥有了其他絮凝剂无法比拟的优点,微生物絮凝剂取代大部分传统的无机和合成有机高分子絮凝剂将成为一种趋势。从土壤中筛选出具有良好絮凝效果的絮凝菌,为环境中污水处理提供了一定的菌种资源,为廉价絮凝菌种的开发利用提供参考。
[参考文献]
[1]刘国军.图书馆目录[M].北京:中国社会科学出版社,1993.
[1]马洪芳,刘志宝.用铝盐絮凝剂处理含铬废水的研究[J].材料保护,2003(3):6-11.
[2]韩志新,赵晓祥.微生物絮凝剂对几种废水的测试及其机理的研究[D].上海:东华大学,2007.
[3]唐文伟,肖耀明,郝西平,等.生物法去除地下水中铁锰的研究进展[J].工业用水与废水,2009(6):14-17.
[4]张玉玲,张兰英,姚 军,等.高效复合型微生物絮凝剂研究[J].哈尔滨工业大学学报,2008(9):1 481-1 482.
[5]KURANE R,NOHATA Y. Microbial flocculation of waste liquids and oil emulsion by a bioflocculant from alcaligenes latus[J].Agricultural Chemical Society of Japan,1991(4):1 127-1 129.
[6]王雪婷.污水處理中絮凝剂的使用[J].经济技术协作信息,2017(9):79.
[7]张蔚萍,严 平,孙德四,等.一株可处理甲基橙废水的微生物絮凝剂的筛选及其脱色效果的研究[J].安徽农业科学,2011(36):22 544-22 548.
[8]李婵娟,严鹤松.微生物絮凝剂产生菌的筛选及其絮凝特性研究[J].湖北农业学,2014(14):3 284-3 285.
[9]陈 成,刘人荣,夏 祥,等.高效生物絮凝剂产生菌的筛选及培养优化[J].安徽农业科学,2018(6):52-54.
[10]孔 静,单爱琴,裴宗平,等. 微生物絮凝剂产生菌的筛选及培养条件的优化[J].广州化工,2012(23):50-51.
[11]张志强,林 波,夏四清,等. 复合菌群的构建及其所产微生物絮凝剂的动力学研究[J].环境工程学报,2007(1):74-77.
[12]常玉广,马 放,王博,等.高效絮凝菌的鉴定及絮凝特性研究[J].哈尔滨工业大学学报,2010(10):1 609-1 613.
[13]郭 勇.酶工程[M].北京:科学出版社,2000.
[14]沈 越.新型高效微生物絮凝剂在废水处理中的应用[J].环境保护与循环经济,2012(4):51-54.
[15]于海波.微生物絮凝剂用于废水的研究及其应用[J].山西建筑,2011(11):127-128.
