8株木霉菌挥发性代谢产物对玉米种子的促生作用研究
2019-09-10黄竹姚艳平
黄竹 姚艳平



文章编号: 1005-2690(2019)04-0143-03 中图分类号: S436.801 文献标志码: B
摘 要:研究了8株木霉菌挥发性代谢产物对玉米种子的促生效果,筛选有较强生防潜力的菌株,为研究新型木霉生物药剂提供理论基础。采用挥发性代谢产物密封培养法对种子进行促生试验,研究表明:由8株木霉菌挥发性代谢产物处理的玉米种子的根长与对照在F=0.05水平上差异显著;康氏木霉T4在对玉米种子的促生试验中均表现良好,且在第4天促生率高达87.4%,处理12 d后玉米幼苗地上、地下部分的促生率分别为78.9%、55.3%,干湿重的促生率为16.9%、31.3%,故研究筛选此株木霉菌以作进一步研究。
关键词:木霉菌;挥发性代谢产物;玉米;种子;促生作用
木霉菌(Trichoderma Pers)是一种常见的、具有广泛环境适应性和抑菌广谱性的丝状真菌[1]。目前,已有多种木霉被开发利用,成为被大范围使用的生物菌剂。其促生效果主要表现为提高作物的发芽率、增加植株高度、降低植株的倒伏率、增大叶片面积、使作物提前开花等[2,3]。对植株的促生机制主要是与植株的共生及其产生代谢产物的影响作用,包括产生植物生长调节剂、增加养分利用率、抑制或降解根际有害生物[4]。
木霉菌可以产生多种次级代谢产物,一直以来对其挥发性代谢产物拮抗病原菌的研究较多[5~7],关注对植株促生效果的研究较少。木霉等微生物的挥发性代谢产物多为亲脂性化合物,具有低分子量(<300 g/mol)、低沸点和高蒸气压的特点,能够作为短距离和长距离的信号分子[8]。其可以吸附、解吸或直接与黏土表面反应,也可以直接穿过根际的土壤、水或空气来发挥作用。且种类繁多,包括烷类、酯类、烯类、醇类、酮类、苯类、醚类等。其中6-戊基-2H-吡喃-2-酮、3-羟基-2-丁酮(乙酰丙酮)、2,3-丁二醇、2-戊基呋喃等已被发现在根或叶上的促生能力[9]。Farnaz Jalali等研究发现木霉菌挥发性代谢产物可以促进
拟南芥的生长和诱导其耐盐碱能力的产生[10]。同样Samantha
Lee发现其研究木霉菌的揮发性代谢产物均可增加拟南芥生物和叶绿素含量。另外,用挥发性有机物(VOCs)处理番茄,其植株生物量显著增加(>99%),且植株较大、侧根发育明显[11]。
近年来,有多种微生物的挥发性代谢产物被研究和测定,有望成为化学药剂的更加有效的环境友好型替代品。木霉菌挥发性代谢产物对植物生长影响的研究较少,所以有必要寻找挥发性有机化合物在蔬菜、水果、粮食上有良好促生效果的菌株,以期作为一种可持续应用减少化学物质使用的生物制品。
1 材料与方法
1.1 试验材料
1.1.1 供试植物种子
玉米种子由山西农业大学实验室提供。
1.1.2 供试木霉菌株
长枝木霉T1(Trichoderma longibrachiatum.)、绿木霉T2(Trichoderma viride)、哈茨木霉T3(Trichoderma harzianum)、康氏木霉T4(Trichoderma koningii)、绿木霉T5(Trichoderma viride.)、绿木霉T6(Trichoderma viride.)、哈茨木霉T7(Trichoderma harzianum)、木霉T8(Trichoderma spp.)。
1.2 试验方法
1.2.1 种子的预处理方法
挑选饱满、一致性好的玉米种子,用5%次氯酸钠消毒10 min,之后用无菌水冲洗干净,再浸泡48 h。
1.2.2 木霉菌的培养
PDA培养基、25 ℃无水恒温培养箱培养5 d,以供下一步操作。
1.2.3 木霉菌挥发性代谢产物对种子及幼苗的促生作用
采用挥发性代谢产物密封培养法,将木霉与预处理过的种子共同放入培养容器内25 ℃恒温黑暗培养,分别于第2、3、4天,测量种子根长与芽长。第4天测量完毕后,每处理选取10粒种子放在铺有湿润滤纸的培养皿中,与木霉平板一起置于干燥器中密封保湿,7 d后统计幼苗的地上、地下部长度、湿重、80 ℃烘干至恒重后测定幼苗干重。
1.3 数据处理与统计分析
试验数据处理公式如下:
芽长促生率=■×100%
根长促生率=■×100%
采用SPSS 18.0软件进行试验数据统计分析。
2 结果与分析
2.1 木霉挥发性代谢产物对玉米种子生长的影响
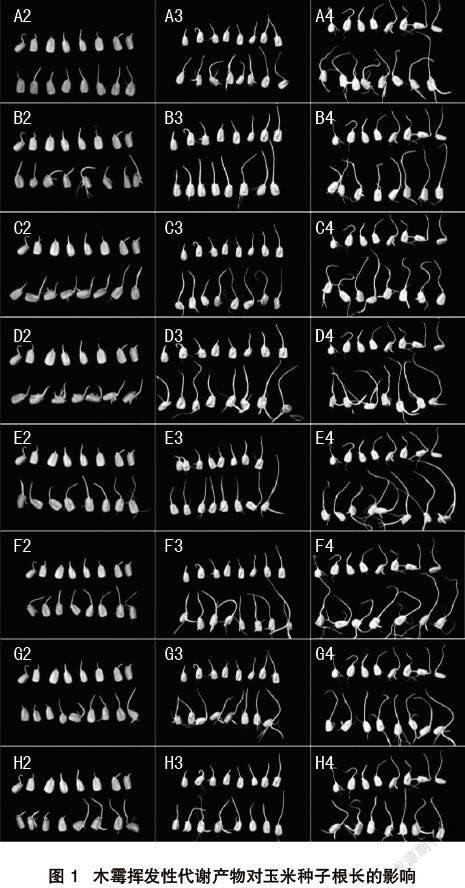
从图1和表1数据可以观察到,8株木霉处理的玉米种子根长与CK根长差异显著。除T1、T3、T6、T8在第3天的促生率最低随后上升外,其余4株木霉的促生率均在第2天达到最大值后下降。处理第2天,木霉T4和木霉T6的根长分别为18.4 mm、19.0 mm,促生率分别达到了121.7%、128.9%。处理第3天,木霉T4的根长为42.6 mm,促生率为101.9%,显著地高于其他7株木霉的促生率。处理第4天,木霉T4、T5、T6的促生率分别达到了87.4%、75.8%、82.1%。
2.2 木霉挥发性代谢产物对玉米幼苗生长的影响
由图2可知,8株木霉处理幼苗12 d后,除木霉T5外,其余7株木霉处理后的幼苗根长与CK均有显著差异。木霉T4、T7处理后幼苗的根长分别达到213.4 mm、222.5 mm,促生率达到78.9%、86.2%;受木霉T4、T8的影响,幼苗根长促生率达到55.3%、52.4%。除木霉T1、T2、T3、T6处理外,其余4株木霉处理后茎叶与CK差异显著。其中T4与T8的茎叶长度达到163.4 mm、159.4 mm,促生率为55.3%、51.5%。
2.3 木霉挥发性代谢产物对玉米幼苗干湿重的影响
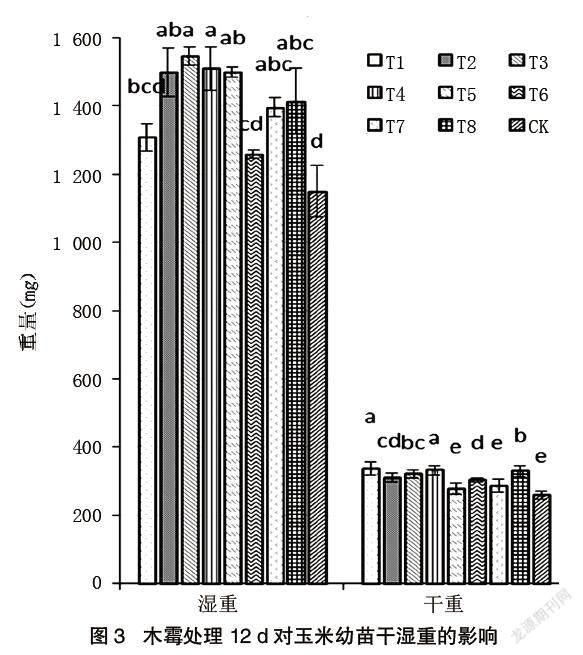
由图3可知,木霉培养12 d后,除T1、T6外,玉米幼苗的湿重均显著高于对照幼苗的湿重。木霉T2、T3、T4的湿重为1 498.8 mg、1 546.1 mg、1 499.7 mg,促生率分别高达30%、34%、30%。除T5、T7外,玉米幼苗的干重显著高于对照幼苗的干重,湿重的促生率在9%~34%之间,干重的促生率在-3%~18%之间。木霉T1、T4处理后,玉米干重分别为336.5 mg、331.3 mg,促生率分别为18%、16%。
3 结论与讨论
3.1 结论
(1)通过8株木霉菌对玉米种子促生作用的研究,发现在种子生根发芽阶段,康氏木霉T4对玉米种子的根长促生效果最好,第2、3、4天的根长分别为18.4 mm、42.6 mm、56.6 mm,促生率分别为121.7%、101.9%、87.4%。同时此阶段木霉处理下的种子生出大量须根,而对照种子须根较少或没有。
(2)幼苗阶段,康氏木霉T4对玉米幼苗地上、地下部分的促生率分别为78.9%、55.3%。且木霉T4在幼苗湿重、干重的促生效果方面均表现良好,促生率分别为30%、16%。综合来看,康氏木霉T4是具有较强生防潜力的菌株。
3.2 讨论
由于各个木霉菌生长活跃的时间和挥发性产物暴露时间有差异,木霉的促生机制复杂[12~13],通常因其菌株、种类、寄主植物等的不同而不同,且不同木霉产生的挥发性代谢产物的种类和含量也不同[14~15],对不同种子的物质积累可能也效果不同,导致8株木霉对玉米幼苗干湿重影响的数据出现差异。此结论与Samantha Lee得出的结论相同。而导致干重与湿重之间促生率差距的原因可能是木霉菌的挥发性代谢产物促进幼苗生长的部位不同,导致其积累的物质不同。所以,木霉菌挥发性代谢产物对植物的促生机制、生防效果尚需进一步的研究和探索。
参考文献:
[ 1 ] 郭润芳,刘晓光,高克祥,等. 拮抗木霉菌在生物防治中的应用与研究进展[J]. 中国生物防治学报,2002,18(04):180-184.
[ 2 ] 谢琳淼,常春丽,姚志红,等. 哈茨木霉对紫羊茅和草地早熟禾的促生及抗性诱导作用[J]. 草业科学,2018,35(09):2 079-2 086.
[ 3 ] Lee S ,Yap M , Behringer G , et al. Volatile organic compoundsemitted by Trichoderma species mediate plant growth[J]. FungalBiology and Biotechnology,2016,03(01):7.
[ 4 ] Pascale A ,Vinale F , Manganiello G,et al. Trichoderma andits secondary metabolites improve yield and quality of grapes[J].Crop Protection,2017(92):176-181.
[ 5 ] 陳德强,谭志琼,张荣意. 香蕉枯萎病菌拮抗木霉的筛选[J].中国南方果树,2012,41(02):74-77.
[ 6 ] 赵阿娜.木霉菌剂防治人参根部病害研究及木霉田间种群动态监测[D]. 北京:中国协和医科大学,2006.
[ 7 ] 张雯雯. 木霉菌株挥发性物质拮抗尖孢镰刀菌的效果及其鉴定[J]. 热带作物学报,2017,38(04):704-715.
[ 8 ] Kanchiswamy C N,Malnoy M,Maffei M E.Bioprospecting bacterialand fungal volatiles for sustainable agriculture[J]. Trends in PlantScience,2015,20(04):206-211.
[ 9 ] Fincheira P,Quiroz,Andrés. Microbial volatiles as plant growthinducers[J]. Microbiological Research,2018(208):63-75.
[ 10 ] Jalali F,Zafari D,Salari H.Volatile organic compounds of someTrichoderma spp. increase growth and induce salt tolerance inArabidopsis thaliana[J]. Fungal Ecology,2017(29):67-75.
[ 11 ] Lee S ,Hung R ,Yap M ,et al. Age matters:the effects of volatile organic compounds emitted byTrichoderma trovirideon plant growth[J]. Archives of Microbiology,2015,197(05):723-727.
[ 12 ] Lee S, Hung R,Schink A,et al. Arabidopsis thaliana,for testingthe phytotoxicity of volatile organic compounds[J]. Plant Growth Regulation,2014,74(02):177-186.
[ 13 ] 斯琴巴特尔,吴红英.盐胁迫对玉米种子萌发及幼苗生长的 影响[J].干旱区资源与环境,2000,14(04):76-80.
[ 14 ] Stoppacher N,Kluger B,Zeilinger S,et al. Identification and profiling of volatile metabolites of the biocontrol fungus Tricho- derma atroviride by HS-SPME-GC-MS.[J]. Journal of Micro- biological Methods,2010,81(02):187-193.
[ 15 ] Marek N,Lucia,Jakubíková,et al. Induc- tion of conidiation by endogenous volatile compounds in Trichoderma spp.[J].Fems Microbiology Letters,2010,284(02):231- 236.
(收稿日期:2019-03-18)
